流产衣原体CPAF基因的克隆序列分析及原核表达
刘 萍,马晓霞,周小凯,马 鹏,常秋燕,李林杰,李凌浩,马忠仁
(1.西北民族大学 生物工程与技术国家民委重点实验室,甘肃 兰州 730030;2.甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030;3.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
衣原体是一类严格寄生于细胞内,可感染多种动物和人并引起疾病的原核微生物。衣原体科(Chlamydiaceae)仅含1个属,即衣原体属,共有12个已明确鉴定的种,包括以人为天然宿主的沙眼衣原体(C.trachomatis)、肺炎衣原体(C.pneumoniae)和以动物为天然宿主的鹦鹉热衣原体(C.psittaci)、流产衣原体(C.abortus)、鼠衣原体(C.muridarum)、猪衣原体(C.suis)、家畜衣原体(C.pecorum)、猫衣原体(C.felis)、豚鼠衣原体(C.caviae)、野鸟衣原体(C.avium)、家禽衣原体(C.gallinacea)以及朱鹭衣原体(C.ibidis)[1]。这些衣原体物种具有相同的生活周期,包括感染和在细胞内增殖2个阶段。衣原体的原生小体(Elementary body,EB)代谢不活跃但具有感染性。游离的EB附着在宿主细胞表面后,通过胞吞作用进入细胞并形成包涵体(Inclusion),在包涵体内EB转变为代谢旺盛的网状体(Reticulate body,RB),RB通过二分裂的方式增殖。经过一定时间的增殖,RB重新转变为EB并释放到细胞外完成其发育周期[2-3]。在感染和增殖过程中,衣原体编码的多种蛋白可分泌到宿主细胞的细胞浆中并随成熟的EB颗粒释放到细胞外,这些分泌性的衣原体蛋白分子与宿主细胞之间发生复杂的相互作用,对于衣原体的感染和增殖具有重要意义,同时也与衣原体的致病机制密切相关[4-5]。
衣原体蛋白酶样活性因子(Chlamydial protease like activity factor,CPAF)是由衣原体合成并分泌到宿主细胞内的蛋白,是衣原体和宿主之间相互作用的重要分子之一[6-7]。沙眼衣原体的CPAF能选择性降解由上皮细胞和嗜中性粒细胞产生的抗菌肽LL-37以及具有抗衣原体活性的其他活性肽,从而增加沙眼衣原体的感染力和致病性[8]。肺炎衣原体的CPAF可能与肺炎衣原体的致病性密切相关,重组肺炎衣原体的CPAF能引起BALB/c小鼠肺组织的炎症损伤和炎症因子TNF-α和IL-6水平的升高[9]。另外,CPAF具有很强的免疫原性,其抗原性明显强于MOMP和HSP60,可以作为衣原体诊断和疫苗的候选抗原[4,10]。
流产衣原体是绵羊地方性流产(Enzootic abortion of ewes)的主要病原,在全世界范围内广泛分布,能够引起猪、牛、羊等多种动物发生流产、死胎、弱胎等慢性接触性疾病,也能够感染人类,导致孕妇流产,是一种重要的人畜共患病病原[11-13]。近年来,动物流产衣原体病在我国时有发生,对养殖业造成了较大的经济损失[14-15]。由于流产衣原体感染的动物通常症状表现不明显,容易被忽视,而在妊娠后期导致动物流产[12]。早期诊断和疫苗免疫是防控动物流产衣原体病最有效的措施,然而,目前尚无针对流产衣原体病的商品化疫苗。因此,有必要建立特异性高、灵敏性好的流产衣原体抗体检测方法。
本试验对流产衣原体的CPAF编码基因进行克隆并原核表达,为动物流产衣原体病诊断方法的建立奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 菌种和质粒 流产衣原体菌株(GN6)基因组由兰州兽医研究所李兆才博士惠赠,pMD18T为大连宝生物工程有限公司产品,感受态细胞DH5α、表达菌株BL21(DE3)以及pET30a质粒均由西北民族大学细胞工程中心保存。
1.1.2 主要试剂 2×Ex Taq Master Mix、DNA标准分子量(DL2000)、T4DNA连接酶、限制性内切酶等购自大连宝生物工程有限公司;蛋白质标准分子量(Blueplus Ⅱ Protein Marker)购自北京全式金生物技术有限公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG、IPTG分别购自北京博奥森生物技术有限公司和Sigma公司;Ni-NTA Superflow购自QIAGEN公司;咪唑购自 BioTech公司。
1.1.3 流产衣原体阳性血清 以流产衣原体GN6菌株感染新西兰大白兔制备阳性血清。
1.2 试验方法
1.2.1 引物设计 根据流产衣原体GN6菌株全基因序列(CP021996)[16],设计用于扩增流产衣原体CPAF的编码基因的引物,上游引物为:5′-GAACATATGAAGCTAAAACAAATTACAGTC-3′(下划线为NdeⅠ酶切位点);下游引物为:5′-GTACTCGAGCGACTCAGTGATTTTGTCTGC-3′(下划线为XhoⅠ酶切位点)。引物由上海生工生物科技有限公司有限公司合成,-20oC保存,备用。以该引物扩增所得目的片段长度为1 809 bp。
1.2.2 CPAF编码基因的扩增与克隆 以流产衣原体GN6株基因组为模板,PCR扩增流产衣原体CPAF的编码基因。回收纯化目的基因片段,将其连接到pMD18T上,筛选阳性克隆,将目的片段正确连接的质粒命名为pMD18T-CPAF。
1.2.3 原核表达载体的构建及鉴定 以NdeⅠ和XhoⅠ双酶切pMD18T-CPAF和pET30a空载体;琼脂糖凝胶电泳并回收目的基因和线性化的pET30a载体。将回收的CPAF基因片段与载体片段用T4DNA连接酶于16 ℃过夜连接。筛选阳性克隆,送上海生工生物工程有限公司测序。
1.2.4 重组蛋白的诱导表达、纯化及鉴定 鉴定为阳性的重组表达载体命名为pET30-CPAF,将其转化表达菌BL21(DE3)感受态细胞,挑取单克隆,过夜培养后转接到10 mL LB培养液中,继续培养至菌液OD值为0.8左右,加入IPTG(终浓度为1.0 mmol/L)诱导目的基因表达。在诱导过程中每小时收集菌体一次,用SDS-PAGE检测目的蛋白表达情况,优化诱导条件。最后收集诱导后菌体,经超声破碎后,取上清液和沉淀,与300 μL Ni-NTA Superflow混匀,4oC过夜,再用咪唑缓冲液洗脱,获得纯化的蛋白。将纯化的蛋白进行SDS-PAGE检测。
1.2.5 重组蛋白的Western Blot分析 将表达产物进行SDS-PAGE后,转印于PVDF膜上。PVDF膜用5%脱脂奶粉封闭后与稀释于2%脱脂奶粉流产衣原体阳性血清4 ℃过夜孵育,PBST洗膜,再与稀释于2%脱脂奶粉的HRP标记羊抗兔IgG孵育2 h,PBST洗涤,滴加ECL工作液,暗室压片曝光。
2 结果与分析
2.1 PCR扩增结果及重组原核表达载体的鉴定
以流产衣原体GN6菌株基因组为模板,经PCR扩增得到1 800 bp左右的CPAF编码基因,与预期大小相符。重组质粒pET30-CPAF经NdeⅠ和XhoⅠ双酶切,酶切产物经琼脂糖凝胶电泳后出现1 809 bp的目的条带和5 240 bp的载体条带,说明重组表达构建成功(图1)。
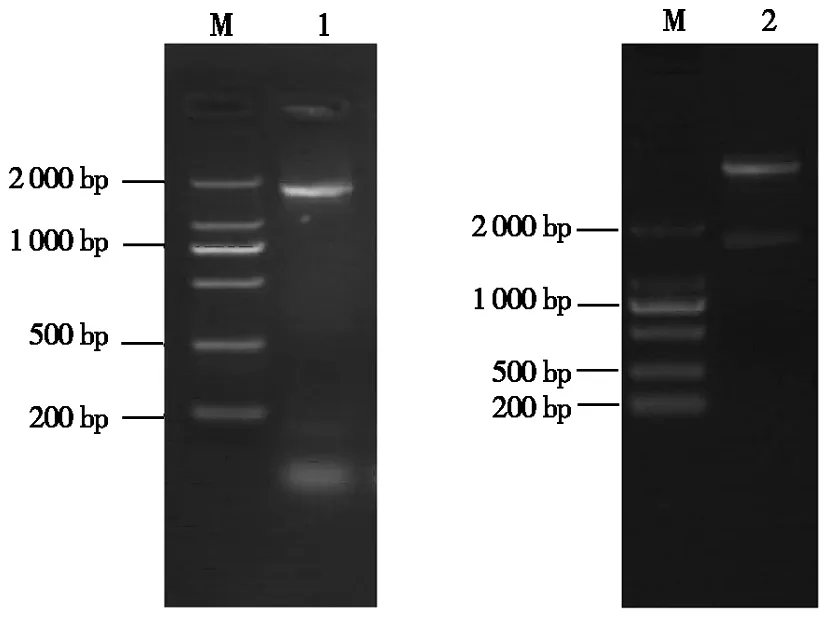
M.DL2000 Marker;1.CPAF基因扩增产物;2.pE30-CPAF经NdeⅠ和XhoⅠ双酶切。M.DL2000 Marker;1.Amplification of CPAF gene;2.pET30-CPAF digested using NdeⅠ and XhoⅠ.
2.2 CPAF编码基因的序列分析及蛋白质的结构预测
测序结果显示,所克隆的CPAF编码基因与流产衣原体标准菌株S26/3(NC_004552.2)及我国分离株GN6(CP021996.1)全基因组序列中的CPAF编码基因核苷酸序列100%符合,表明基因克隆正确。利用在线软件预测CPAF的氨基酸序列,结果显示,流产衣原体CPAF分子由603个氨基酸残基组成,相对分子质量为67.6 ku,理论等电点是5.79,理论推导半衰期大于30 h,属于稳定蛋白质。N端前23个氨基酸残基组成的多肽可能是该蛋白的信号肽,最可能的定位是在宿主细胞的细胞质,C端含有2个保守的S41蛋白酶超家族(Petidase_S41 superfamily)结构域,与其在沙眼衣原体和肺炎衣原体中的同系物一致[4,10],推测其同样具有蛋白水解酶活性。将衣原体属成员具有2个保守的S41蛋白酶超家族(Petidase_S41 superfamily)结构域的基因进行系统发育分析,结果显示,衣原体各物种的CPAF同系分子序列可分为3类:沙眼衣原体和鼠衣原体聚为一类,它们具有相似的组织嗜性和病理过程;肺炎衣原体和家畜类衣原体聚为一类,它们具有相似的组织嗜性和病理过程;流产衣原体、鹦鹉热衣原体、猫衣原体、豚鼠衣原体和家禽衣原体聚为一类,它们的亲缘关系更近(图2)。进一步利用SWISS-MODEL 软件源建模得到的流产衣原体CPAF分子高级结构预测,结果显示,在25-592位可形成高级结构,其高级结构与沙眼衣原体CPAF 的X 射线衍射晶体结构十分相似(图3)。因此推测,流产衣原体的CPAF分子在其组织嗜性、致病过程以及其本身适应宿主细胞等方面发挥重要作用。
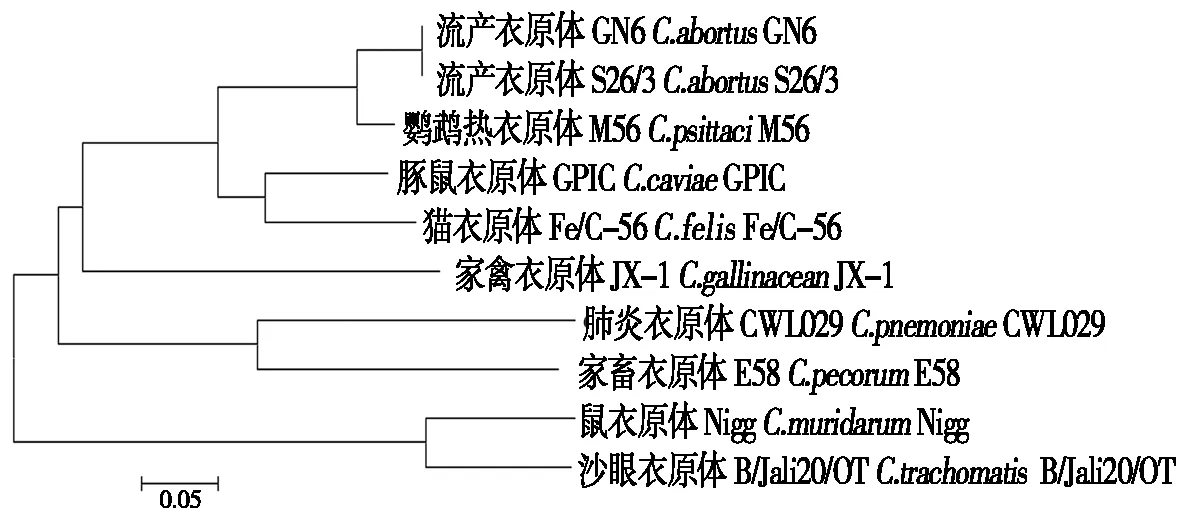
图2 衣原体CPAF同系分子亲缘关系Fig.2 Phylogenetic analysis of CPAFs in Chlamydial species

A.流产衣原体CPAF;B.沙眼衣原体CPAF。A.CPAF of Chlamydia abortus;B.CPAF of Chlamydia trachomatis.
对流产衣原体CPAF的亲水性分析表明,该蛋白在第46-80位,154-168位,191-215位,257-343位,408-429位,437-454位,467-476位,562-576位,584-603位的氨基酸残基处有较高的亲水性;由抗原表位分析图4可知,流产衣原体CPAF在第19-25位,46-56位,59-81位,115-121位,131-142位,150-167位,191-215位,228-235位,241-247位,260-298位,304-312位,325-344位,348-367位,376-389位,407-427位,445-454位,467-475位,483-502位,522-547位,584-603位可能存在抗原表位(图4)。
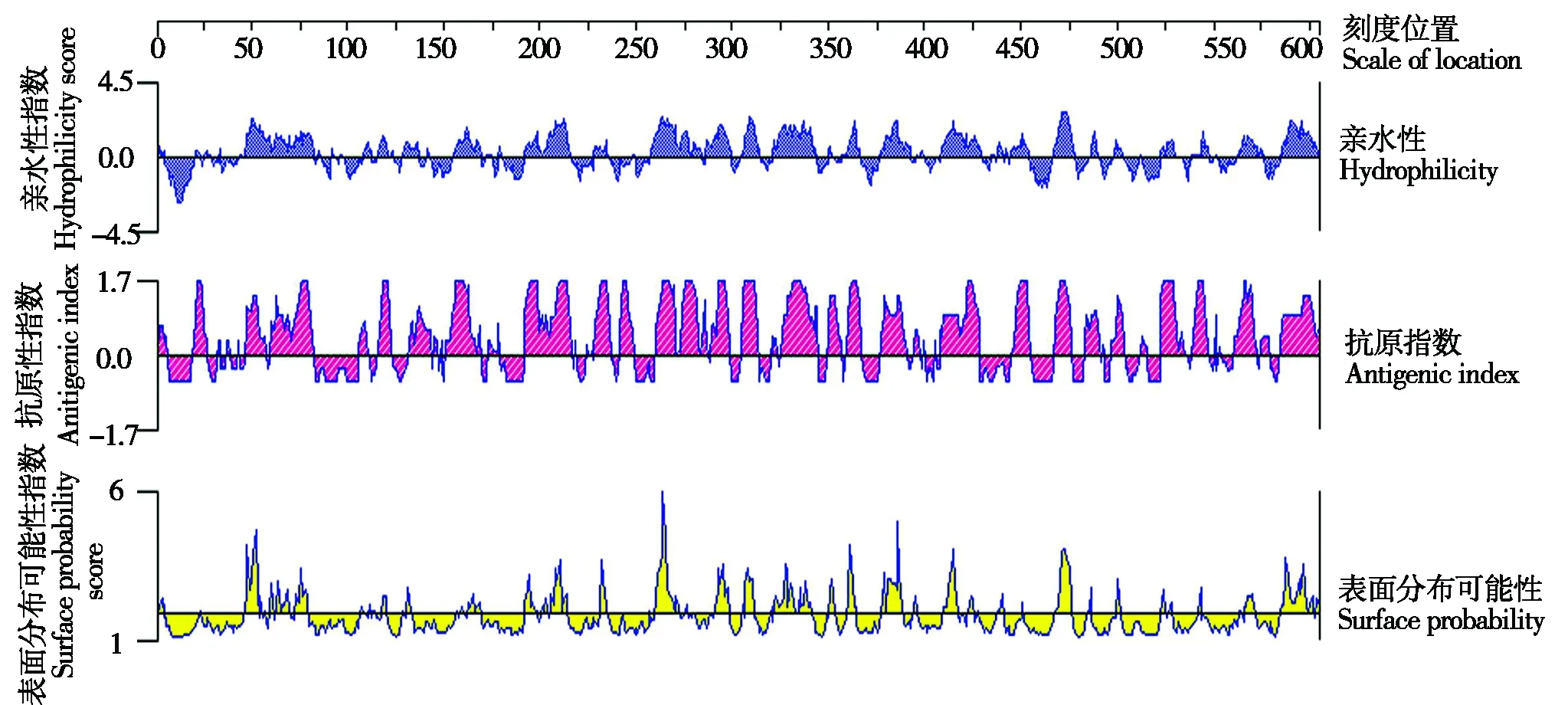
图4 流产衣原体CPAF氨基酸序列的亲水性、抗原指数和表面分布可能性分析Fig.4 Analysis of hydrophilicity,antigenic index and surface probability of CPAF protein amino acid
2.3 重组蛋白诱导表达条件的优化
用终浓度为1 mmol/L的IPTG诱导不同时间(1~5 h),SDS-PAGE结果显示,在诱导1 h后重组CPAF蛋白表达量即明显增加,在3 h时表达量最大(图5);未诱导对照组则没有重组蛋白的表达。
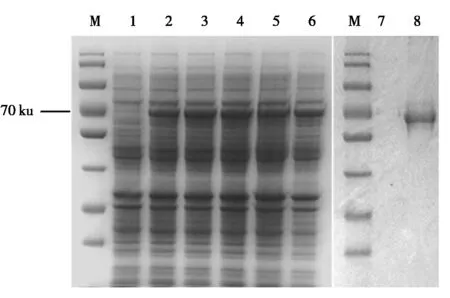
M.蛋白分子质量标准;1.未诱导的pET30-CPAF;2~6.分别诱导1~5 h的pET30-CPAF;7~8.分别从未诱导和诱导的细胞中纯化的重组CPAF蛋白。
M.Protein Marker;1.Uninduced cells containing pET30-CPAF;2-6. Cells containing pET30-CPAFinduced for 1-5 h respectively;7-8.Purified recombinant CPAF from uninduced and induced cells containing pET30-CPAFrespectively.
图5重组CPAF的诱导表达及纯化
Fig.5ExpressioninductionandpurificationofrecombinantCPAF
2.4 重组蛋白的Western Blot分析
Western Blot结果显示,重组流产衣原体CPAF蛋白能与抗His标签单克隆抗体和流产衣原体阳性血清发生特异性反应(图6)。

M.蛋白分子量标准;1.pET-30a对照菌;2.重组CPAF与His-tag抗体反应;3.pET-30a对照菌;4.重组CPAF与流产衣原体阳性血清反应。M.Protein Marker;1.pET-30a control;2.Reaction of recombinant CPAF with His-tag anibody;3.pET-30a control;4.Reaction of recombinant CPAF with positive serum.
3 讨论
流产衣原体主要寄生于多种动物的生殖系统黏膜上皮细胞中,引起母畜流产、产死胎或弱仔胎,公畜生殖系统炎症等慢性接触性传染病[17]。因流产衣原体感染引起家畜流产在全世界范围内每年都有发生,给全球畜牧业的发展都造成了较为严重的影响[18-20]。在我国,流产衣原体引起绵羊、奶牛、牦牛、猪等家畜流产的报道较多,由此造成经济损失十分严重[14-15]。目前,国内外关于衣原体感染及致病等的研究主要集中在感染人的沙眼衣原体和肺炎衣原体上。沙眼衣原体的CPAF曾被认为能够降解细胞内与凋亡、抗原呈递及炎症反应等相关的关键蛋白,在一定程度上揭示了衣原体与宿主细胞互作及致病机制[21-23]。但目前的研究表明,CPAF可中和补体,降解细胞外抗菌肽,增加沙眼衣原体的感染力和致病性[7-8]。沙眼衣原体CPAF在衣原体各物种间均存在同系分子,流产衣原体的CPAF分子为CAB712基因编码的一个假定蛋白,其蛋白质一级结构与沙眼衣原体和肺炎衣原体的CPAF同源性均为50%左右,N端具有分泌型信号肽,C端具有一个蛋白酶活性结构域,据此推测,它们可能具有相同的生物学功能。因此,深入研究流产衣原体CPAF分子的生物学功能对于揭示流产衣原体的感染及致病机制具有重要意义。另外,研究也表明,流产衣原体的CPAF可与感染流产衣原体的绵羊血清发生特异性免疫反应[24],提示该分子可作为动物流产衣原体病的血清学诊断及亚单位疫苗研究的候选抗原分子。
本研究成功克隆流产衣原体GN6株CPAF全长编码基因,在线生物软件预测显示,流产衣原体CPAF蛋白具有较高的亲水性,含有多个可能抗原表位,可作为临床上诊断流产衣原体血清抗体的理想抗原使用。pET-30a(+)为高效原核表达载体,将外源基因插入其NdeⅠ和XhoⅠ之间,所表达的融合蛋白中仅引入一个His标签,既为融合蛋白的纯化提供保障,又不会额外引入冗余的抗原成分,可最大限度地表达抗原。本试验将流产衣原体CPAF编码基因连接在pET-30a原核表达载体中,使其与载体末端His-Tag同框融合,成功构建了原核表达载体,并在宿主菌BL21(DE3)中成功诱导表达。通过对诱导条件的优化,确定诱导表达的最佳条件为IPTG终浓度1 mmol/L,诱导3 h,可大量获得重组目的蛋白。Western Blot检测显示,重组蛋白能与抗His-Tag的单克隆抗体特异性结合,也能与流产衣原体阳性血清特异性结合,在胶片上显示出一条特异性条带,这表明重组蛋白具有良好的反应原性。本试验为建立动物流产衣原体病的血清学检测方法提供一种候选抗原。
近年来,动物衣原体性流产在我国的发生率有逐年增加的趋势,尽管已有成功研制的衣原体疫苗,但尚未在市场上流通,动物衣原体性流产疫情的防控形势不容乐观,因此,疫病的诊断就显得尤为重要。目前,在我国用于动物衣原体病的临床诊断方法主要为间接血凝试验(Indirect haemagglutination assay,IHA)[25]。国内也有以流产衣原体主要外膜蛋白(MOMP)等为抗原开发的ELISA方法,但尚未在临床上推广使用。国外也有以流产衣原体多形外膜的蛋白(POMP)为抗原的针对牛、羊的流产衣原体ELISA试剂盒,可用于临床大规模检测[26]。而成本低、特异性高、操作简便对动物疫病的诊断非常重要。CPAF蛋白的抗原稳定性高,基因在种内高度保守,可作为流产衣原体的特异性检测抗原使用。所以本试验对我国流产衣原体分离株(GN6)的CPAF编码基因序列进行克隆、分析及原核表达,旨在为将来建立动物流产衣原体病的血清学诊断方法奠定基础。
参考文献:
[1] Sachse K,Bavoil P M,Kaltenboeck B,et al. Emendation of the family Chlamydiaceae:proposal of a single genus,Chlamydia,to include all currently recognized species[J]. Systematic and Applied Microbiology,2015,38(2):99-103.
[2] Hybiske K,Stephens R S. Mechanisms of host cell exit by the intracellular bacterium Chlamydia[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(27):11430-11435.
[3] Hybiske K,Stephens R S. Mechanisms ofChlamydiatrachomatisentry into nonphagocytic cells[J]. Infection and Immunity,2007,75(8):3925-3934.
[4] Zhong G,Fan P,Ji H,et al. Identification of a Chlamydial protease-like activity factor responsible for the degradation of host transcription factors[J]. The Journal of Experimental Medicine,2001,193(8):935-942.
[5] Zhong G.Chlamydiatrachomatissecretion of proteases for manipulating host signaling pathways[J]. Frontiers in Microbiology,2011,2:14.
[6] Jorgensen I,Bednar M M,Amin V,et al. TheChlamydiaprotease CPAF regulates host and bacterial proteins to maintain pathogen vacuole integrity and promote virulence[J]. Cell Host & Microbe,2011,10(1):21-32.
[7] Yang Z,Tang L,Zhou Z,et al. Neutralizing antichlamydial activity of complement byChlamydia-secreted protease CPAF[J]. Microbes and Infection,2016,18(11):669-674.
[8] Tang L,Chen J,Zhou Z,et al.Chlamydia-secreted protease CPAF degrades host antimicrobial peptides[J]. Microbes and Infection,2015,17(6):402-408.
[9] 王华丽,吴移谋,郑江花,等. 肺炎嗜衣原体CPAF重组蛋白致小鼠肺组织炎症及对炎症细胞因子的影响[J]. 中国免疫学杂志,2011,27(4):308-311.
[10] Zheng J,Ding T,Chen Z,et al. Preparation and evaluation of monoclonal antibodies against chlamydial protease-like activity factor to detectChlamydiapneumoniaeantigen in early pediatric pneumonia[J]. European Journal of Clinical Microbiology & Infectious Diseases,2015,34(7):1319-1326.
[11] Barati S,Moori-Bakhtiari N,Najafabadi M G,et al. The role of zoonotic chlamydial agents in ruminants abortion[J]. Iranian Journal of Microbiology,2017,9(5):288-294.
[12] Softic A,Asmare K,Granquist E G,et al. The serostatus ofBrucellaspp.,Chlamydiaabortus,CoxiellaburnetiiandNeosporacaninumin cattle in three cantons in Bosnia and Herzegovina[J]. BMC Veterinary Research,2018,14(1):40.
[13] Walder G,Hotzel H,Brezinka C,et al. An unusual cause of sepsis during pregnancy:recognizing infection withChlamydophilaabortus[J]. Obstetrics and Gynecology,2005,106(5 Pt 2):1215-1217.
[14] Li Z,Cao X,Fu B,et al. Identification and characterization ofChlamydiaabortusisolates from yaks in Qinghai,China[J]. BioMed Research International,2015:658519.
[15] Hu S F,Li F,Zheng W B,et al. Seroprevalence and risk factors ofChlamydiaabortusinfection in goats in Hunan province,subtropical China[J]. Vector Borne and Zoonotic Diseases,2018:2183.
[16] Entrican G,Wattegedera S,Wheelhouse N,et al. Immunological paradigms and the pathogenesis of ovine chlamydial abortion[J]. American Journal of Reproductive Immunology,2010,64(4):287-294.
[17] Li Z,Cai J,Cao X,et al. Whole-Genome sequence ofChlamydiaabortusStrain GN6 isolated from aborted yak fetus[J]. Genome Announcements,2017,35(5):e00817-e00893.
[18] Wheelhouse N,Sait M,Wilson K,et al. Expression patterns of five polymorphic membrane proteins during theChlamydiaabortusdevelopmental cycle[J]. Veterinary Microbiology,2012,160(3/4):525-529.
[19] Chisu V,Porcu R,Tanda A,et al. First isolation and characterization ofChlamydophilaabortusfrom abortion tissues of sheep in Sardinia,Italy[J]. Veterinaria Italiana,2013,49(4):331-334.
[20] Hireche S,Bouaziz O,Djenna D,et al. Seroprevalence and risk factors associated withChlamydophilaspp. infection in ewes in the Northeast of Algeria[J]. Tropical Animal Health and Production,2014,46(2):467-473.
[21] Pirbhai M,Dong F,Zhong Y,et al. The secreted protease factor CPAF is responsible for degrading pro-apoptotic BH3-only proteins inChlamydiatrachomatis-infected cells[J]. The Journal of Biological Chemistry,2006,281(42):31495-31501.
[22] Fan P,Dong F,Huang Y,et al.Chlamydiapneumoniaesecretion of a protease-like activity factor for degrading host cell transcription factors required for [correction of factors is required for]major histocompatibility complex antigen expression[J]. Infection and Immunity,2002,70(1):345-349.
[23] Chen A L,Johnson K A,Lee J K,et al. CPAF:a chlamydial protease in search of an authentic substrate[J]. PLoS Pathogens,2012,8(8):e1002842.
[24] Forsbach-Birk V,Foddis C,Simnacher U,et al. Profiling antibody responses to infections byChlamydiaabortusenables identification of potential virulence factors and candidates for serodiagnosis[J]. PLoS One,2013,8(11):e80310.
[25] 周继章,曹小安,邱昌庆,等. 动物衣原体病诊断技术[S]. 中华人民共和国农业行业标准,2015,562/T-2015.
[26] Hireche S,Ababneh M M,Bouaziz O,et al. Seroprevalence and molecular characterization ofChlamydiaabortusin frozen fetal and placental tissues of aborting ewes in northeastern Algeria[J]. Tropical Animal Health and Production,2016,48(2):255-262.

