白乌鱼胴体黏液抗菌活性分析
张龙翼,陈平平,王林果,陈婷婷,张 ,熊 伟,郭思亚
(成都大学 肉类加工四川省重点实验室,四川 成都 610106)
0 引 言
鱼类的皮肤与水环境直接接触,其皮肤上覆盖着一层由上皮细胞和表皮杯状细胞分泌的黏液.黏液作为鱼体的第一道免疫防线,具有渗透压调节器、天然润滑剂、化学信息传递介质等多种重要的生理功能[1].研究发现,鱼体存在局部的皮肤黏液免疫系统,具有一定的黏液细胞基础,能独立完成抗原摄取、呈递及抗体分泌功能[2-4].近年来,科研人员对鱼胴体黏液在鱼类疾病防治以及提取并特征化其中的抗菌活性物质等方面开展了一些研究并取得了一些成果[5-7].白乌鱼是一种低脂高蛋白的经济鱼类,营养价值较高.白乌鱼在宰杀后,其表面有很多的黏液,但目前对其体表黏液的抗菌活性却鲜有报道.为了更充分地发掘白乌鱼的经济价值,本研究拟对白乌鱼胴体黏液的抗菌活性进行分析.
1 材料与方法
1.1 材料与仪器
1.1.1材料.
实验所用材料包括:新鲜白乌鱼,购自成都龙泉驿区三联汽车城水产市场;蛋白胨,购自北京奥博星生物技术有限责任公司;琼脂粉、过硫酸铵(分析纯),购自成都金山化学试剂有限公司;酵母提取物,购自广州市华粤瑞科科学器材有限公司;氯化钠(分析纯)、盐酸(36.0%~38.0%)购自成都科龙化工试剂厂;Acrylamide(99%电泳级),购自上海麦克林生化科技有限公司;Tris、TEMED,购自北京诺其雅盛生物科技有限公司.
1.1.2仪器.

1.2 方 法
1.2.1白乌鱼鱼胴体黏液的收集.
新鲜白乌鱼用自来水暂养,间隔半小时换一次水,连续3次,宰杀后刮去鱼鳞,然后用手(带乳胶手套)轻捋其体表,让黏液流入灭菌后的器皿中,分装后4 ℃保存备用.
1.2.2白乌鱼鱼胴体黏液抑菌活性分析.
分别取2份白乌鱼体表黏液10 mL于离心管中,将其中1份黏液在沸水(96 ℃)中煮20 min.将1 mL纯水、1 mL新鲜黏液、1 mL变性黏液分别均匀接种到灭菌后的LB固体培养基中,再放入生化培养箱中,在37 ℃恒温培养24 h,观察菌落生长状况,每组平行3次.分别取不同培养基中的菌落于载玻片上,在生物显微镜下观察每组单体菌落和单个菌体的生长状态,分析其菌种的属性.
1.2.3活性菌种放大培养.
用灭菌牙签挑选新鲜黏液黄色菌、新鲜黏液大菌和变性黏液大菌,分别接种到LB液体培养基中,将液体培养基放入恒温振荡器中,在160 r/min、30 ℃条件下振荡24 h.
1.2.4菌落蛋白凝胶电泳分析.
用PBS缓冲液洗脱培养基,各取10 mL菌液,在10 000 r/min,离心5 min,倒掉上清液,再加入10 mL PBS缓冲液用旋涡混合器混匀,再离心5 min,重复3次,最后加入5 μL PBS缓冲液混匀,提取到3种放大培养后的蛋白.分别取80 μL放大培养后的蛋白,加入20 μL上样染色液,在沸水中煮10 min,然后在旋涡混合器中混匀.各取10 μL进样到电泳仪中,用蛋白质凝胶电泳观察其蛋白质表达情况.
1.2.5数据分析.
所有实验数据利用Excel 2016对数据进行统计分析.
2 结果与讨论
2.1 鱼胴体黏液变性前后的外表特征
由于白乌鱼胴体黏液在采集过程容易感染杂菌,为了减少外界杂菌对后期抗菌活性的影响,在实验中,对黏液进行了加热处理,加热处理后的鱼胴体黏液见图1.

A管为未加热黏液;B管为加热处理后的黏液
图1鱼胴体黏液变性前后的外表特征
由图1可知,未加热鱼胴体黏液呈现淡红色,而加热处理后的黏液呈淡绿色.未加热鱼胴体黏液呈淡红色,这可能是鱼在去鳞后收集黏液时带入了一些鱼体血液所致;但是经过加热的鱼胴体黏液,其颜色呈现淡绿色.通常血色素在加热以后会呈褐色,而鱼胴体黏液加热后却呈现淡绿色,对于导致这一现象的原因暂时还不明确.
2.2 鱼胴体黏液的抗菌性比较
为了比较鱼胴体黏液的抗菌性,取1 mL纯水、1 mL新鲜黏液、1 mL加热处理的黏液,分别均匀接种到灭菌后的LB固体培养基中,再放入生化培养箱中,于37 ℃恒温培养24 h,观察微生物的生长状况,结果如图2所示.

A:取1 mL纯水;B:1 mL新鲜黏液;C:1 mL加热处理的黏液
图2鱼胴体黏液变性前后的抗菌性比较
由图2可知,接种了新鲜黏液的培养基主要生长了2种菌落,即黄色菌和大菌,具体为何种微生物根据菌像难以判断;而接种了加热处理的黏液的培养基,只生长了大菌;空白组中无菌落生长.
由培养基上微生物生长状况可以推测,新鲜和经加热处理的黏液培养基上所长微生物很可能不是空气中的杂菌.因为黏液热处理会导致部分杂菌死亡,图2(B)中不仅有黄色菌又有大菌,而图2(C)中仅有大菌,而且图2(B)和图2(C)中大菌的生长直径相当.因此,黏液中的大菌与杂菌之间很可能存在竞争性生长,而且黏液中的大菌具有较好的耐热性,对此有必要做进一步分析.
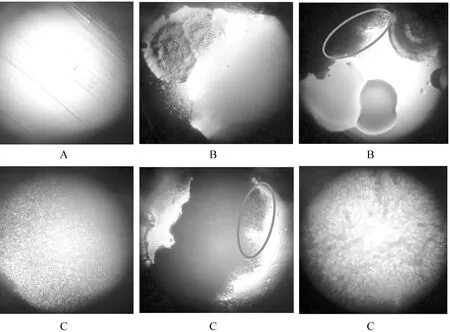
2.3 菌落的显微照片
为了更加清晰地观察培养基上生长菌落的菌像,对菌种进行显微镜观察,拍照结果如图3所示.
由图3可知,与对照(图3(A))相比,新鲜黏液培养基(图3(B))上的微生物菌像种类较加热处理黏液(图3(C))培养基上的菌像种类多.图中椭圆圈内的微生物不仅出现在新鲜黏液培养基上(图3(B)),而且还出现在加热处理黏液的培养基上(图3(C)).由此进一步验证了“2.2”项的推测,即大菌和黄色菌之间存在竞争性生长现象.
2.4 变性黏液菌落蛋白分析
为了进一步分析大菌的特征,对黏液中的大菌进行了放大培养,并提取其中的蛋白质进行电泳分析,其电泳图如图4所示.
A:取1 mL纯水;B:1 mL新鲜黏液;C:1 mL加热处理的黏液
图3黏液菌落的显微照片
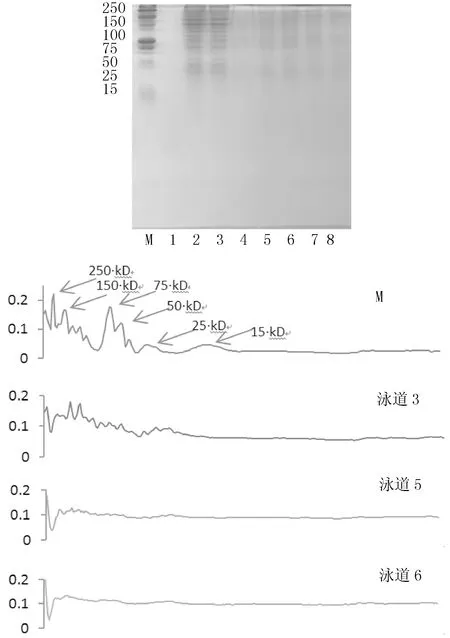
M为标准蛋白;1道为培养基空白;2道、3道为新鲜黏液黄色菌;4道、5道为新鲜黏液大菌;6道、7道、8道为加热黏液大菌
图4变性黏液菌落蛋白分析
图4显示,新鲜黏液黄色菌(2道、3道)中主要蛋白的分子量在100~150 kD之间,而且其中的蛋白质种类较多;而新鲜(4道、5道)和加热黏液(6道、7道、8道)中大菌的蛋白质分布无明显差异,但含量较黄色菌低.
大菌中的蛋白质含量较低,这可能是大菌较其他杂菌耐高温处理的可能原因.如果能进一步对大菌中的蛋白质进行分析,那么大菌中的蛋白质很可能具有耐热等特性,具体情况有待做进一步研究.
3 结 论
通过比较鱼胴体黏液变性前后的外表特征,发现未加热鱼胴体黏液呈现淡红色,而加热处理后的黏液呈淡绿色.比较鱼胴体黏液的抗菌性,发现接种了新鲜黏液的培养基主要生长了2种菌落,黄色菌和大菌;而接种了加热处理的黏液的培养基,只生长了大菌;空白组中无菌落生长.通过电泳分析发现,新鲜黏液的黄色菌中主要蛋白的分子量在100~150 kD,而且其中的蛋白质种类较多.实验结果表明,大菌不仅与其他菌间存在竞争性生长特性,而且还表现出较高的耐热性.

