敲除IgG受体FcγRIIB加重小鼠全身及脂肪组织炎性反应
张 唯,舒 婷,宋小敏,李博伦,王 婧
(中国医学科学院基础医学研究所 北京协和医学院基础学院,北京 100005)
肥胖是2型糖尿病和很多心血管疾病以及某些类型癌的主要风险因素[1]。白色脂肪组织(white adipose tissue, WAT)由脂肪细胞和基质血管细胞组成,包括内皮细胞、前脂肪细胞和免疫细胞[2]。在免疫细胞中,巨噬细胞在肥胖诱导的脂肪组织炎性反应中起着特别重要的作用[3]。如M1型巨噬细胞可以产生TNF-α等炎性因子。肥胖时WAT中M1巨噬细胞的相对和绝对数量增加,从而促进了脂肪组织炎性反应[4]。
IgG分子的Fc段在调节免疫细胞的活化中起重要作用。IgG通过与IgG受体(FcγR)的不同亚型结合来调理免疫反应。人免疫系统含有高亲和性受体FcγRI、低亲和性受体FcγRIIA、FcγRIIB、FcγRIIC、FcγRIIIA以及FcγRIIIB等6种典型的FcγR,其中FcγRIIB是唯一具有抑制功能的FcγRIIB[5]。 FcγRIIB是一类酪氨酸激酶受体,由两个Ig样细胞外结构域、跨膜结构域和具有免疫受体磷酸酪氨酸抑制(immunoreceptor tyrosine-based inhibitory motif, ITIM)基序的细胞质内尾部构成[6]。FcγRIIB的胞外段含有IgG结合位点,FcγRIIB的活化导致磷酸酶向ITIM基序招募,抑制来自其他活化受体的信号传导[7]。FcγRIIB广泛表达于大多数类型的免疫细胞,包括树突细胞、单核细胞、巨噬细胞、肥大细胞、嗜中性粒细胞、嗜碱性粒细胞甚至记忆CD8+T细胞[8-9]。最近的流行病学研究揭示FcγRIIB的跨膜结构域内的非同义单核苷酸多态性(rs1050501)引起I232T取代,与系统性红斑狼疮的易感性相关[10]。还有研究表明,缺乏FcγRIIB的小鼠有过敏性气道炎性反应的过度表现,提示其在哮喘中的可能存在负向调控的作用[11]。
综上,本研究意在探究FcγRIIB对高脂饮食诱导肥胖所引起的慢性炎性反应的改变,脂肪组织局部炎性细胞浸润的情况,以及FcγRIIB所引起的炎性改变对肥胖和脂肪代谢功能的影响。
1 材料与方法
1.1 材料
1.1.1实验动物:SPF级野生型(WT)与IgG受体FcγRIIB敲除(FcγRIIB-/-)小鼠(哈佛医学院Jackson’s实验室提供),两组小鼠互相交配,获得杂合子(FcγRIIB+/-)小鼠,雌雄交配,选取纯合子(FcγRIIB+/+与FcγRIIB-/-)小鼠各10只做实验,6~8周龄,体质量20~23 g。饲养温度(23±2)℃;湿度50%±20%;12 h光照和黑夜循环,水和食物均为随意摄取。
1.1.2主要试剂:IL-6、TNF-a和IFN-γ试剂盒(eBioscience公司)。Trizol(Ambion公司);RNA反转录试剂盒和实时定量PCR(RT-qPCR)试剂盒(全式金生物技术有限公司);PCR引物(广州天一辉远基因科技有限公司);HE染色试剂盒(北京世济合力生物科技有限公司);HFD(OpenSource Diets公司);山羊抗大鼠二抗(北京中杉金桥生物技术有限公司);AEC显色液(福州迈新生物技术开发有限公司);巨噬细胞抗体MAC、CD11b和F4/80(BD公司)。
1.2 方法
1.2.1动物的分组及处理:选取6~8周FcγRIIB+/+与FcγRIIB-/-雄鼠各10只,均给予高脂饮食(high fat diet,HFD)喂养,17周末,所有小鼠经三溴乙醇麻醉(400 mg/kg)后,采集心脏血,常规制备血清;迅速取出皮下、腹部脂肪并称取其质量,一半腹部脂肪组织于40%甲醛中存放,用于石蜡切片的制备免疫组化染色。剩余脂肪组织于-80 ℃冻存,用于RNA的提取。
1.2.2ELISA检测血清中炎性因子:具体步骤按照试剂盒说明书操作。
1.2.3总RNA提取和RT-qPCR检测:利用Trizol法提取脂肪组织中的总RNA,用反转录试剂盒将RNA反转录成cDNA。利用RT-qPCR检测目的基因mRNA的表达。所有基因表达量以GAPDH为内参。
1.2.4组织化学染色:脂肪组织于甲醛固定后,常规制成石蜡切片进行HE染色和免疫组化染色,并在显微镜下观察拍照。
1.2.5流式细胞计量术:将离体脂肪组织剪碎,用Ⅰ型胶原酶消化成单个细胞,2 000 r/min离心后用100 μL PBS重悬,每管添加CD11b抗体(FITC)和F4/80抗体(PE)各1 μL,避光,冰上孵育30~60 min,染色完成后直接加1 mL PBS,2 000 r/min室温离心10 min,去上清,沉淀用100 μL 4%多聚甲醛重悬后上机检测。
1.3 统计学分析
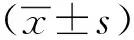
2 结果
2.1 FcγRIIB-/-小鼠血清中炎性因子增加
FcγRIIB-/-组中血清炎性因子IL-6、TNF-α和IFN-γ的水平均明显高于FcγRIIB+/+组(P<0.05)(图1)。
2.2 FcγRIIB-/-小鼠脂肪组织中巨噬细胞浸润增加
FcγRIIB-/-组脂肪组织巨噬细胞阳性巨噬细胞的浸润显著高于FcγRIIB+/+组(P<0.05)(图2A,B)。脂肪组织中,FcγRIIB-/-组的CD11b和F4/80双阳性细胞明显增加(图2C,D)。FcγRIIB-/-组脂肪组织中F4/80和CD68的mRNA水平明显增加(图2E,F)。
2.3 FcγRIIB-/-小鼠脂肪组织中巨噬细胞向M1型极化
FcγRIIB-/-脂肪组织中M1型巨噬细胞表面标志物MCP-1和TNF-α的mRNA水平明显高于FcγRIIB+/+组(P<0.05),而M2型巨噬细胞表面标志物ARG和IL-10无显著差异(图3)。
2.4 FcγRIIB-/-不改变脂肪组织质量和脂代谢水平
FcγRIIB-/-组小鼠体质量、皮下脂肪、腹部脂肪以及脂肪细胞大小无明显改变(图4A-E)。脂合成相关的基因PPARG、CEBPα和FASn的表达量没有改变(图4F-H)。与脂分解相关基因HSL和ATGL的表达同样没有变化(图4I,J)。与产热相关的基因UCP-1(图4K)以及葡萄糖转运相关基因GLUT4(图4L)的表达也没有差异。
3 讨论
本研究探究FcγRIIB敲除对高脂饮食诱导肥胖和脂肪炎性反应的影响,发现在高脂饮食诱导下,FcγRIIB敲除后小鼠血清中的炎性因子TNF-α、IL-6和IFN-γ明显升高。通过免疫组化染色、流式细胞术和qPCR的方法检测脂肪组织中巨噬细胞的数量。发现FcγRIIB敲除后小鼠脂肪组织中巨噬细胞的浸润明显增加,同时发现巨噬细胞向M1型促炎方向极化。脂肪组织炎性细胞与脂肪代谢以及肥胖有直接相关性,但在本次研究中,高脂饮食诱导下FcγRIIB敲除小鼠体质量、脂肪质量以及脂肪细胞大小并没有出现明显的差异。同时本研究对脂肪组织代谢相关基因进行检测,发现FcγRIIB敲除并不影响脂肪细胞的代谢。
FcγRIIB是IgG的一类抑制性受体,主要发挥抑制免疫应答的作用[8]。近些年来,越来越多的研究显示FcγRIIB在其他炎性反应疾病中起到重要作用,如哮喘、动脉粥样硬化、主动脉瘤和阿尔兹海默病[12]等。也有研究认为,肥胖也是一种慢性炎性疾病,高脂饮食诱导小鼠肥胖会伴随慢性炎性反应的发生以及局部炎性细胞浸润增加[13]。在本研究中,FcγRIIB敲除小鼠的全身炎性反应和脂肪组织局部巨噬细胞浸润增加,与报道的FcγRIIB抑制炎性反应的结论相一致。
在肥胖诱导的慢性炎性反应中,研究的最早也是最深入的是肿瘤坏死因子TNF-α。TNF-α通过影响巨噬细胞浸润和朝向M1型极化加重炎性反应。然而脂肪组织炎性反应是如何加重肥胖的还存在争议。一些研究表明,TNF-α转化酶缺失导致小鼠TNF-α水平降低,在高脂诱导下,小鼠出现肥胖减弱、胰岛素敏感性增强[14]。而另一些研究表明,TNF-α是一种导致体质量减轻的恶病质素[15],发挥抑制脂肪脂合成和促进脂分解的作用[14]。在本研究中,虽然FcγRIIB敲除后小鼠出现了全身和脂肪组织炎性反应的增加,但对小鼠体质量、脂肪质量和脂肪细胞大小没有影响。同时检测了脂肪脂合成基因(PPARG、FASn和CEBPα)、脂分解相关基因(HSL、ATGL)、糖代谢相关基因GLUT4以及产热相关基因UCP-1的mRNA水平表达,发现FcγRIIB敲除后不影响脂肪代谢。

*P<0.05, **P<0.01 compared with FcγRIIB+/+图1 高脂饮食诱导下FcγRIIB+/+和FcγRIIB-/-小鼠血清炎性因子变化Fig 1 Serum inflammatory cytokines changed between FcγRIIB+/+ and FcγRIIB-/- mice after n=10)

A.representative image of adipose tissue macrophage immunohistochemical staining,positive cells were developed in red(indicated by the arrows); B.the statistics of macrophage infiltration in adipose tissue in two groups; C.representative image of adipose tissue macrophage flow cytometry; D.the statistics of macrophage infiltration in adipose tissue in two groups; relative mRNA expression of CD68(E) and F4/80(F) in adipose tissue ofFcγRIIB+/+andFcγRIIB-/-mice by RT-qPCR;*P<0.05 compared withFcγRIIB+/+
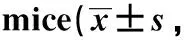

A,B.relative mRNA expression of MCP-1 and TNF-α in adipose tissue ofFcγRIIB+/+andFcγRIIB-/-mice by RT-qPCR; C,D.relative mRNA expression of ARG and IL-10 in adipose tissue ofFcγRIIB+/+andFcγRIIB-/-mice by RT-qPCR;*P<0.05 compared withFcγRIIB+/+


A,B,C.body weight, subcutaneous fat weight and abdominal fat weight ofFcγRIIB+/+andFcγRIIB-/-mice; D.representative image of adipose tissue HE staining; E.statistics of adipocyte size in both groups; F,G,H,I,J,K,L.relative mRNA expression ofPPARG,CEBPα,FASn,HSL,ATGL,UCP-1 andGLUT4 in adipose tissue ofFcγRIIB+/+andFcγRIIB-/-mice by RT-qPCR

综上所述,FcγRIIB敲除后促进小鼠全身以及局部的炎性反应水平,但不影响脂肪组织的代谢功能。

