离子液体[Bmim]FeCl4氧化吸收高浓度H2S研究
李维军 ,吴基荣 ,王南伟 ,陈 磊 ,邱 奎 *,何 柏
(1.重庆科技学院,重庆 401331;2.中石化西南油气分公司元坝净化厂,四川 广元 628000;3.中石油西南油气田分公司重庆气矿,重庆 400021)
在中小规模含硫气体净化方面,传统湿法氧化脱硫存在硫容低、药剂易变质、耗量大、无法回收利用,吸收效能差,能耗偏高,易带来二次环境污染等问题[1]。随着国家对SO2排放要求的日益严格,要求在石化等行业尾气SO2排放质量浓度应低于400mg/Nm3[2],这导致一些传统含硫气体净化工艺很难满足新标准的排放要求,必须开发新型高效脱硫剂及相应工艺设备才能达标排放。
离子液体的基础和应用研究发现[3-7],该液体具有熔点低,沸点高,蒸发损失小,热稳定性和化学稳定性高,功能结构具有可设计性,不易燃、不易爆炸等优点[8],在酸性气体 H2S、CO2、SO2等脱除方面初步显示出良好的性能[9-14]。何义等[15]等研究发现铁基离子液体[Bmim]FeCl4在H2S脱除上具有如下优点:在弱酸性条件下脱硫,净化度高,脱硫液不易蒸发损失,可在较宽温度范围内脱硫,不产生副产物,集氧化性、疏水性和热稳定性于一体,非常适合对H2S含量变化区间很大的含硫气体高效净化处理。Jalili等[16-19]研究了不同压力和温度下,H2S在[Emim][PF6]、[Bmim][PF6]、[Hemim][PF6]和[Omim][PF6]等中的溶解度,将文献中的数据进行综合整理,如图1。从图中可以看出:在常温常压下,H2S在离子液体中具有较高的溶解度;具有相同阴离子基团的咪唑类离子液体,其阳离子烷基取代基越长,越有利于H2S的溶解吸收;H2S在离子液体中溶解度随着压力升高逐渐增大,具有物理溶剂吸收的规律。[Bmim]FeCl4与上述离子液体含有类似的阳离子,作为氧化脱硫剂,在吸收高浓度H2S时,是否也会存在物理吸收作用,这种物理吸收作用将会促进还是妨碍离子液体氧化脱除H2S呢,目前对该离子液体的物理及化学吸收H2S报道较少,而这方面的研究对于指导工业中高含H2S酸气脱除具有十分重要的理论意义,因此开展了此方面实验研究。
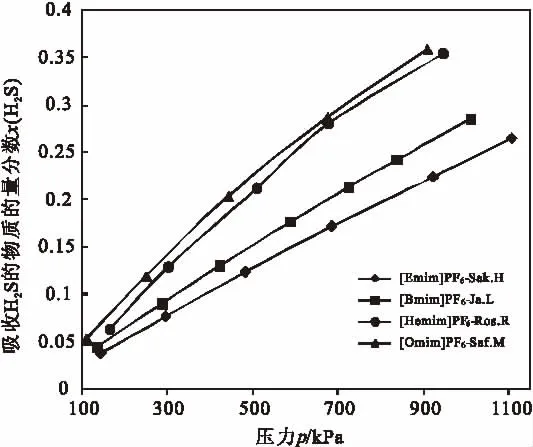
图1 压力对离子液体吸收H2S的影响Fig.1 Effect of ionic liquids on H2S absorption under different pressure
1 实验部分
1.1 试剂
[Bmim]FeCl4离子液体的制备按照文献[20]获得。氮气,氧气体积分数均为99.9%。标气1,硫化氢体积分数为5.0%、甲烷体积分数为95.0%。标气2,硫化氢体积分数为20.0%、甲烷体积分数为80.0%。标气3,硫化氢体积分数为99.9%。
1.2 实验方法
目前,已有学者对铁基离子液体的反应机理进行了初步研究,但还没有明确的定论,何义[15]给出的方程式为:
脱硫过程:

再生过程:

实验脱硫装置如图2所示,在常温、常压下,控制标气流量为60~80mL/min,将其通入装有40mL[Bmim]FeCl4的鼓泡吸收器进行氧化吸收,净化后的尾气用氢氧化钠溶液吸收。用精度为0.0001g的电子天平对脱硫前后进行称重。经N2汽提后的离子液体通入氧气再生,重复多次脱硫实验。
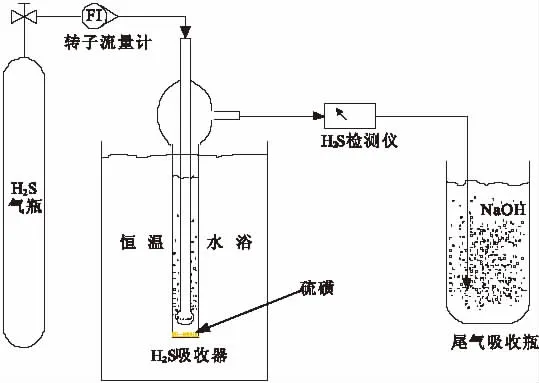
图2 离子液体氧化吸收H2S实验装置Fig.2 Experimental setup for oxidation absorption of H2S in ionic liquid
1.3 物理化学吸收H2S的测定方法
将40mL[Bmim]FeCl4加入鼓泡吸收器,称量质量为m0;脱硫后称量鼓泡吸收器质量为m1。对脱硫后的离子液体进行N2汽提或者真空干燥,称量质量为m2。离子液体物理吸收H2S质量m3=m1-m2;离子液体化学吸收H2S的质量为m4=m2-m0。由于氮气为惰性气体,前期空白实验表明它在离子液体中基本不溶解,故采用氮气汽提脱硫后的离子液体有助于将物理溶解于离子液体中的H2S完全汽提出来。此外,在较高真空度条件下,物理溶解于离子液体中的H2S也可完全解吸出来。希望通过两种方法的对比,探索更方便、准确的测定H2S物理溶解于离子液体的方法。
2 结果与讨论
2.1 H2S浓度对离子液体脱硫吸收的影响
取40 mL[Bmim]FeCl4于鼓泡吸收器中,调整进气流量为80 mL/min,分别进行标气1、标气2、标气3的脱硫实验,每种标气进行15min氧化吸收,重复三次。[Bmim]FeCl4吸收H2S的平均增重随时间变化如图3所示。
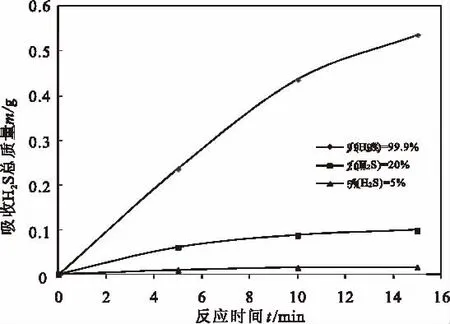
图3 离子液体吸收不同含量H2S的质量增量Fig.3 Increased mass of ionic liquid fordifferent concentration H2S absorption
由图3可知,随时间延长,离子液体吸收不同含量H2S气体的质量均逐渐增大,但是H2S含量越高,离子液体对其吸收的质量增长幅度越大。在15min吸收时间内,标气1的H2S吸收量平均为0.38g/L,标气2的H2S吸收量为2.62g/L,标气3的H2S吸收量达14.48 g/L,[Bmim]FeCl4对H2S吸收量与H2S含量呈正相关关系,且对高含量H2S吸收效果尤为显著。此规律表明酸气中H2S含量升高有利于加强其在离子液体中的物理溶解作用,进而溶解的H2S先在溶液中离解生成HS-后再与Fe3+反应生成S,提高了离子液体总的硫容量。
2.2 脱硫液重复使用对吸收效率的影响
每次脱硫完成后分离出硫磺单质,用N2汽提30min,再用纯氧再生脱硫液30min,称量质量后重新开始新的脱硫实验,以考察脱硫性能的重现性。每次脱硫时间均为15min。
脱硫后的 [Bmim]FeCl4用氧气再生后发现脱硫剂的质量均大幅度降低,对此,王建宏等[21]解释通入O2将Fe2+氧化成Fe3+的同时,过量的O2将反应生成的水带走从而导致[Bmim]FeCl4的质量下降,这与络合铁水相催化氧化H2S时需要补充水是一致的。此外,氧气可能也会携带走少量硫化氢。为保证[Bmim]FeCl4脱硫与再生实验数据的稳定性和可靠性,每次脱硫后的 [Bmim]FeCl4通入O2进行30min再生,对再生后的[Bmim]FeCl4进行多次重复脱硫实验,脱硫后溶液质量增加情况如图4。与首次脱硫相比,再生后的[Bmim]FeCl4吸收H2S的平均质量增加可达到首次质量增加的87%以上,说明[Bmim]FeCl4具有良好的脱硫稳定性,这与文献[21]报道接近。
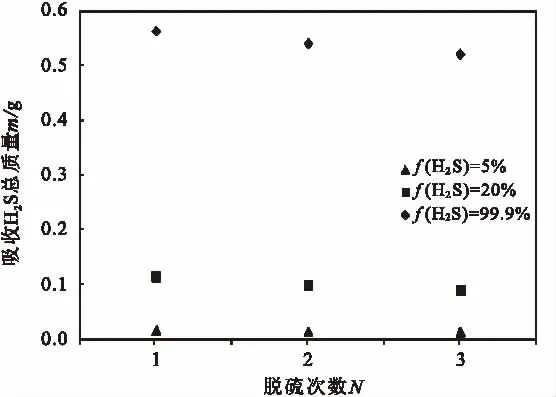
图4 重复脱硫次数对离子液体吸收H2S的影响Fig.4 Effect of reused times of ionic liquid on H2S absorption
2.3 离子液体对H2S的物理吸收和化学吸收分析
文献[16-19]描述了不同类型离子液体对H2S都具有一定的物理溶解作用,而[Bmim]FeCl4中的Fe3+又可氧化H2S形成单质硫。因此,[Bmim]FeCl4脱硫同时具有物理吸收和化学反应两种作用。[Bmim]FeCl4作为氧化还原脱硫剂,当然希望将H2S直接氧化成元素硫加以脱除,而并非希望主要以物理吸收作用将H2S脱除。但是,[Bmim]FeCl4具有一定的对H2S的物理溶解作用可促进H2S加速溶解于脱硫液促进其与Fe3+氧化反应生成S。因此分析清楚H2S在离子液体中的物理吸收和化学吸收规律,有助于指导脱硫操作条件及调整溶液配方,以获得更高效的脱硫效果。
实验发现离子液体吸收H2S的质量增加与气体H2S体积分数呈正相关关系,表现出一般物理溶剂性质。而采用氧气再生离子液体时,O2将与溶解的H2S离解出来的H+反应生成水,使得溶剂质量增加。尽管大量氧气对离子液体进行再生可带出部分水分,但是毕竟仍会有少量水分残留在液体中,给质量分析带来误差,最终影响离子液体硫容的测定。基于氮气为惰性气体,它在有机溶剂中溶解度极低,将它通入脱硫之后的离子液体中,不仅不会像O2一样与H+反应生成水带来溶剂质量增加的影响,而且它作为惰性气体还可以汽提出物理性溶解的H2S。为了提高实验准确性,首先做了空白试验,即将氮气通入没有脱硫的新鲜离子液体中30min,在通入氮气前后分别称量离子液体质量,实验结果前后质量几乎不变,这表明氮气常压下基本不溶解于离子液体中,不会给汽提之后离子液体称量质量带来误差。
将脱硫之后的 [Bmim]FeCl4经氮气汽提后的平均质量增加数据以及由1.3节方法计算出的离子液体物理吸收H2S质量和化学反应消耗的H2S质量数据记录在表1。

表1 不同体积分数的H2S在离子液体中的物理吸收和化学吸收作用Table 1 Physical and chemical absorption of different concentration H2S in ionic liquid
表1可知,利用40mL脱硫液对H2S体积分数为5%的低浓度标气1脱硫,其化学吸收H2S质量仅为0.0131g,而标气3的H2S体积分数升高到99.9%时,化学吸收H2S质量增加到0.1132g,增长了8.64倍,说明随H2S浓度增加,化学吸收效率有较显著提高,这主要应归因于高浓度H2S气体更易物理溶解于离子液体中,进而促进三价铁离子对H2S的化学氧化反应。
由表1还可发现,标气1代表低浓度H2S,离子液体对其物理吸收作用较轻微,40mL脱硫液中仅仅物理溶解了0.0009g H2S,标气2和标气3的H2S体积分数分别提高到20%和99.9%,对应在离子液体中的物理溶解量分别达到0.0619g和0.423g,比标气1的物理吸收H2S质量分别提高了69倍和470倍。该数据变化趋势表明,酸气中H2S浓度的迅速升高将使物理吸收作用显著增强。
由表1第5行数据可知,对H2S体积分数为5%的标气脱硫,化学吸收H2S质量是物理吸收的14.56倍。对体积分数为99.9%的H2S脱硫,化学吸收H2S质量是物理吸收的0.27倍,这一趋势表明,随着H2S浓度升高,物理吸收与化学反应H2S的能力都在提高,但是物理吸收增长速率明显快于化学反应消耗的H2S。H2S浓度的升高将有助于增强酸性气体在离子液体中的溶解度,也进一步促进了化学反应作用的增强。
根据离子液体对H2S的物理吸收和化学反应增重,对离子液体吸收体积分数分别为20%和99.9%的H2S的数据进行拟合,结果如图5。
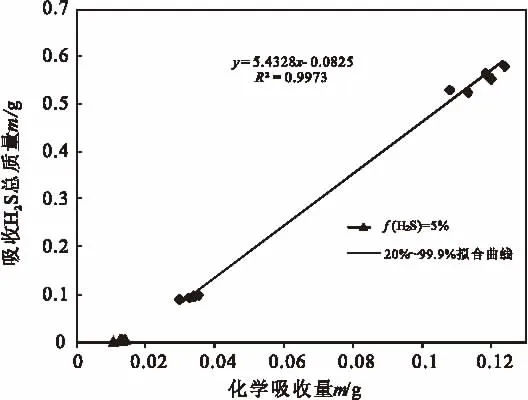
图5 离子液体化学吸收H2S与吸收H2S总质量关系Fig.5 Total absorption of H2S vs chemical absorption of H2S in ionic liquid
由图5可推断,在一定的时间内,当H2S体积分数在5.8%以下时,离子液体[Bmim]FeCl4对H2S吸收主要以化学吸收为主,因为在低浓度含硫天然气脱硫之后,对其汽提的质量减少比例基本不变;但标气2、3的高浓度H2S脱硫后,经N2汽提的质量分别显著下降了65.4%和78.7%,这说明[Bmim]FeCl4对高浓度H2S气体进行氧化吸收时存在明显的物理吸收作用。根据表1中[Bmim]FeCl4吸收不同浓度H2S的化学吸收质量(即硫容),脱除体积分数为5%H2S的脱硫剂硫容为0.35g/L,与何义等[15]在低浓度H2S进行氧化脱硫的硫容相近,而进行体积分数为99.9%H2S的脱除时硫容可达3.0g/L;本次实验在吸收不同浓度H2S时出现了不同硫容,很有可能是H2S借助这种强烈的物理吸收作用可快速溶解于[Bmim]FeCl4中从而促进化学吸收,提高脱硫剂的硫容量。
离子液体对低浓度H2S吸收可以通过化学吸收作用有效地将H2S转化成硫磺加以脱除,这是赋予离子液体氧化脱硫性能的主要目标所在。而对高浓度H2S吸收主要是物理吸收占主导地位,脱硫吸收液采用空气再生时会带出较多H2S气体,为避免环境污染,可以采用吸附方法脱除这些物理解吸出来的H2S。
[Bmim]FeCl4的组成测定表明,Fe3+的质量分率为16.1%,其理论硫容应为66.0g/L,而实验获得的硫容最大为3.0g/L,其铁离子的反应活性仅为理论值的4.5%,而Lo-Cat试剂中铁离子在溶液中的质量分数一般不超过0.2%[22],但其活性可达98%以上。[Bmim]FeCl4中铁离子浓度比Lo-Cat试剂中铁离子浓度高出近百倍,理论上具有极大优势提高硫容从而提高脱硫效率,降低能耗,然而高铁离子含量无法体现出高硫容,其中一定存在某些因素影响了离子液体中铁离子的反应活性,这也是后续研究中值得关注的焦点问题。
3 结论
(1)根据[Bmim]FeCl4氧化吸收不同浓度H2S的曲线图,推断出气体中H2S体积分数低于5.8%,其脱硫主要以化学吸收为主;随着H2S浓度升高,化学吸收和物理吸收作用同时增强,但后者增长趋势远大于前者。尽管这样总体脱硫效果增强,但对H2S氧化脱除效率的提升并非有利。
(2)离子液体[Bmim]FeCl4对不同浓度的H2S氧化吸收时,对高浓度H2S的吸收比低浓度的效果更为显著,这是H2S借助物理吸收作用强化了在离子液体中的溶解,使Fe3+与更多溶解的H2S接触,充分促进化学反应吸收,提高了脱硫剂硫容。
(3)[Bmim]FeCl4实验硫容可高达3.0g/L,虽然比常规Lo-Cat脱硫剂的硫容高近8倍,但铁离子的反应活性不足理论值的4.5%,提高铁离子的反应活性可大幅提高硫容,降低溶液循环量,减少能耗。可通过改变离子液体的酸碱度或调整铁离子的含量等因素进行研究。
(4)[Bmim]FeCl4进行高浓度的H2S脱除时存在物理吸收和化学吸收,压力是影响物理溶解性的重要参数,它将进一步影响化学吸收性能。根据工业生产需求,进行高压下离子液体对H2S吸收性能的研究将具有更重要和现实的价值。

