两种典型炭材料对微生物还原含砷水铁矿的影响及其机制研究
吴 松,袁贝嘉,闫慧珺,方国东,张 俊,王玉军*,周东美*
(1.中国科学院土壤环境与污染修复重点实验室,中国科学院南京土壤研究所,南京 210008;2.中国科学院大学,北京100049;3.南京外国语学校,南京 210008)
生物炭、活性炭、石墨等炭材料含有无定型的碳结构、微晶石墨结构、三维孔道结构、高比表面积和无机组分,在土壤肥力提升、污染物吸附去除和固碳减排等领域具有广泛的应用前景[1]。近年来大量文献报道了炭材料对环境中污染物的吸附去除作用[2]。此外,炭材料介导环境中有机污染物化学转化的研究也有诸多报道[3-5]。但是关于炭材料对环境中Fe、As、C、N等元素的生物地球化学转化过程影响的研究却很少被报道。近年来,Klüpfel等[6]首次通过电化学方法测定了生物炭的得失电子能力,并推断生物炭在元素的生物地球转化过程中起到重要作用。随后生物炭以及生物炭的浸出液先后被报道能够作为电子中介体,加速微生物还原胞外铁矿[7-8]。此外,近期Saquing等[9]发现在厌氧环境中,生物炭既可以作为微生物代谢有机物的电子受体,又可以作为微生物还原硝酸盐的电子供体。尽管这几篇文献陆续报道了生物炭在元素生物地球化学转化过程中的电子穿梭体特性,但是关于炭材料在介导氧化还原反应过程中对重金属污染物环境行为影响的研究报道较少。元素在生物地球化学转化过程中通常会伴随着巨大的环境效应。例如:在重金属污染区域,铁矿的还原溶解会导致铁矿中重金属的再释放,造成潜在的环境风险。
随着工业化和城市化进程的加速,大量的重金属、有机污染物进入环境,对人类健康和生态系统的稳定构成严重威胁。砷(As)是最普遍的环境有毒元素,它引起了全球性的环境健康问题[10]。流行病学研究表明,孟加拉国的居民由于长期饮用高As污染地下水,导致该国居民的皮肤、肝脏、膀胱、肺等器官癌变的风险增大[11]。环境中的生物过程能够调控As的形态分布,从而影响As的环境毒性及其迁移转化。对东南亚地区众多沉积物样品的分析发现,可提取态的As和Fe呈现正相关关系[12]。厌氧环境中铁矿的还原溶解通常是由微生物主导,因此在淹水稻田、河口沉积物、湿地等厌氧环境中,微生物与铁矿的相互作用对As的氧化还原转化及迁移起重要作用[13]。
由于活性炭[14]和生物炭[6]具有得失电子能力,当它们进入环境中后,必然会影响微生物还原含As铁矿的过程,进而引起矿物的溶解、转化,以及次生矿物的生成,最终影响到As的溶解释放、迁移转化等环境行为。本文拟构建生物炭或活性炭、微生物以及含As水铁矿的复合培养体系,探究生物炭和活性炭对微生物还原铁矿过程的影响,以及铁矿还原过程中As的溶解释放行为。
1 材料与方法
1.1 生物炭、活性炭和含As水铁矿的制备
木屑采自木材加工厂,经过清洗烘干处理后,在马弗炉中500℃烧制1 h,制备得到生物炭。实验中使用的活性炭购自国药集团(CAS:7440-44-0)。将生物炭和活性炭粉末放置于厌氧箱的进样室中,抽真空24 h以去除吸附在活性炭中的氧气;随后在厌氧箱中加入除氧的超纯水至炭的浓度为20 g·L-1;曝氮气2 h,以除去悬液中残留的氧气并密封。最后将装有20 g·L-1活性炭和生物炭悬液的血清瓶,置于灭菌锅中121℃灭菌处理20 min。
含五价砷的水铁矿[As(Ⅴ)-FH]通过共沉淀的方法合成:配制 1 mol·L-1的 Fe(NO3)3和 4.66 g·L-1的Na2HAsO4·7H2O的混合溶液,随后用1 mol·L-1的KOH中和以上混合溶液,生成的沉淀即为As(Ⅴ)-FH,其中Fe∶As为50∶1(W∶W)[15]。合成的As(Ⅴ)-FH清洗后制备成悬液,悬液中Fe(Ⅲ)的浓度为200 mmol·L-1,装入血清瓶中,曝氮气除氧后,密封室温保存。
1.2 微生物的培养
本研究选取在微生物胞外电子传递研究中使用的模式细菌Shewanmella oneidensis MR-1(ATCC No.700550)开展实验。首先将S.oneidensis MR-1在LB培养基中(蛋白胨10 g·L-1,酵母提取物5 g·L-1,氯化钠5 g·L-1)好氧培养16 h(150 r·min-1,28 ℃)。随后离心收集菌体(6000 g,6 min),用厌氧碳酸盐缓冲溶液清洗后,重悬于厌氧缓冲盐溶液中(~2×1011cells·mL-1),除氧备用。
厌氧培养过程中的厌氧矿物质培养基组成如下:0.6 g·L-1KH2PO4,0.3 g·L-1NH4Cl,0.5 g·L-1MgSO4·7H2O,0.1 g·L-1CaCl2·2H2O;30 mmol·L-1NaHCO3;1 mL维生素溶液,1 mL硒-钨溶液,1 mL微量元素溶液;pH为7.0±0.1。本研究中,30 mmol·L-1的乳酸钠和10 mmol·L-1的As(Ⅴ)-FH分别作为培养基中的电子供体和电子受体供微生物代谢。
1.3 厌氧批培养实验
厌氧批培养实验在100 mL的血清瓶中进行。首先用注射器将2 mL的活性炭或生物炭悬液(20 g·L-1)或2 mL的灭菌超纯水加入含有30 mmol·L-1乳酸钠和10 mmol·L-1As(Ⅲ)-FH的厌氧矿物质培养基。随后接种1 mL S.oneidensis MR-1悬液或1 mL灭菌超纯水,将血清瓶放入振荡箱中避光培养(28℃,80 r·min-1),启动厌氧批培养实验。
在设定的时间点,于厌氧箱中取样,取出的样品分三份:0.1 mL的培养液加入1 mL的HCl(1 mol·L-1)中,用于测定培养体系中总的Fe(Ⅱ)和总Fe;培养液过滤后,收集0.1 mL滤液加入1 mL的HCl(1 mol·L-1)中,用于测定培养体系中溶解态的Fe(Ⅱ)和总Fe;培养液过滤后,收集0.1 mL滤液加入1 mL的H3PO4(10 mmol·L-1)中,用于测定培养体系中溶解态的As(Ⅲ)和总As。H3PO4可以减小富铁水样中As的氧化及沉淀,因此将用于测定滤液中溶解态As(Ⅲ)和总As的样品保存在H3PO4溶液中[16]。
1.4 分析测定
Fe(Ⅱ)和总Fe均使用邻菲罗啉法测定。As(Ⅲ)和总As的浓度通过原子荧光光谱仪测定(AFS-230E,Haiguang,China)[17]。培养体系中死菌和活菌的鉴定通过死活菌染色试剂盒(LIVE/DEAD BacLight,Invitrogen)进行分析。具体步骤如下:用注射器从培养瓶中取悬液0.5 mL加入2 mL离心管中,超声振荡1 min之后,涡旋振荡5 min;200 g离心1 min,收集上清液,转入新的1 mL离心管中;10 000 g离心5 min收集固体,用0.85%的NaCl溶液清洗;收集固体,重悬于0.5 mL的NaCl溶液中,分别加入1 μL的SYTO 9和Propidium iodide,用铝箔纸包裹避光,放入振荡箱中振荡15 min(200 r·min-1,25 ℃);离心收集固体,用NaCl溶液清洗两遍,去上清;用10 μL的Na-Cl溶液重悬固体,转移至载玻片,用盖玻片覆盖后,用荧光显微镜(Nikon 80i,Japan)观察死菌和活菌。
分别在48 h和250 h,用注射器从培养瓶中取1 mL的培养液,用于制备扫描电子显微镜(SEM)样品。SEM制样步骤如下:将培养液7000 g离心5 min收集固体,用50 mmol·L-1的磷酸盐缓冲溶液(pH=7.0)清洗三遍;将固体重悬于50 mmol·L-1的磷酸盐缓冲溶液,同时加入戊二醛(终浓度为2.5%)和甲醛(终浓度为0.4%),固定30 min(可避免磷酸盐与悬液中的固体反应生成新的沉淀);7000 g离心5 min收集固体,用50 mmol·L-1的磷酸盐缓冲溶液清洗固体三遍;用水、15%、30%、50%、70%、90%、95%、100%和100%的乙醇对固体样品进行梯度脱水,每个梯度10~15 min;脱水后的固体重悬于HMDS(Hexamethyldisilazane)中,30 s后离心收集固体,室温放置10 min,密封保存。制备好的样品喷金后,用SEM进行样品形貌观察(S-4800,Hitachi,Japan)。同时,分别在 48 h和250 h,将整瓶培养液-20℃冷冻之后,迅速转移至冷冻干燥机中冷冻干燥。冷冻干燥完毕的样品,迅速转入厌氧培养箱中收集固体,研磨后密封保存,尽快进行X射线衍射分析(XRD,Ultima IV,209 Rigaku,Japan)。
2 结果与讨论
2.1 活性炭和生物炭对As(Ⅴ)-FH中Fe(Ⅱ)还原的影响
如图1A所示,当接种S.oneidensis MR-1后,所有培养体系中Fe(Ⅱ)的比例均呈现增加的趋势,但是在未接种细菌的对照组中,所有培养体系中Fe(Ⅱ)的比例在整个培养过程中均保持基本稳定。在生物对照组中,Fe(Ⅱ)的比例在84.5 h时达到52.7%,随后基本维持稳定。在加入活性炭和生物炭的培养体系中,Fe(Ⅱ)的比例在84.5 h时分别为45.4%和47.6%。但是随着培养时间的延长,Fe(Ⅲ)还原的比例始终呈增加趋势,246 h时Fe(Ⅲ)还原的比例分别为100%和73.6%,远高于此时生物对照组中Fe(Ⅲ)还原的比例(57.0%)。以上研究结果说明在培养初期,活性炭和生物炭的加入并未显著促进微生物对铁矿的还原,但随着培养时间的延长,加入炭材料的培养体系中Fe(Ⅲ)还原的比例远高于生物对照组。
已有研究发现,当生物炭施加入土壤后,它可以促进土壤中Fe2+持续不断的生成并释放至溶液中[18-20]。本研究中,通过检测活性炭和生物炭对微生物还原As(Ⅴ)-FH过程中培养体系中Fe2+的生成量,发现在接菌并有活性炭和生物炭存在时,培养液上清中Fe2+的浓度缓慢增加,培养结束时达到最大值,分别为 1.01 mmol·L-1和 1.17 mmol·L-1。但是在没有加入炭材料的生物对照组中,培养液上清中Fe2+的浓度在95.5 h时达到最大值1.65 mmol·L-1,随后又逐渐降低至0.45 mmol·L-1,并基本维持稳定。溶液中Fe2+浓度的降低,是由于Fe2+与培养体系中的阴离子形成沉淀[21]。在没有接种S.oneidensis MR-1的培养体系中,整个培养周期均难以检测到Fe2+(图1B)。以上结果表明,活性炭和生物炭的加入使Fe2+的释放减缓。由于活性炭和生物炭的加入既没有促进培养初期微生物对铁矿的还原,也没有加速培养液中Fe2+的增加,因而我们推测可能是炭材料的加入对微生物的生长产生了影响。
2.2 活性炭和生物炭对微生物生长的影响

图1 活性炭和生物炭对Shewanalla oneidensis MR-1还原含As(Ⅴ)-FH过程中Fe还原比例和Fe2+释放的影响Figure 1 Effect of activated carbon and biochar on the percent of Fe reduced and the released Fe2+during Shewanalla oneidensis MR-1 reduction of As(Ⅴ)-bearing ferrihydrite

图2 荧光染色法鉴定生物炭影响Shewanalla oneidensis MR-1还原As(Ⅴ)-FH过程Figure 2 Live-dead cell counts using epifluorescence microscopy in the culture suspensions during microbial reduction of As(Ⅴ)-FH in the absence(biotic control)and presence of biochar
以往的文献报道结果表明,生物炭和活性炭可以明显加速微生物还原铁矿[7,14],但是本研究中发现在培养初期活性炭和生物炭没有明显促进微生物还原含As铁矿,因而我们推断这可能是本研究中使用的活性炭和生物炭具有生物毒性[22]。因此,我们进一步通过死活菌染色,表征体系中死菌和活菌的量(图2)。当培养48 h时,在生物对照组中,所有菌体都呈现绿色荧光,为活菌;但在加入生物炭的培养体系中,大部分的菌呈现红色荧光,为死菌。当培养120 h时,在生物对照组和加入生物炭的培养体系中,观察到的都为活菌。当培养250 h时,在生物对照组中,观察到的均为活菌;在加入生物炭的培养体系中,除了活菌外,还有部分死菌。因此,本研究中活性炭和生物炭的加入,在培养初期会对微生物的生长造成毒害作用,抑制了铁矿的微生物还原,从而减缓了Fe2+的释放;随着培养时间的增加,微生物逐渐适应培养环境,活性炭和生物炭可以持续不断地促进微生物还原铁矿,从而加大了铁矿的还原比例以及培养后期Fe2+的大量释放。
2.3 活性炭和生物炭对As(Ⅴ)-FH中As释放和转化的影响
As(Ⅴ)-FH中Fe(Ⅲ)的还原及Fe2+的释放会导致铁矿中As的释放和转化。活性炭和生物炭通常表面带负电,因而其对As(Ⅲ)和As(Ⅴ)的吸附能力很弱[23]。因此,我们分析了活性炭和生物炭影响微生物还原As(Ⅴ)-FH的过程中,培养液上清中As(Ⅲ)和总As的浓度。结果如图3A所示,当没有加入活性炭和生物炭时,溶液中总As的浓度从0 h的1.86 mg·L-1升高至23.5 h的2.45 mg·L-1,随后急剧下降,到84.5 h时降至0.01 mg·L-1,此后溶液中总As的浓度基本维持稳定。但是,当加入活性炭和生物炭时,溶液中总As的浓度持续不断地增加,分别到108 h和37.8 h达到最大值3.20 mg·L-1和2.51 mg·L-1,随后缓慢降低,直到培养结束时才降到最低值,分别为0.13 mg·L-1和0.01 mg·L-1。与生物对照组相比,活性炭和生物炭的加入阻碍了培养液上清中As(Ⅴ)的去除。此外,对于以上As(Ⅴ)-FH的培养体系,在整个培养过程中,溶液中As(Ⅲ)的浓度始终低于0.08 mg·L-1(图3B),这说明S.oneidensis MR-1不具有还原As(Ⅴ)的能力[15]。在没有接种微生物的培养体系中,培养液上清中总As的浓度始终维持在1.68~2.24 mg·L-1,活性炭和生物炭的存在,仅会使溶液中总As的浓度稍微降低,这可能是由于活性炭和生物炭对As(Ⅴ)有微弱的吸附能力[23]。在培养初始阶段培养液上清中即可以检测到As,这是由于磷酸根(4.4 mmol·L-1)与As(Ⅴ)竞争水铁矿表面的吸附位点,从而导致水铁矿中共沉淀的As(Ⅴ)的溶出[24]。
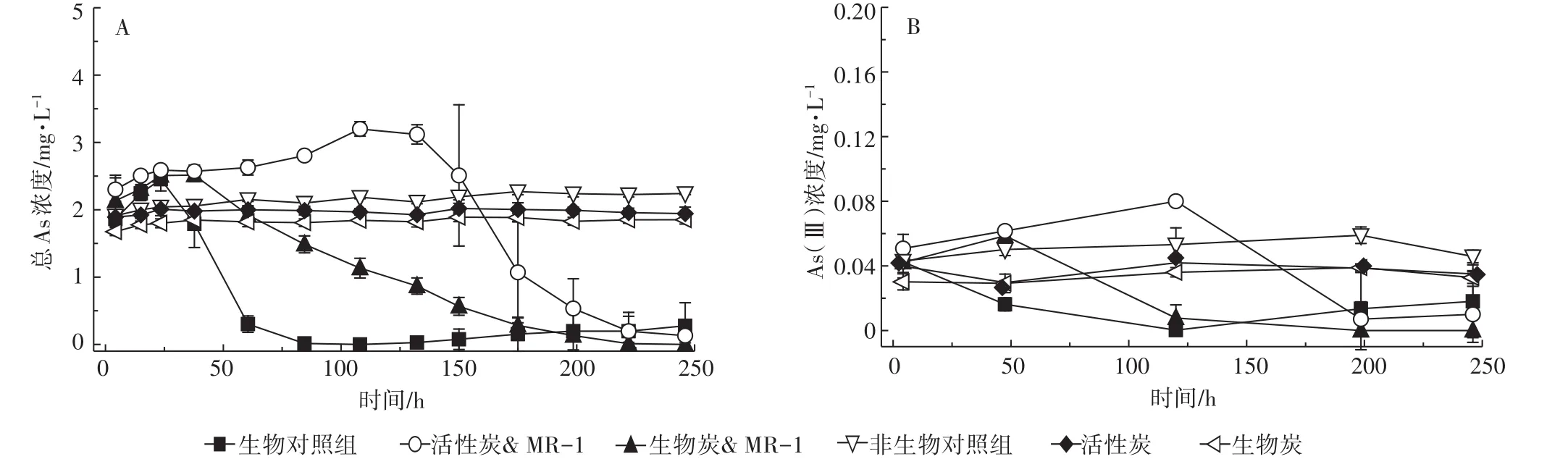
图3 活性炭和生物炭影响Shewanalla oneidensis MR-1还原含As(Ⅴ)-FH矿过程中溶液总As和As(Ⅲ)的浓度Figure 3 Effect of activated carbon and biochar on the concentration of total As and As(Ⅲ)in the supernatant during Shewanalla oneidensis MR-1 reduction of As(Ⅴ)-bearing ferrihydrite
2.4 活性炭和生物炭对次生矿物生成的影响
次生矿物的类型主要受Fe2+生成的速度和共存配体的类型影响[25-26]。因此,微生物还原As(Ⅴ)-FH过程中,培养48 h和250 h后生成的固体产物的矿物学组成,首先进行XRD检测(图4)。经过48 h的培养,在生物对照组和加入生物炭的培养体系中均检测到蓝铁矿的生成,而在加入活性炭的培养体系中,没有检测到次生矿物的生成。经过250 h的培养,次生矿物的谱峰强度增加,说明了矿物的含量在逐渐增加,在生物对照组中,既检测到蓝铁矿,又检测到菱铁矿,而在加入活性炭和生物炭的培养体系中,均只检测到蓝铁矿生成。在没有接种微生物的培养体系中,均没有检测到次生矿物的生成(图4B)。
为了验证矿物学组成的结果,我们选取培养48 h和250 h后的固体样品进行SEM观察(图5)。经过48 h的培养:在生物对照组中,观察到少量片状的次生矿物生成,其余仍为无定型的水铁矿;在加入活性炭的培养体系中,没有观察到明显的次生矿物;在加入生物炭的培养体系中,观察到少量片状的次生矿物生成。经过250 h的培养:在生物对照组中,观察到大量片状和立方体形的次生矿物生成;在加入活性炭的培养体系中,观察到条片状的次生矿物;在加入生物炭的培养体系中,观察到大量片状的次生矿物生成。
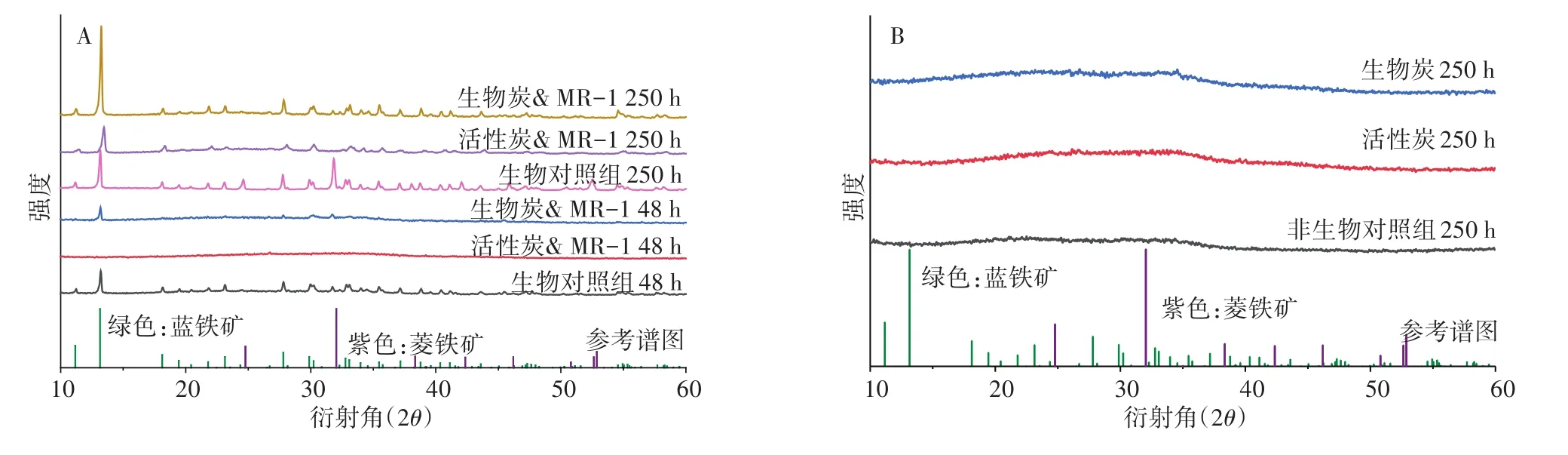
图4 活性炭和生物炭影响微生物还原As(Ⅴ)-FH过程中固体样品的矿物学组成(A)和没有加微生物的对照组中固体样品的矿物学组成(B)Figure 4 Effect of activated carbon and biochar on the composition of secondary mineral during Shewanalla oneidensis MR-1(A)and abiotic(B)reduction of As(Ⅴ)-bearing ferrihydrite
经过48 h和250 h的培养,通过XRD检测到的次生矿物种类与SEM观察到的次生矿物种类均一致。因此,我们可以推断出片状的次生矿物为蓝铁矿,正方体形的次生矿物为菱铁矿。Muehe等[15]也在厌氧培养体系中检测到片状的蓝铁矿和正方体形的菱铁矿,与本研究结果一致。本研究中使用的厌氧矿物质培养基的组成是根据地下环境中的地球化学组成模拟设计的[15,27],其中磷酸根的浓度为 4.4 mmol·L-1,氯离子的浓度为7.0 mmol·L-1,硫酸根的浓度为2.0 mmol·L-1,碳酸根的浓度为30 mmol·L-1。次生矿物的生成,与它们的溶解性具有相关性。菱铁矿和蓝铁矿的lgKsp分别为-36和10.9,因此这两种次生矿物均可生成[28],并且先生成蓝铁矿,后生成菱铁矿。尽管在加入活性炭的培养体系中,培养结束时铁完全被还原,但是通过XRD检测到的次生矿物的谱峰强度很弱,并且在48 h的时候未能检测到次生矿物的生成。我们之前的研究结果发现,当将Fe2+加入含有活性炭的培养体系时,仅发现纳米级的小颗粒,没有次生矿物生成;但当培养体系中没有活性炭时,可以检测到明显的次生矿物生成[14]。因此,本研究中活性炭抑制次生矿物生成的原因可能是,活性炭对Fe2+具有较强的吸附能力,使缓慢生成的Fe2+被均匀地吸附在活性炭表面,抑制了蓝铁矿和菱铁矿矿物晶体的生长。
图3的结果表明溶液中的As最终都被固体矿物所固定,而在本实验中检测到蓝铁矿和菱铁矿的生成。为了进一步确定As是否累积在蓝铁矿中,我们通过SEM-EDX元素面扫观察As在不同次生矿物中的分布,见图6。由于蓝铁矿和菱铁矿的主要成分分别为 Fe3(PO4)2和 FeCO3,因而在 SEM-EDX 元素面扫时选取Fe、P和As三种元素。图6中片状矿物的元素组成包括Fe、P和少量的As,而正方体形矿物的元素组成仅为Fe。因此,我们推断出,在生成的片状蓝铁矿和正方体形菱铁矿中,As主要累积在片状的蓝铁矿中。
综合以上研究结果,本研究中活性炭和生物炭的加入在培养初期会对微生物的生长造成毒害作用,抑制了铁矿的还原和Fe2+的释放,从而减缓了次生矿物的生成,使溶液中的As不能被尽快固定在次生矿物中。但是在培养中期微生物逐渐适应培养环境,铁矿的还原可以持续进行,因而与生物对照组相比,活性炭和生物炭的加入,最终显著增加了铁的还原比例。

图5 活性炭和生物炭影响微生物还原As(Ⅴ)-FH过程中固体样品的矿物形貌Figure 5 Effect of activated carbon and biochar on the morphology of solid mineral during Shewanalla oneidensis MR-1 reduction of As(Ⅴ)-bearing ferrihydrite
3 结论
(1)活性炭和生物炭由于具有生物毒性,在培养初期会抑制微生物还原As(Ⅴ)-FH过程中铁的还原和Fe2+的释放。
(2)在培养中期微生物逐渐适应培养环境,铁矿的还原持续进行,反应结束时活性炭和生物炭显著增加了As(Ⅴ)-FH中铁还原的比例。

图6 蓝铁矿和菱铁矿的SEM-EDX元素面扫Figure 6 SEM-EDX mapping the elemental composition of Fe,P,and As in the secondary minerals
(3)活性炭和生物炭抑制微生物还原As(Ⅴ)-FH过程中溶液中As的去除。
(4)活性炭和生物炭减缓了次生矿物生成的速度,改变了次生矿物的种类。
(5)蓝铁矿和菱铁矿两种次生矿物依次生成,As主要累积在蓝铁矿中。

