桑葚花色苷的提取纯化及稳定性
唐 榕,宁恩创,林 莹
(广西大学轻工与食品工程学院,广西南宁 530004)
桑葚为桑科桑属(MorusalbaL.)的聚花果,在广西分布广泛、资源丰富[1]。桑葚果成熟期为4~6月份,味酸甜可口,其富含花色苷[2]。花色苷不仅是桑葚重要的活性物质之一,也是桑葚主要的呈色物质,它使桑葚色泽表现为紫红色或紫黑色[3]。作为天然色素,花色苷安全无毒,并且具有抗氧化、抗癌、缓解视疲劳等功效[4-5],在食品、保健品、化妆品等领域有着巨大的应用前景。花色苷作为桑葚中主要活性因子,在食品加工中易降解和损失,导致产品品质降低。因此,研究桑葚花色苷适宜的加工与贮藏条件,对其最终能否得到有效利用至关重要。朱庆珍等[6]、姜少娟[7]仅对桑葚色素粗提物进行了稳定性研究,而本研究先对桑葚花色苷纯化,再研究其稳定性,能更近于真实的了解温度、pH、光照等加工条件对花色苷的影响。
本文拟通过单因素实验探明桑葚花色苷提取的适宜条件,以大孔树脂为填料,通过柱层析对提取液进行纯化,确定花色苷适宜的加工与贮存条件,为桑葚花色苷的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
桑葚 -18 ℃冷冻保存,市售;大孔树脂HPD600、D101、LX1180、AB-8、DA201-C 陕西乐博生化科技有限公司;无水乙醇、柠檬酸、磷酸氢二钠等 分析纯,天津市大茂化学试剂厂;乙腈、甲酸、甲醇 色谱纯,天津市科密欧化学试剂有限公司;矢车菊素-3-O-葡萄糖苷标准品 HPLC≥98%,北京北纳创联生物技术研究院。
UV-6100紫外可见分光光度计 上海美谱达仪器有限公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;Beta 2-8 LSCplus实验室冷冻干燥机 德国CHRIST公司;CM-3600d色差计 柯尼美能达有限公司;HL-2B数显恒流泵、BSZ-160F电脑自动部分收集器 上海精科实业有限公司;Agilent 1200 HPLC色谱仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 桑葚花色苷提取条件的确定 桑葚于4 ℃解冻,打浆,参照文献[7,10-11]确定料液比为1∶10。乙醇浓度的确定:取5 g桑葚浆,按料液比加入不同浓度(30%~80%)的酸化乙醇溶液(含0.1% HCl),超声功率150 W,提取1 h,抽滤,计算花色苷得率,确定最佳乙醇浓度;超声时间的确定:取5 g桑葚浆,按料液比(1∶10)加入40%酸化乙醇溶液,在不同的超声时间(30~110 min)下进行提取,抽滤,计算花色苷得率,确定最佳超声时间。
1.2.2 桑葚花色苷的纯化
1.2.2.1 树脂筛选 于510 nm下测定花色苷粗提液吸光值A0。分别准确称取活化后的HPD600、D101、LX1180、AB-8、DA201-C大孔树脂湿态体积5 g,加入同浓度的花色苷粗提液60 mL,在100 r/min的转速下25 ℃振荡24 h,充分吸附后,过滤,测滤液吸光值A1。将滤出的树脂加入到60 mL 60%乙醇溶液(HCl调至pH3),在100 r/min的转速下室温振荡24 h,充分解吸后过滤,测滤液吸光值A2。以吸附率及解吸率为指标,筛选出对桑葚花色苷的吸附及解吸性能均较好的树脂。
吸附率(%)=(A0-A1)/A0×100
解吸率(%)=A2/(A0-A1)×100
1.2.2.2 静态吸附/解吸曲线 称取活化后的大孔树脂5 g于三角瓶中,加入60 mL 0.1 mg/mL的桑葚花色苷粗提液,25 ℃、100 r/min振荡,每隔一段时间测定花色苷含量,对时间作图,绘制静态吸附曲线;将滤出的树脂,加入60 mL 60%乙醇溶液(pH3),25 ℃、100 r/min振荡,每隔一段时间测定花色苷含量,对时间作图,绘制静态解吸曲线。
1.2.2.3 纯化方法 以1.2.2.1中筛选出的树脂为填料。提取液经8000 r/min离心10 min、抽滤、过0.22 μm滤膜,稀释上样液花色苷溶液浓度至0.1028 mg/mL,通过恒流泵以1 mL/min的速率上样,用部分收集器每10 min收集一次流份,以管数为横坐标,流出液中花色苷含量为纵坐标,绘制动态泄露曲线。
先以水洗脱糖分等杂质,再用60%乙醇溶液(pH2)洗脱色素溶液,洗脱流速1 mL/min,以洗脱管数为横坐标,流出液中花色苷含量为纵坐标绘制动态洗脱曲线。洗脱液经45 ℃真空旋转蒸发后进行真空冷冻干燥(冻干温度25 ℃),备用。
1.2.2.4 高效液相色谱条件 样品及标准品用50%甲醇(含0.1% HCl)溶解;色谱柱:Agilent Eclipse XDB-C18;流动相:A液为乙腈,B液为10%的甲酸水溶液,线性梯度洗脱:0~15 min,A液由5%升至15%;15~21 min,A液由15%升至28%;21~22 min,A液由28%升至40%,流速1 mL/min,检测波长520 nm,进样体积20 μL。
1.2.3 纯化后桑葚花色苷稳定性研究
1.2.3.1 温度对桑葚花色苷稳定性的影响 将花色苷溶液分别置于25、50、70、90 ℃下,于1、2、3、4 h测定提取液颜色、花色苷保存率。
1.2.3.2 光照对桑葚花色苷稳定性的影响 将花色苷溶液分别置于室内光(50~100 Lux)、室外光(5万~6万 Lux)及避光条件下,每天测定提取液颜色、花色苷保存率。
1.2.3.3 pH对桑葚花色苷稳定性的影响 将花色苷溶液分别用pH3~6的缓冲液稀释15倍,以蒸馏水稀释的溶液作为对照组。取稀释后的溶液50 mL置于避光条件下,3 d后测定提取液颜色、花色苷保存率。
1.2.3.4 金属离子对桑葚花色苷稳定性的影响 将Na+、Mg2+、Al3+、Cu+、Cu2+、Fe2+、Fe3+分别加入到花色苷溶液中,使各金属离子终浓度为5 mmol/L。避光放置,每天测定提取液颜色、花色苷保存率。
1.2.4 测定方法 总花色苷的测定:采用pH示差法[8]。将1 mL待测液分别加入9 mL pH1.0和pH4.5的缓冲液,分别在510 nm和720 nm下测定吸光度;
花色苷得率(mg/g)=提取液中花色苷质量(mg)/称取的桑葚质量(g);
花色苷保存率(%)=C/C0×100
式中,C为处理后花色苷含量(mg/mL),C0为初始含量(mg/mL)。
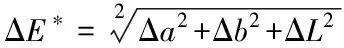
式中,Δa为处理后样品与初始样品的红绿值之差;Δb为处理后样品与初始样品的黄蓝值之差;ΔL为处理后样品与初始样品的亮度值之差。

色价测定参考胡金奎[10]的方法。
1.3 数据处理
每个样品设3个平行,采用Origin 8.6和SPSS 19.0软件进行数据分析。采用ANOVA中的Duncan分析差异性,以p<0.05为差异显著。
2 结果与分析
2.1 桑葚花色苷提取条件的确定
2.1.1 乙醇浓度的确定 花色苷类通常带有若干未被取代的羟基或糖基,是一种极性化合物。又因为花色苷在中性和碱性条件下不稳定,所以目前一般采用盐酸化的醇作为提取液。
2.1.2 超声时间的确定 超声波可产生空化效应和局部高温,使细胞破裂而促进花色苷的溶出。图2结果显示,超声时间小于90 min时,随着超声时间的增加,花色苷得率增高。但当超声时间大于90 min时,花色苷得率反而下降,这可能是由于超声时间过长对一些花色苷造成了破坏。因此,超声时间选择90 min。

图2 超声时间对桑葚花色苷得率的影响Fig.2 The effect of ultrasonic time on the extraction yield of anthocyanin
综上,确定桑葚花色苷的提取条件为:40%乙醇溶液(含0.1% HCl),料液比1∶10,超声提取90 min,得率(2.9±0.1) mg/g。抽滤后40 ℃下真空浓缩,4 ℃冷藏备用。
2.2 桑葚花色苷的纯化
2.2.1 大孔树脂的筛选 不同树脂的静态实验结果比较见表1,大孔树脂是物理性吸附,主要影响其性能的指标是极性和比表面积。综合吸附和解吸效果来看,HDP600 表现较好,是用于纯化桑葚花色苷较理想的树脂。

表1 不同大孔树脂的静态吸附和解吸性能Table 1 Static adsorption and desorption properties of different macroporous resin
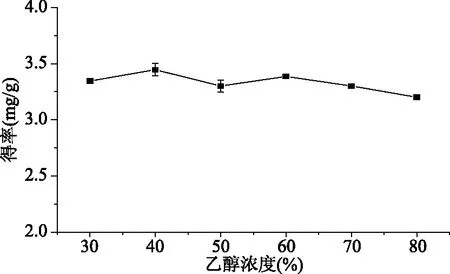
图1 乙醇浓度对桑葚花色苷得率的影响Fig.1 Effects of ethanol concentration on extraction yield of anthocyanin
2.2.2 HDP600的静态吸附/解吸曲线 图3显示,HPD600对桑葚花色苷的吸附、解吸属于快速平衡型。在吸附和解吸过程的前30 min花色苷含量变化最大,随后变化逐渐放缓。吸附在120 min左右达到平衡,解吸在90 min左右即达到平衡。
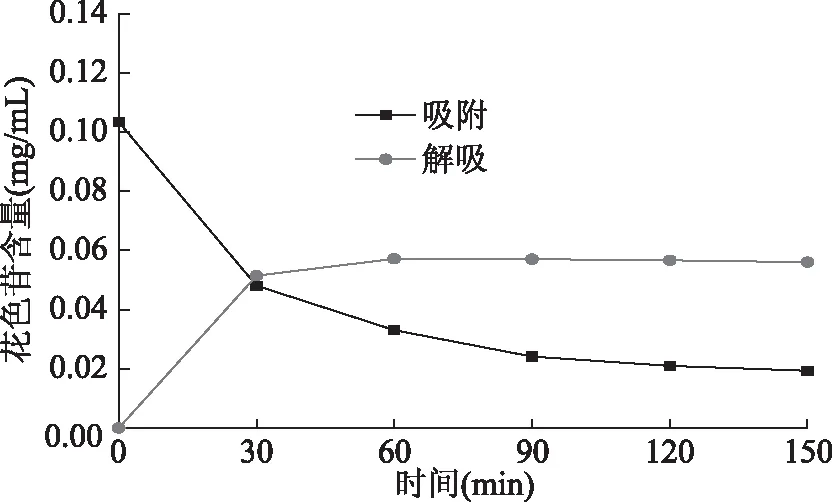
图3 HDP600静态吸附/解吸曲线Fig.3 Static adsorption/desorption curve of HPD600
2.2.3 动态泄露曲线 上样初期,花色苷在大孔树脂表面充分进行扩散,花色苷充分被树脂吸附,因此流出液中未检测到花色苷。随着上样量的增多,部分树脂逐渐吸附饱和,吸附力减弱,未被吸附的少量花色苷随着洗脱液流出。当树脂完全吸附饱和时,花色苷类物质透过树脂,流出液中花色苷含量急剧增大,此时大孔树脂无法吸附更多的花色苷,即大孔树脂的吸附达到泄漏点,应停止上样。因此,在1 mL/min的上样流速下,每1 mL湿树脂可以处理33.17 mL浓度为0.1028 mg/mL的花色苷溶液。
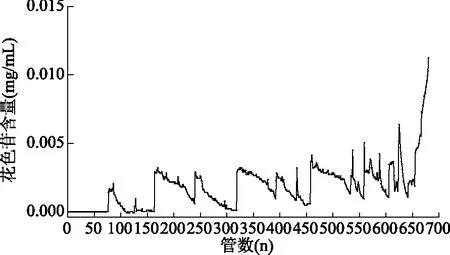
图4 HDP600吸附桑葚花色苷的动态泄露曲线Fig.4 Dynamic leakage curve of HPD600 adsorbed anthocyanin
2.2.4 动态洗脱曲线 由图5可以看出,洗脱峰较为明显,说明洗脱物质较为集中,有利于随后的浓缩。当洗脱液用量为105管(1050 mL)时,即约5倍柱体积,花色苷基本洗脱完毕,此后流出液中虽然残留有花色苷,但含量较少,就效益考虑,可以放弃收集剩下的洗脱液。

图5 HDP600的动态洗脱曲线Fig.5 Dynamic elution curve of HPD600
2.2.5 纯化后桑葚花色苷的液相色谱图 纯化后样品的第二个峰出峰时间为8.394 min,与标准品的出峰时间8.296 min接近。将标准品加入样品后,第二个峰出峰时间为8.270 min,且峰面积所占比例明显增大。由此可以推测,树脂纯化后样品中第二个峰为矢车菊素-3-O-葡萄糖苷。B中第二个峰面积为41.2%,可推测纯化后样品中矢车菊素-3-O-葡萄糖苷的相对含量为41.2%左右。
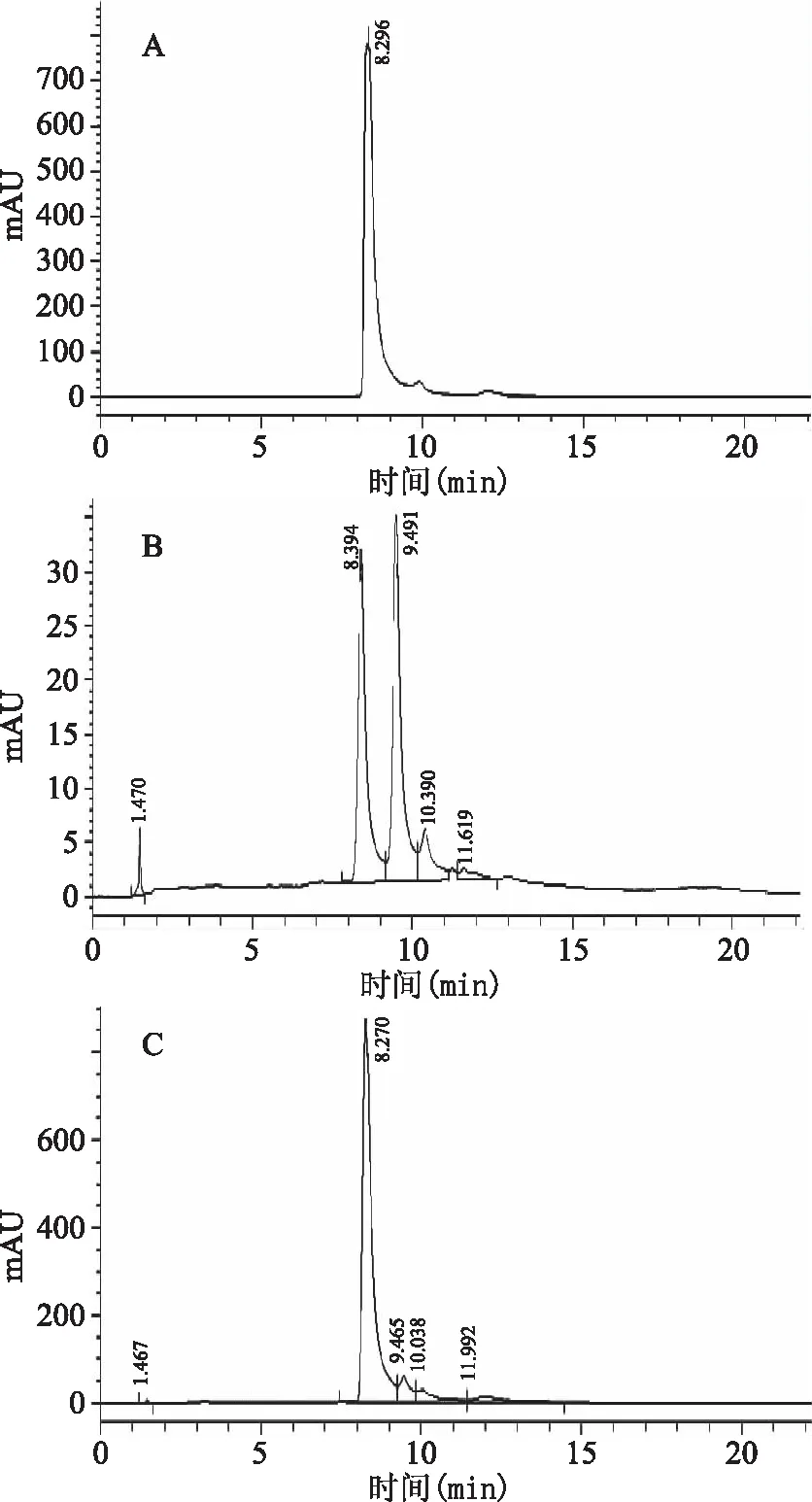
图6 高效液相色谱图Fig.6 High performance liquid chromatography注:检测波长520 nm,A:矢车菊素-3-O-葡萄糖苷标准品,B:树脂纯化后样品,C:加标样品。
2.2.6 纯化前后产品比较 由表2可以看出,树脂纯化后,产品色价、总花色苷含量均有所提高,除糖率67.6%,由于糖分的减少,使得产品呈干燥粉末状,更易于保存。赵云霞[13]采用D101树脂对桑葚色素进行纯化,色价是未纯化的4.39倍,除糖率为39.5%,前者高于本文测定值,但后者低于本文测定值。

表2 纯化前后产品比较Table 2 Comparison of products before and after purification
2.3 稳定性实验
2.3.1 温度对桑葚花色苷稳定性的影响 花色苷的稳定性明显受到温度影响,如图7所示,随着温度的升高,桑葚花色苷的保存率降低、色差变化程度加剧。Laleh等[14]研究不同温度下血红小檗等四种浆果花色苷的降解情况,推测可能是由于高温下花色苷C3位上糖基发生水解,导致稳定性降低。此外,温度增加时,花色苷的构型会向查耳酮式转换[12],从而导致溶液变色。在25 ℃下放置4 h,花色苷含量无显著性差异(p>0.05),表明花色苷可以在25 ℃下放置。高温、长时间加热会加速花色苷的降解,因此,花色苷的保存与加工应尽量在较低温度下、较短时间内进行。
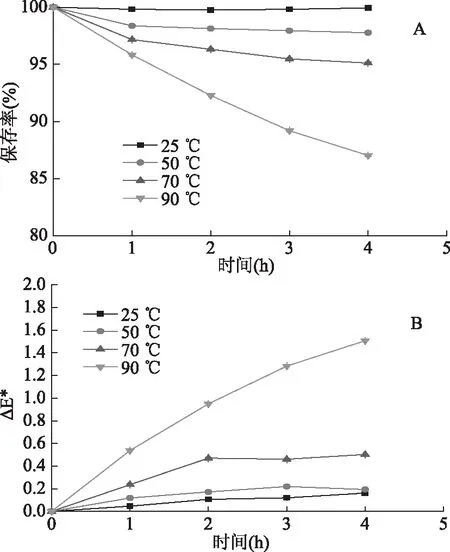
图7 温度对桑葚花色苷稳定性的影响Fig.7 Effect of temperature on the stability of mulberry anthocyanin
2.3.2 光照对桑葚花色苷稳定性的影响 如图8所示,室外光下(5~6万Lux)花色苷的稳定性明显变差,与室内光(50~100 Lux)和避光(0 Lux)相比,室外光下保存率急剧下降,总色差变化急剧上升。4 d后室外光下桑葚花色苷的保存率低于60%。避光和室内光条件下花色苷保存率的变化无显著性差异,室内光的色差变化稍大于避光。尤扬等[15]的研究显示,碧桃花色苷的光稳定性好,在室外自然光和黑暗条件下无显著性差异。这表明不同来源的花色苷其单体种类和比例不同,因此对光的稳定性可能存在一定的差异。本研究结果提示,桑葚花色苷需避免暴露在室外强光下,应在室内光及避光条件下进行贮存与加工。

图8 光照对桑葚花色苷稳定性的影响Fig.8 Effects of light on the stability of mulberry anthocyanin
2.3.3 pH对桑葚花色苷稳定性的影响 在不同的酸碱条件下,花色苷4种构型的比例会发生变化,从而导致色泽和颜色强度的改变,甚至造成花色苷的降解。如图9所示,在25 ℃下放置3 d后,随着pH的增大(对照组pH为2左右),花色苷的保存率显著降低,色差变化加剧。李杨等[16]研究也表明,葡萄皮花色苷在常温下放置30 h,随着pH由2上升到6,保留率由90%下降到75%。因此,在贮存与加工时,应使花色苷溶液维持在尽可能高的酸性条件下。

图9 酸碱度对桑葚花色苷稳定性的影响Fig.9 Effect of pH on the stability of mulberry anthocyanin
2.3.4 金属离子对桑葚花色苷稳定性的影响 不同金属离子对桑葚花色苷的影响不同。如图10所示,Na+、Mg2+、Al3+对花色苷的稳定性影响不大,而加入Cu2+和铁离子的花色苷溶液保存率降低,溶液色泽变化大,尤其是Fe3+对桑葚花色苷的破坏程度最大,且随着时间的增加,Fe2+被氧化成Fe3+,加入Fe2+的花色苷溶液变化趋势接近Fe3+。张志博等[17]的研究也表明,Fe3+、Cu2+对越橘花色苷的稳定性影响较大,并推测可能是花色苷中的酚羟基结构与 Fe3+、Cu2+发生反应生成沉淀,使其稳定性降低。但王露等[18]研究发现,Fe3+对红肉桃花色苷的稳定性有显著的保护作用。这表明金属离子对不同花色苷稳定性的影响不同。对桑葚花色苷而言,应尽可能避免使用铜、铁容器进行加工与贮存。

图10 金属离子对桑葚花色苷稳定性的影响Fig.10 Effect of metal ions on the stability of mulberry anthocyanin
3 结论
桑葚花色苷提取的适宜条件为:提取液为40%乙醇溶液(含0.1% HCl),料液比1∶10,超声时间90 min,在此条件下花色苷得率为2.9 mg/g。从5种不同树脂中筛选出HPD600树脂作为纯化填料,纯化后得到的产品为紫黑色粉末,色价为46.1,除糖率为67.6%,总花色苷含量为16.7%,采用高效液相分析出树脂纯化后的样品中矢车菊素-3-O-葡萄糖苷的相对含量为41.2%左右。稳定性实验表明,温度、光照、pH、金属离子均会影响花色苷的保存率及色泽变化程度,高温、室外光(5~6万Lux)、偏碱性条件、铜离子和铁离子均会降低桑葚花色苷的稳定性。因此,桑葚花色苷的贮存与加工应在低温、避光、低pH条件下进行,并且应避免接触铜离子、铁离子。

