基于代谢组学技术的鹿血与鹿茸血鉴别研究
张然然,王 磊,李 洋,徐佳萍,邢秀梅
(中国农业科学院特产研究所 特种经济动物分子生物学重点实验室,长春 130112)
鹿血泛指鹿科动物梅花鹿和马鹿的血液,在《本草纲目》中记载为大补虚损、益精血。现代研究显示,鹿血具有延缓衰老[1]、抗疲劳[2]、增强免疫力[3-4]、抗氧化[5-6]等功能,富含蛋白质、脂肪酸、维生素等物质[7]。鹿茸血是指用真空泵或分离机从新锯鹿茸中提取出来的血液,鹿茸血稀少而珍贵。其性热而不燥,补肾壮阳,强筋健骨,生精益髓,含有丰富的必须氨基酸、磷脂、矿物质、胶原蛋白、蛋白聚糖、硫酸软骨素、硫酸葡萄糖胺、透明质酸、核苷酸、生长激素等[8]。经研究显示,鹿茸血中的前列腺素、脂肪酸、单胺类物质、孕酮、皮质醇等含量显著高于鹿血,而鹿血中的雌二醇、磷脂、多胺类物质的含量显著高于鹿茸血[9]。但也有学者认为,鹿茸血和鹿血具有类似的活性成分与药理功效。究竟鹿茸血与鹿血的化学成分上有无差异,需要做出全面的分析。
代谢组学是继基因组学和蛋白质组学之后新兴的一门学科,是系统生物学的重要组成部分,通过高通量、高分辨率的分析检测技术,在整体上分析探讨生命活动在代谢层面的特征和规律[10-12],基因与蛋白质表达的微小变化会在代谢物上得到放大,从而使检测更容易。近些年,在中药研究领域得到了广泛的应用,如潜在活性成分挖掘[13-14]、药代动力学研究[15]、中药质量控制与鉴别[16-17]等。从分析技术的角度来看,非靶向代谢组学是尽可能多地定性和相对定量生物体系中的代谢物,最大程度反映总的代谢物信息[18]。色谱-质谱技术(LC-MS)是以高效液相色谱作为分离系统,高分辨率质谱为检测系统的一种串联分析平台;与GC-MS技术相比,LC-MS更适用于分析难挥发、热稳定性差的代谢物[19]。
目前,超高效液相色谱与四级杆-飞行时间质谱联用(UPLC-QTOF-MS)技术已被广泛用于非靶向代谢组学的研究,超高效液相色谱应用1.7 μm超细粒径填料填充的色谱柱,比传统的HPLC的分析速度、灵敏度、分离度都有显著的提升。为全面的分析、比较鹿茸血与鹿血的代谢物差异,本研究采用UPLC-QTOF-MS技术,结合数据依赖采集方式对样本进行全谱分析,同时获得一级质谱和二级质谱数据,随后对数据进行峰提取、统计学分析及代谢物鉴定,以筛选出鹿茸血与鹿血的差异代谢物。
1 材料与方法
1.1 主要试剂与仪器
甲醇、乙腈、醋酸铵、氨水的LCMS级皆购自CNW Technologies;水由纯水仪提供。
超高效液相(Agilent 1290 UHPLC, Agilent),高分辨质谱(AB Triple TOF 5600, AB Sciex),色谱柱(ACQUITY UPLC BEH Amide 1.7 μm 2.1*100 mm,Waters),离心机(Thermo Scientific Heraeus Fresco17 centrifuge),涡旋仪(VORTEX-5, 其林贝尔仪器制造有限公司),天平(BSA124S-CW,赛多利斯科学仪器(北京)有限公司),纯水仪(明澈 D24 UV, Merck Millipore, Germany),超声仪(PS-60AL,深圳市雷德邦电子有限公司)。
1.2 试验样品
血液样品来自于长春东大鹿业有限公司所饲养的10头5岁纯种东北梅花鹿,这些梅花鹿亲缘关系较近,体型一致,健康状况良好,连续3年的产茸量相当,且长期饲养在同一圈舍。鹿茸血为新鲜鹿茸排出血液,鹿血为梅花鹿颈静脉血液,每组样品共10份。 血液样本用添加分离胶的促凝管收集,3 000 r·min-1离心15 min,得到血清样本。
1.3 代谢物提取
移取100 μL血清样品至1.5 mL离心管中,加入300 μL甲醇,涡旋混匀30 s,超声10 min(冰水浴),-20 ℃ 静置1 h;之后 4 ℃,13 000 r·min-1离心15 min;小心地取出200 μL上清于2 mL液相色谱进样瓶,每个样本各取10 μL混合成QC质控样本,再取60 μL上机检测。
1.4 上机检测
试验所用液质联用系统由Aglient 1290 UPLC串联AB Sciex Triple TOF 5600高分辨质谱仪组成。所使用的色谱柱为Waters的UPLC BEH Amide 色谱柱 (1.7 μm 2.1*100 mm)。流动相为25 mol·L-1醋酸铵及25 mmol·L-1氨水的水溶液(A液),纯乙腈(B液)。梯度洗脱:0~0.5 min,95% B液;0.5~7 min,95%~65% B液;7~8 min,65%~40% B液;8~9 min,40% B液;9~9.1 min,40%~95% B液;9.1~12 min,95% B液。流速为500 μL·min-1,柱温40 ℃,正离子扫描模式进样量3 μL,负离子扫描模式进样量4 μL。
质谱条件:利用AB 5600 Triple TOF质谱仪进行一级、二级质谱数据采集。质谱扫描质核比范围 为100~1 200,轰击能量:30 eV。离子源(ESI)参数设置:雾化气压(GS1)为60 Psi,辅助气压为60 Psi,气帘气压为35 Psi,温度为650 ℃,喷雾电压为5 000 V (正离子扫描模式),-4 000 V(负离子扫描模式)。
1.5 数据处理
获得的质谱原始数据通过MSconventer软件转换为mzXML格式,使用XCMS软件(版本号:1.41.0)做峰寻找、滤噪、样本间峰匹配、保留时间校正和缺失峰补齐等数据处理。使用SIMCA软件(Version 14.1)对整理好的数据进行PCA、OPLS-DA等多元变量模式识别分析。PCA可以揭示数据的内部结构,从而更好的解释数据变量。而通过OPLS-DA分析,可以过滤掉代谢物中与分类变量不相关的正交变量,从而获取更加可靠的代谢物组间差异与试验组的相关程度信息。
用VIP(OPLS-DA模型第一主成分的变量投影重要度)结合t检验(student’st-test)来筛选差异代谢物,再通过离子质核比和精确分子量来推断代谢物的分子式,由分子式及二级质谱信息在Metlin数据库中搜索可能的结构。
2 结 果
2.1 鹿血与鹿茸血代谢产物的鉴定
UPLC-QTOF-MS 获得的原始数据经XCMS软件[20]做峰寻找、峰对齐、峰过滤等数据处理,为保证数据的完整性,本研究采用了正、负两种离子扫描模式。其中在正离子扫描模式下共提取118种化合物,负离子扫描模式下提取到107种化合物。图1为两种采集模式下得到的色谱图,结果显示,鹿血与鹿茸血在两种离子采集模式下,其峰型基本一致。
2.2 鹿血与鹿茸血代谢物多元统计分析
为进一步探究鹿血与鹿茸血在代谢物层面上是否有差异,该试验运用了多元统计分析,如PCA、OPLS-DA。经无监督三维 PCA 统计分析结果显示(图2),大部分鹿血与鹿茸血样本能够区分开来,说明鹿茸血和静脉血中的代谢物是有区别的,但分离效果不理想。因而采用有监督的模式识别方法—正交偏最小二乘判别分析(OPLS-DA)对代谢组数据重新进行分析。与无监督PCA相比,OPLS-DA能够将组间差异放大,并得到更好的分类效果。OPLS-DA分析结果显示(图3),鹿血样品与鹿茸血样品分离较为明显,其中正离子扫描模式下的预测主成分与正交主成分对X变量的累计解释度R2X(cum)=0.288,对Y变量的累计解释度R2Y(cum)=0.974,模型的可预测性Q2(cum)=0.762;负离子扫描模式下的预测主成分与正交主成分对X变量的累计解释度R2X(cum)=0.249,对Y变量的累计解释度R2Y(cum)=0.984,模型的可预测性Q2(cum)=0.840,说明分离效果较好,进一步证明了鹿血与鹿茸血在小分子代谢物层面上有着明显区别。

图1 UPLC-QTOF-MS检测总离子流图Fig.1 Total ion chromatogram detected by UPLC-QTOF-MS
2.3 鹿血与鹿茸血差异代谢物筛选
为进一步深入探究鹿血与鹿茸血小分子代谢物的差异,根据代谢物的表达量进行差异代谢物筛选,并设置筛选条件:VIP>1,P<0.05,差异倍数>1.5倍,其中 VIP代表该物质在OPLS-DA模型得到的变量投影重要度。共成功筛选出28种差异代谢物(表1)。其中上调代谢物有20种,主要为核苷类、有机酸类、脂类等;下调的有8种,主要为糖类、有机酸类。其中差异倍数最大的为下调化合物7-酮基胆固醇与上调化合物麦角硫因,分别为0.21与3.23倍。
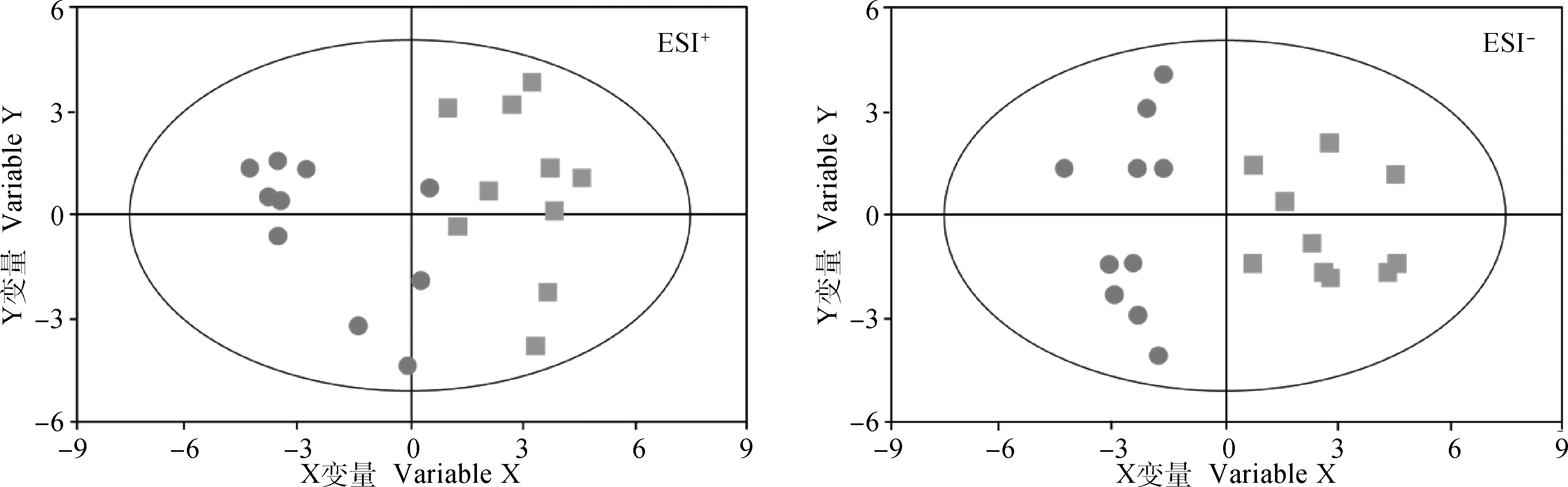
图2 鹿血组(圆形)对鹿茸血组(方形)的PCA得分散点图Fig.2 Score scatter plots of PCA model for deer blood (circle) vs. antler blood (square)

图3 鹿血组(圆形)对鹿茸血组(方形)的OPLS-DA得分散点图Fig.3 Score scatter plots of OPLS-DA model for deer blood (circle) vs. antler blood (square)
表1差异代谢物信息
Table1Informationsfordifferentiallyexpressedmetabolites

名称Name得分Score显著性P-value差异倍数Fold-change2-羟基腺嘌呤 2-hydroxyadenine0.902.65E-071.76麦角硫因 Ergothioneine0.823.62E-053.23胞嘧啶核苷 Cytidine1.003.41E-052.45尿嘧啶核苷 Uridine0.663.70E-062.84阿卡地辛(药) Acadesine (Drug)1.002.31E-041.88脯氨酰谷氨酸 Prolyl-glutamate0.967.80E-041.85胞嘧啶核苷 Cytidine0.958.19E-052.25

(转下页 Carried forward)
3 讨 论
鹿茸血与鹿血同样是名贵的中药材,而且行驶着类似的药理作用,但二者在化学成分与药理疗效方面是否有区别,区别是什么,迄今为止仍没有明确的解释。随着质谱技术的发展,代谢组学也逐渐应用到了中药领域,主要用于活性物质的挖掘、中药材质量控制等方面。
本研究采用基于UHPLC-QTOF-MS技术的代谢组学方法分析了梅花鹿茸血与鹿血的代谢物差异。试验结果显示,鹿茸血与鹿血在不同个体间存在差异,整体上,鹿茸血与鹿血也存在显著的差异,但仅是在代谢物的含量上存在差异,代谢物的种类没有差异,这与前人的研究结果一致[7]。将筛选出的差异代谢物进行二级质谱水平上的鉴定,结果成功鉴定出了28种代谢物,其中脂类、核苷酸类代谢物在鹿茸血中表达水平较高,而糖类在鹿血中表达水平较高。由于鹿茸血是源于鹿茸组织中的血液,势必会携带鹿茸组织中的某些物质,所以推测,鹿茸血中高含量的脂类、核苷酸类代谢物来自于鹿茸组织。其中麦角硫因是差异最为显著的代谢物之一,查询文献得知,麦角硫因是一种天然抗氧化剂[21],具有清除自由基[22],解毒,维持DNA生物合成[23]、细胞正常生长及细胞免疫等多种生理功能[24],主要存在于蘑菇、黑豆、红豆、燕麦麸等食物中[25]。但至今还没有动物机体合成麦角硫因的证据,所以鹿茸血与鹿血中的麦角硫因很可能是来源于饲料。但为何在鹿茸血中的含量高于鹿血还需要进一步的探究。鹿茸血中7-酮基胆固醇含量显著低于鹿血,其是胆固醇氧化产物的主要成分之一,存在于动物的多种组织中,并具有多种生物学作用,如抑制胆固醇合成酶活性和细胞毒性等,最近研究还显示,7-酮基胆固醇在动脉粥样硬化形成、诱导胰岛β细胞凋亡过程中也起着重要作用[26]。本研究不仅在代谢组水平上将鹿血与鹿茸血区分开来,也为鹿血、鹿茸血相关产品的深度开发提供了理论基础。
4 结 论
本研究结果显示,在小分子代谢物种类上鹿血与鹿茸血并无差异,只是在含量上有所差别,而且在OPLS-DA模型上分离明显。差异代谢物筛选结果显示,脂类、核苷酸类代谢物在鹿茸血中的含量较高,天然抗氧化剂麦角硫因也在鹿茸血中的含量较高。

