新疆哈萨克族奶酪中潜在益生酵母菌的筛选
刘飞,郭孝敬,陈欢,史学伟,王斌,郑晓吉
(石河子大学 食品学院,新疆 石河子,832003)
酵母菌在人类社会的发展中具有重要作用,不仅在医药学、环境方面的应用与日俱增[1],在食品行业中,酵母菌在制作面包、奶酪、啤酒、葡萄酒等发酵型产品时,也有十分广泛地应用,是极为重要的添加物[2]。它能够在发酵过程中影响产品的风味[3],并且具有潜在益生特性的酵母菌还能抑制病原菌微生物和梭状芽孢杆菌等有害菌的生长[4],并产生多种水溶性维生素,提高发酵乳制品的营养物质,为人体提供潜在益生功效[5-6]。目前,有相关报道从婴幼儿粪便和乳制品中发现了具有潜在益生特性的酵母菌,如酿酒酵母(S.cerevisiae)和东方伊萨酵母(I.orientalis)等,它们能在低pH 值和胆盐环境下生存,具备在人体胃肠道内生存的能力。将这些具有益生特性的酵母菌作为生物治疗剂,能够抑制或治疗与抗生素相关的腹泻和肠炎、预防和治疗急性痢疾[7]、降低胆固醇[8]、抗辐射[9]和抗氧化[10]等益生功效。现今,国外的一些发酵乳制品中,如Kefir、Viili(酸乳酒)、Cantal(康塔尔坎特尔干酪)干酪、Camembert(法国卡门贝所产的软质乳酪)干酪,均添加酵母菌赋予产品特殊的风味和较高营养品质[2]。但是也有一部分酵母菌是在食品制作过程中的污染菌、腐败菌和有害菌,使产品品质下降并出现产气、有酵母味或其他异味、引起质构变化、变色等[6,11],因此我们要准确找出对人体有潜在益生性的酵母菌,使益生酵母菌在食品行业中发挥更大的作用。
我国境内的新疆哈萨克族牧民常年居住在新疆天山山脉脚下,长期饮用含氘量很少的冰川水和冰雪融水,拥有优质的奶源,在这种得天独厚的条件下,悠久历史的哈萨克族奶酪中蕴含了丰富多样的酵母菌菌种资源,为新疆哈萨克族奶酪提供了独特的风味和极高的营养价值。近年来,随着我国乳品行业的迅速发展,市场的不断扩大,从哈萨克族奶酪中筛选出具有潜在益生特性的酵母菌应用于乳制品加工中,开发新型乳制品迫在眉睫。新产品的开发将伴随新疆地区乳品行业的又一个发展热潮。
1 材料与方法
1.1 样品采集
从新疆哈萨克族聚居的吉木乃(N)、阿勒泰(L)、伊宁(Y)、和分县(F)地区,每地采集5块奶酪样品,用保鲜袋封装后贴上标签放入- 4 ℃的手提式冰盒内保藏,18 h内运回实验室,在4 ℃下冷藏保存。选取出18株生长状况良好酵母菌L5、Y1、Y36-6、N9、L1、H2、N6、L3、H6、H1、F3、F1、N香、N2、N1、H3、Y2、L4,从中筛选出具有益生特性的酵母菌。
1.2 试剂
葡萄糖、酵母浸粉、琼脂粉,北京奥博星生物技术有限责任公司;蛋白胨,天津市北方天医化学试剂厂;NaOH、HCl,天津市致远化学试剂有限公司;胆盐,天津永晟精细化工厂有限公司;胃蛋白酶,天津市福晨化学试剂有限公司;PBS磷酸缓冲液,天津市富宇精细化工有限公司。
1.3 培养基
YEPD液体培养基:酵母浸粉10 g、蛋白胨20 g、葡萄糖20 g、蒸馏水1 L;
YEPD固体培养基:酵母浸粉10 g、蛋白胨20 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L;
胆盐培养基:酵母浸粉10 g、蛋白胨20 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L、胆盐1、3、5 g/L;
酸性培养基:酵母浸粉10 g、蛋白胨20 g、葡萄糖20 g、蒸馏水1 L、pH值为1.5、2.0、3.0、5.0、6.5;
LB培养基:蛋白胨10 g、酵母浸粉5 g、NaCl 10 g、琼脂15 g、pH 7.4~7.6、蒸馏水1 L;
牛肉膏蛋白胨培养基:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、琼脂20 g、pH 7.0~7.2、蒸馏水1 L。
1.4 仪器及设备
高速冷冻离心机5810R(德国eppendorf仪器公司),万分之一天平BS224S(美国 Mettler Toledo 公司),冷藏冷冻箱BCD-265F(荣事达集团),全自动高压灭菌锅LAC-5040S(浙江新丰医疗器械有限公司),标准型pH计pHS-3C(上海精密科学仪器有限公司),光学显微镜CX21FS1(Olympus 公司),紫外分光光度计722光栅(上海精密科学仪器有限公司),超净工作台SW-CJ(苏州安泰空气技术有限公司),智能生化培养箱Bnp-9272(上海精宏试验设备有限公司),水浴恒温振荡器SHZ-B(上海博讯实业有限公司),PCR扩增仪TC-512(英国Techne公司),水平电泳仪Power Pac Universal(美国BioRad公司),凝胶成像系统Gel DOC XR(美国BioRad公司)。
2 试验方法
2.1 潜在益生酵母菌的筛选
2.1.1 耐酸试验
在筛选实验中,将培养基调配为5种不同的pH值(1.5、2.0、3.0、5.0和6.5)来测试18株酵母菌的耐酸能力。将活化后的菌悬液以4%的接种量分别接种于5种不同pH值的液体筛选培养基中[12],取pH值6.6为空白对照。在30 ℃,180 r/min的摇床上培养24 h 后测定OD600nm下的吸光度。
2.1.2 耐胆盐试验
将具有酸耐受性的酵母菌,接种在含猪胆盐质量浓度为0、1、3、5 g/L的固体胆盐培养基中,培养48 h后进行菌落平板计数法计算活菌数[2]。观察酵母菌株在不同胆盐质量浓度下的生长状况,对胆盐的耐受能力用公式(1)表示:
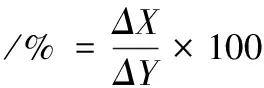
(1)
式中:ΔX,含有胆盐的培养基中细胞增长数量;ΔY,不含胆盐的培养基中细胞增长数量。
2.1.3 模拟人体温度下的生长测试
将菌液接种到YEPD固体培养基上,每组2个平行,在30 ℃,180 r/min摇床上培养24 h后进行活菌平板计数。
2.1.4 模拟人体胃液环境
将筛出的酵母菌进行活化后,取30 mL酵母菌培养物在4 ℃,3 000g下离心10 min,细胞用灭菌后的PBS缓冲溶液(0.1 mol/L,pH 7.2:内含80 g/L NaCl)按1∶9比列稀释。然后取0.1 mL悬浮液添加到1.0 mL模拟胃液中,模拟胃液[13]:含3 g/L胃蛋白酶和5 g/L NaCl,加HCl调节pH值为1.2。混合物在30 ℃、150 r/min摇床上培养2 h后,用紫外分光光度计测培养前后的OD600 nm值,计算菌数变化,用公式(2)表示:
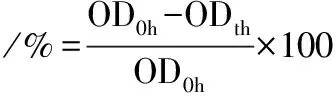
(2)
式中:OD0h,没有放入模拟胃液中的初始吸光度;ODth,在模拟胃液中培养若干小时之后的吸光度。
2.1.5 抑菌性试验
人体胃肠道内菌种复杂,而益生菌的增多能够抑制有害菌的生长,对人体健康有益。采用牛津杯法进行抑菌试验,将筛出的酵母菌进行活化后调整菌液浓度为106CFU/mL备用。指示菌的菌液浓度也调整为106CFU/mL,吸取200 μL涂布于牛肉膏蛋白胨平板上。牛津杯灭菌后,用洁净的镊子轻压于指示菌的平板上,使杯底紧贴于培养基上。每个培养基的牛津杯中加入200 μL酵母菌菌液,置于28 ℃恒温箱培养24 h,测抑菌圈大小[13-14]。
2.1.6 菌体自动聚集能力及表面疏水性试验
益生菌表面疏水性和自动聚集能力的强弱与其粘附性的强弱有密切关系,对益生菌在人体胃肠道内的生长存活有重要的影响,一般表面疏水性越强与自动聚集能力越高的细菌黏附力越强[15]。
(1)自动聚集能力测定
将YEPD培养基中过夜培养的酵母菌悬液以6 000 r/min离心10 min,并用0.2 mol/L的PB 缓冲溶液(pH 7.2)洗涤2次。将沉淀重悬于相同的缓冲液(2 mL)中,振荡30 s,并在37 ℃下培养2 h。从上层取出悬浮菌液并等分试样(1 mL),在OD560nm对吸光度测定[16-17],使用公式(3):

(3)
其中:OD0和ODt分别为培养前后的吸光度。Au%<30%被认为是低的,在30%和60%之间为中,高于60%为高,一式三份进行测定。
(2)疏水性测定
当非极性溶液在极性水中会表现出不稳定的状态,并引起分子的重新排列分布及一系列热能(熵)的变化[15],是疏水性的定义。通常将细胞与十六烷结合的能力作为间接评估酵母的疏水能力,测定方法由GONG等人提出[17]。方法如下:
①将10 mL酵母菌细胞培养物在4 000 r/min下离心10 min;
②弃去上清液,将沉淀物悬浮在酸化至pH 2.0的25 mL PBS(0.8 g/L , K2HPO4;0.68 g/L KH2PO48.77 g NaCl)中;
③每个酵母菌制备2个不同的样品:对照(9.5 mL细胞悬浮液+ 0.5mL蒸馏水)和活菌样品(9.5 mL细胞悬浮液+ 0.5 mL十六烷);
④样品振荡10 s后静置10 min;
⑤通过在30,60,90和120 min后在OD600nm处的吸光值来评估十六烷捕获细胞的能力。将水相吸光度的降低作为细胞表面疏水性(H%)的度量,按公式(4)计算:
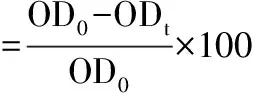
(4)
其中OD0和ODt分别为用正十六烷萃取前后的吸光度,该测定一式三份进行[16,18]。
2.2 菌株生理生化试验及26S rDNA基因序列分析
(1)对筛选出的酵母菌进行糖发酵试验和碳源、氮源同化试验[19-20];
(2)DNA提取按文献[19]、[20]操作;
(3)PCR扩增。
反应体系:采用50 μL反应体系:基因组DNA模版2 μL,ITS1 2 μL,ITS4 2 μL,2xTapPCR MasterMix25 μL,使用引物ITS1(5′-TCCGTAGGTAACCTGCGG-3′) ITS1(5′-TCCTCCGCTTATTGATATGC-3′)对应区域内的酵母菌DNA模版进行扩增,做好空白对照。
PCR反应循环条件:95 ℃预变性5 min,95 ℃变性1 min,52 ℃退火2 min,72 ℃延伸1 min,循环35次,72 ℃延伸10 min。
(4)测序
将扩增产物通过琼脂糖凝胶电泳后,送往上海生工生物工程技术服务有限公司进行测序。
2.3 数据统计及分析
对实验结果进行3次重复测定,最终结果用均值+标准差的方式表现。先使用Origin 8.0软件对数据进行处理,得到的结果比较采用SPSS(Vesion 19)中的ANOVA进行显著性分析,采用邓肯(Ducan)多重范围检验法。
3 结果与分析
3.1 酵母菌在不同pH值下生长状况
酵母菌在人体内的存活与pH值有密切关系,而在益生菌的筛选中通常也把菌株是否耐酸作为一个重要标准。表1中对18株菌在不同pH值下的生长状况进行了显著性差异分析,p<0.05说明各菌株有显著性差异。

表1 各菌株在不同pH值下OD600nm处的吸光值Table 1 Absorbance of each strain at OD600nm at different pH value
续表1
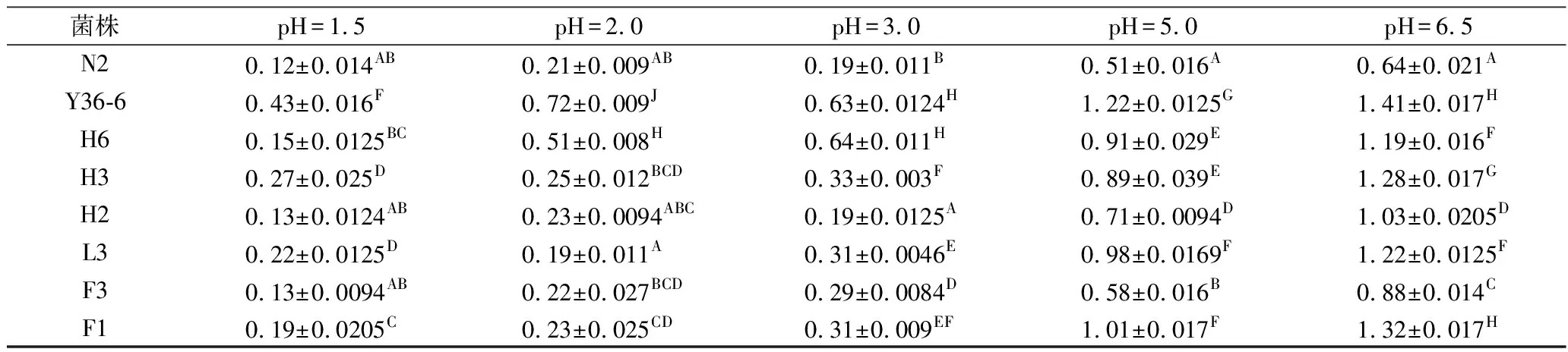
菌株pH=1.5pH=2.0pH=3.0pH=5.0pH=6.5N20.12±0.014AB0.21±0.009AB0.19±0.011B0.51±0.016A0.64±0.021AY36-60.43±0.016F0.72±0.009J0.63±0.0124H1.22±0.0125G1.41±0.017HH60.15±0.0125BC0.51±0.008H0.64±0.011H0.91±0.029E1.19±0.016FH30.27±0.025D0.25±0.012BCD0.33±0.003F0.89±0.039E1.28±0.017GH20.13±0.0124AB0.23±0.0094ABC0.19±0.0125A0.71±0.0094D1.03±0.0205DL30.22±0.0125D0.19±0.011A0.31±0.0046E0.98±0.0169F1.22±0.0125FF30.13±0.0094AB0.22±0.027BCD0.29±0.0084D0.58±0.016B0.88±0.014CF10.19±0.0205C0.23±0.025CD0.31±0.009EF1.01±0.017F1.32±0.017H
注:同列数据中右上标字母相同者,表示差异不显著(p>0.05)。
由图1可以看出,在不同pH值下18株酵母菌的生长状况,用OD600nm下不同菌株的吸光值反应其菌落数量的变化。菌株L1、Y2、N9、N2、H2、F3在5种不同pH值下的吸光值都比较低,且不同梯度间下降幅度较大,说明其在较低pH值下菌落数较少生长受抑制。而菌株Y1、L4、H1、Y36-6在不同pH值下均能够正常生长有较高的生长活性,在pH=1.5的高酸条件下吸光值均大于0.4,酵母菌细胞数有一定的存活率,说明这4株菌具有较好的耐酸特性。其他菌株N1、L5、N6、N香、H6在pH值为1.5时吸光度有所下降,受到一定程度的抑制,但在pH值为2.0、3.0、5.0、6.5时均有一定的生长活性,说明这些菌株在低pH值条件下有一定耐酸性。
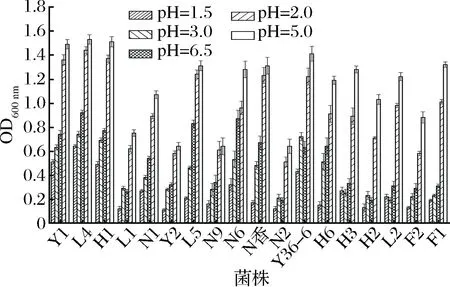
图1 酵母菌在不同pH值下生长状况Fig.1 Yeast growth conditions under acidic conditions
3.2 酵母菌在胆盐固体培养基上的生长状况
由图2酵母菌在不同胆盐质量浓度的生长状况可知,N9、N6、N香、H3在3种胆盐质量浓度下活菌增长率为0,受严重抑制,无法生长。菌株N1、L5、H6、L1、L3、F1的活菌增长率在3种胆盐质量浓度下均小于22%,其中L5、H6、L3、F1在3 g/L胆盐质量浓度下,菌株增长率分别为11.82%、13.01%、13.86%、21.32%,达到最大,在5 g/L质量浓度下增长率分别为3.94%、6.94 %、2.31%、17.89%,均有不同程度的下降,可以看出4株菌在1、3 g/L胆盐质量浓度下有较好的生长具有一定的耐受性,在5 g/L质量浓度增长率降低生长活性受到一定的抑制。菌株L1、N1在1 g/L胆盐质量浓度下菌株增长率分别为15.68%、6.07%,而在5 g/L胆盐下增长率分别为13.51%、3.82%,增长率略微下降,说明L1、N1在5 g/L胆盐下具有一定的生长力、耐受性。菌株Y1、L4、H1、Y36-6在不同胆盐质量浓度下活菌增长率都在30%以上,14株菌中在3 g/L胆盐质量浓度下Y36-6活菌增长率最高56.66%,5 g/L胆盐质量浓度下Y1增长率最高49.08%,4株菌在高胆盐质量浓度下不受抑制均有较强的生长力和耐胆盐性,适合进行下一步的其他潜在益生特性研究。
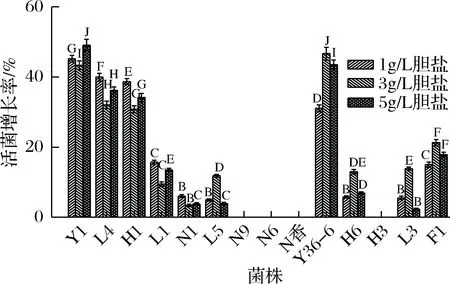
图2 酵母菌在胆盐固体培养基上的生长状况Fig.2 Yeast growth on bile salt solid medium注:图中同一胆盐质量浓度下不同字母表示差异性显著(p<0.05)。
3.3 模拟胃液中酵母菌生长状况
益生菌在人体胃肠道内存活时,对胃肠液的耐受能力是可变,而且具有菌株特异性。根据图3中酵母菌的生长状况显示,10株菌在模拟胃液中培养0.5 h后,F1、L5、L1这3株菌的活菌下降率较高在15%以上,其余菌株下降率都较低在10%以下,但在培养3 h后,除了Y1、L4、H1、Y36-6这4株酵母菌数量略微降低,其余6株菌的活菌数迅速下降,下降率达到30%~55%。综上可知长时间处在模拟胃液的条件下只有Y1、L4、H1、Y36-6有较好的耐胆盐性,具有一定的存活性。
3.4 模拟人体温酵母菌生长试验
将筛出的10株酵母L5、F1、L4、Y1、H1、L3、H3、L1、Y36-6、N1置于37 ℃的恒温培养箱中培养24 h,观察生长情况。由图4酵母菌在37 ℃和室温下的生长状况可看出,在培养24 h后菌株H3的菌落数量最少,生长较缓慢,其余9株菌的菌落数均没有较大的下降。可以看出在24、37 ℃情况下,这10株酵母菌均可以正常生长,说明37 ℃下并不会对菌株生长活性造成较大影响。
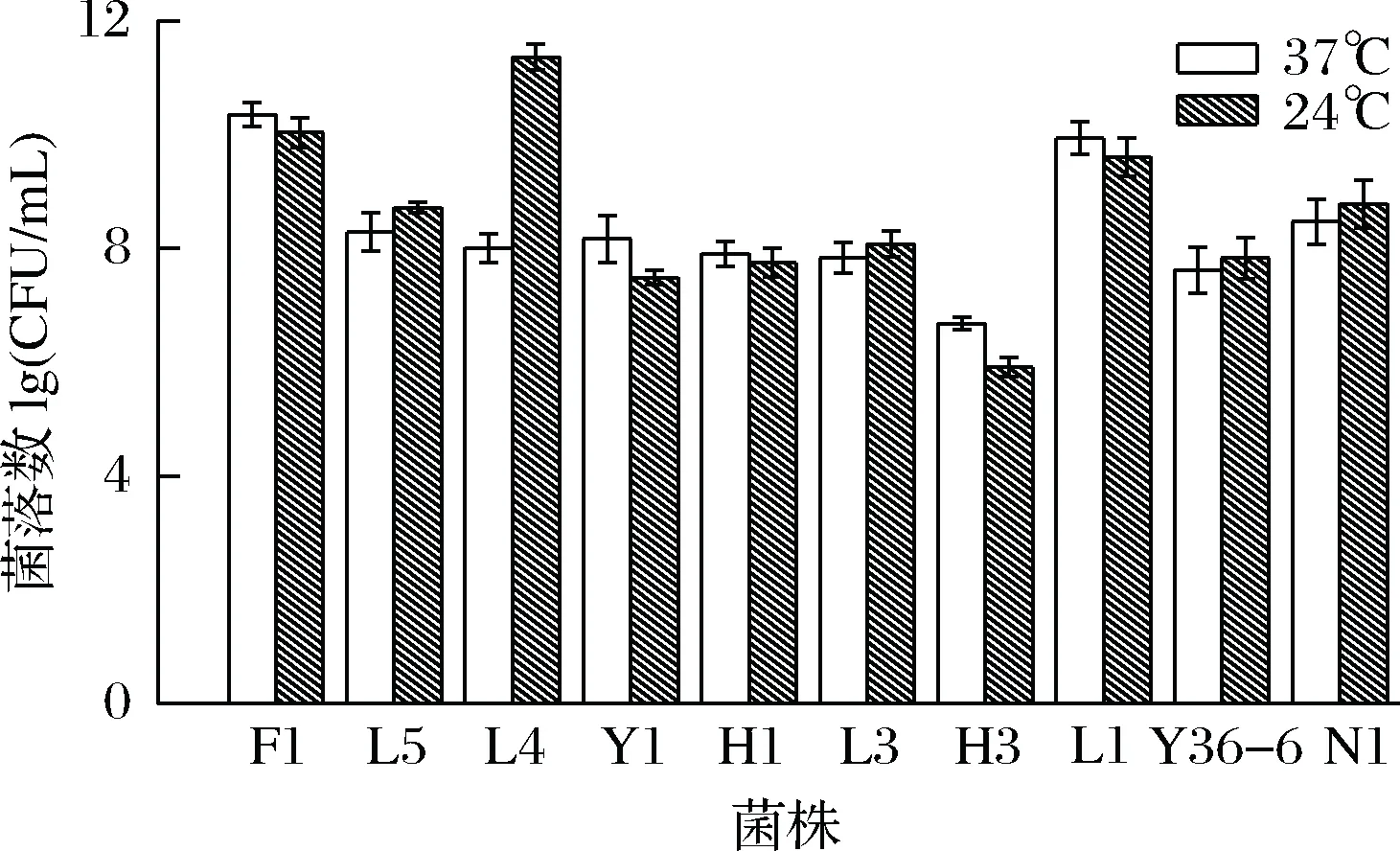
图4 酵母菌在模拟人体温下生长状况Fig.4 Yeast in simulating the growth of human body temperature
3.5 益生酵母菌抑菌结果
通过表2抑菌试验结果,得出L5在金黄色葡萄球菌上有抑菌圈,在大肠杆菌上没有抑菌圈,不具有抑制大肠杆菌特性,F1、H3、L1在大肠杆菌和金黄色葡萄球菌上都没有抑菌圈,不具备抑制有害菌能力。H1、Y1、Y36-6、L4在金黄色葡萄球菌和大肠杆菌上都有抑菌圈。

表2 抑菌试验结果Table 2 Yeast inhibition zone size
3.6 表面疏水性测定结果
图5显示了所研究菌株获得的疏水性值,范围为39.75%~82%,最高值对应于马克斯克鲁维酵母H1(82.21%),而Y1酿酒酵母也有较高疏水性值71.59%。毕赤酵母属菌株L4和Y36-6的疏水性值分别为39.75%、42.94%,具有中等能力的疏水性,由于它们种属固有的凝集条件不同而显示出不同能力的疏水性值。
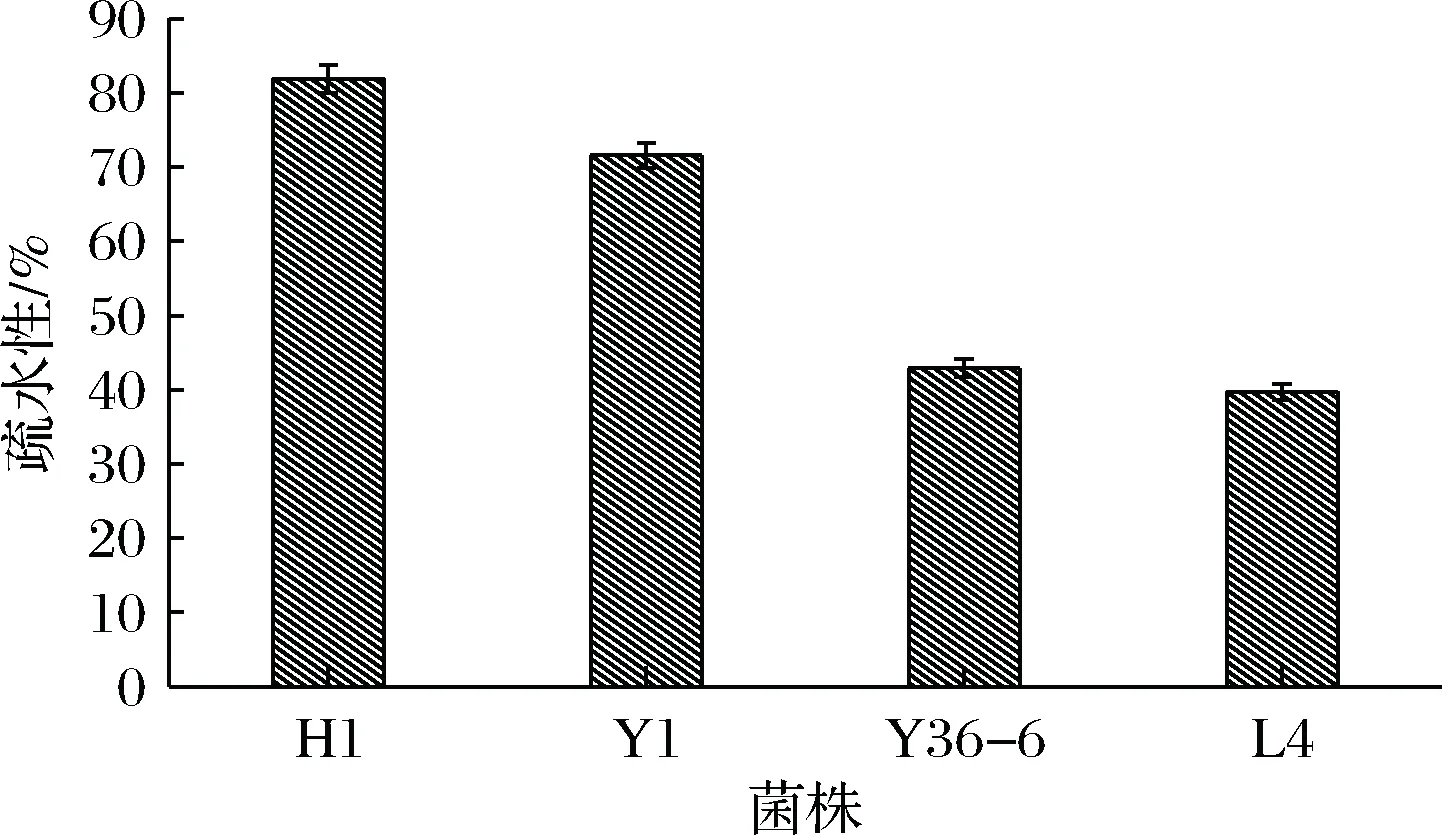
图5 表面疏水性Fig.5 Surface hydrophobicity
3.7 菌体自动聚合能力测定结果
菌株H1、 Y1、 Y36-6、 L4的自动聚集能力如图6所示。其中L4的自动聚合能力较高为59.99%,Y36-6较低为49.46%,4株菌都显示出了中等程度的自动聚集能力。
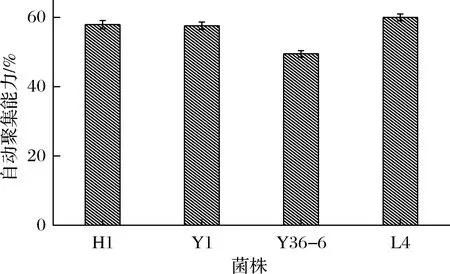
图6 菌体自动聚合能力Fig.6 Cell autolytic capacity
3.8 菌株生理生化及26S rDNA测序分析结果
由表3的生理生化试验及图7的发育树结果分析,H1菌株属于Kluyveromyces马克斯克鲁维酵母菌属,与其相似度为99%,Y1菌株属于saccharomycete酿酒酵母属,与其相似度达到99%,Y36-6和L4都属于Pichiakudriavzevii毕赤酵母属,与其相似度达到99%。
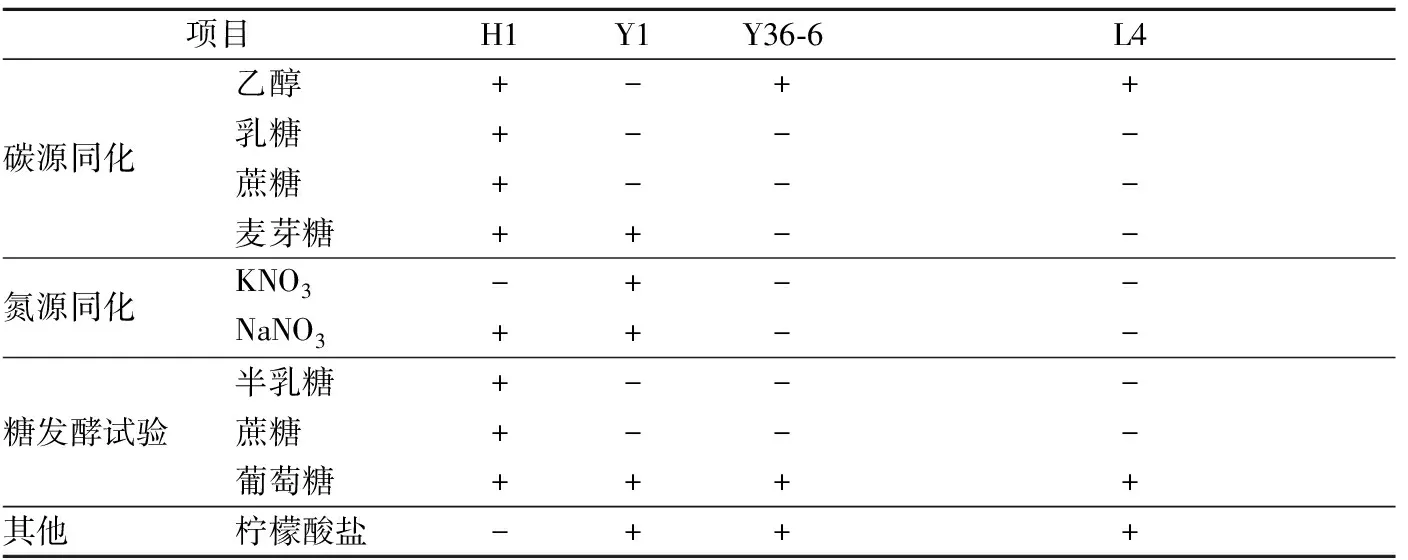
表3 生理生化试验结果Table 3 Physiological and biochemical test results
注:“+”表示阳性,“-”表示阴性。

图7 酵母菌发育树Fig.7 Yeast developmental tree
4 结论
通过益生菌筛选试验发现,在pH分别为1.5、2.0、3.0的条件下进行培养时,pH值越低,酵母菌生长活性受到的抑制越强,在pH为1.5时酵母菌生长活性最低,其中H2、F3、N2、Y2四种菌在3种酸度下均受到的较强的抑制,几乎无法生长。在耐胆盐试验中,N6、H3、N9、N香4种菌无法正常生长,受到的抑制性较大。在模拟胃液和37℃的条件下,筛选出9株能够在人体胃肠道存活的酵母菌,并对这9株菌进行了抑菌试验。其中,L5、L3只在金黄色葡萄球菌的培养基上有抑菌圈,F1、L1、H3在两种指示菌的平板上均没有抑菌圈,只有H1、Y1、Y36-6、L4四株菌可以在两种指示菌上看到明显的抑菌圈。经过以上的益生特性筛选试验后得到H1、Y1、Y36-6、L4这4株菌为潜在益生酵母菌,并对4株菌的疏水性及自动聚集能力进行测试后发现,菌株H1、Y1具有高度疏水性,Y36-6、L4具有中度疏水性,且4株菌都具备中等自动聚集能力,说明它们都具有良好的黏附性在胃肠道内能有较好的存活能力。对4株酵母菌DNA测序,将测序结果比对分析后得出,菌株H1属于马克斯克鲁维酵母菌属,菌株Y1属于酿酒酵母属,与其相似度达到99%,Y36-6和L4都属于毕赤酵母属,与其相似度达到99%。后期将对筛选出的4株具有潜在益生功能的酵母菌,进行益生功能性乳产品的研制,对其在实际应用中的抗氧化性和益生活性等方面进行研究。

