p38MAPK信号通路的抑制减轻缺氧复氧环境下心肌细胞凋亡
李越凡,徐丹,李婷,朱为勇
据统计,每年全球范围内超过720万人死于冠状动脉粥样硬化性心脏病(冠心病),其严重危害着人类的生命健康。心肌梗死后最为有效方法是恢复心肌血液流通,冠状动脉旁路移植术、溶栓等是目前常用的恢复心肌缺血再灌注的有效方法[1]。当心肌缺血再灌注后常会出现心肌组织损伤加重、心力衰竭等现象,严重者会导致死亡,这称为心肌缺血再灌注损伤。氧化应激、心肌细胞大量凋亡等是其发生的主要原因[2-5]。丝裂原活化蛋白激酶(MAPK)信号通路参与细胞生长过程,是细胞信号转导的重要调节通路之一,p38MAPK是MAPK的成员之一,在细胞增殖、分化、凋亡、死亡、迁移等多种生物学特性中有广泛的调控作用[6-9]。有研究表明,p38MAPK在心肌梗死组织中过度激活,其磷酸化水平升高,致细胞炎症因子聚集,使心肌细胞凋亡增加[10,11]。之前的研究表明,15 μmol/L的p38MAPK特异性抑制剂SB203580(SB)能够特异性的抑制p38MAPK磷酸化[12,13]。本研究通过体外构建心肌细胞缺氧复氧模型,探讨p38MAPK信号通路抑制剂对缺氧复氧心肌细胞凋亡的影响,以期为靶向抑制p38MAPK信号通路治疗心肌缺血再灌注损伤提供理论依据。
1 材料与方法
1.1 材料心肌细胞H9C2购自中科院上海细胞库。活性氧(ROS)含量检测试剂盒(DCFH-DA法)购自于碧云天生物技术研究所;超氧化物歧化酶(SOD)含量检测试剂盒(黄嘌呤氧化法)购自于为上海纪宁生物科技有限公司;乳酸脱氢酶(LDH)含量试剂盒(二硝基苯肼显色法)购自于南京建成生物工程研究所;丙二醛(MDA)含量检测试剂盒(硫代巴比妥酸比色法)购自于南京森贝伽生物科技有限公司;p38MAPK多克隆抗体、p-p38MAPK多克隆抗体、β肌动蛋白(β-actin)多克隆抗体、Cleaved Caspase-3多克隆抗体均购自于美国Abcam;p38MAPK特异性抑制剂SB203580、胰蛋白酶均购自美国Sigma;胎牛血清购自于美国Gibco。
1.2 心肌细胞培养将保存在液氮中的H9C2细胞取出,放置于37℃水浴中,观察细胞融化后,用细胞培养液(含10%胎牛血清的DMEM)悬浮细胞,1000 r/min离心10 min,弃上清液,用5 ml的细胞培养液重悬细胞后,种植于细胞培养瓶中,在37℃,饱和湿度,5%CO2培养箱中培养,待细胞融合度超过85%时,将细胞培养液倒掉,用0.25%的胰蛋白酶在37℃消化细胞2 min,1000 r/min离心10 min,弃上清液,用5 ml的细胞培养液悬浮细胞,按照1:3的比例种植到细胞培养瓶中继续培养。
1.3 缺氧复氧模型构建缺氧复氧模型构建:H9C2细胞在37℃,饱和湿度,5%CO2培养箱中培养,观察细胞密度超过80%时,将细胞培养液更换为不含有胎牛血清的培养液,放在1%O2,94% N2,5%CO2缺氧培养箱中孵育12 h。弃培养液,加入含有10%胎牛血清的细胞培养液,在37℃,20%O2,5%CO2培养箱中培养4 h。H9C2细胞分为Con组、H/R组、SB203580组。其中Con组细胞正常培养,不进行缺氧复氧处理;H/R组、SB203580组进行缺氧复氧处理,SB203580组细胞在缺氧复氧前用15μmol/L的p38MAPK特异性抑制剂SB203580预处理24 h。
1.4 MTT检测细胞增殖H9C2细胞培养至对数期后,调整细胞浓度为每毫升含有105个细胞,接种到96孔板中,每孔中加入100 μl的细胞悬浮液,培养过夜。按照Con组、H/R组、SB203580组分组,每组设置5个复孔,以不加细胞的孔为空白组,用于调零。按照3.3中方法处理各组细胞,待细胞复氧后,在每孔中加入20 μl的5 mg/ml的MTT溶液,在37℃孵育4 h,吸取培养液,加入二甲基亚砜溶液150 μl,反应10 min,用酶标仪检测每孔的OD值,分析计算细胞存活率。细胞存活率=100%×(实验组OD值-空白组OD值)÷(Con组OD值-空白组OD值)
1.5 流式细胞术检测细胞凋亡Con组、H/R组、SB203580组细胞按照3.3中方法处理后,待细胞复氧后,用0.25%的胰蛋白酶消化细胞,用PBS调整细胞浓度为每毫升含有6×105个细胞,收集1 ml细胞悬浮液,1000 r/min离心10 min,弃上清液,在细胞沉淀中加200μL结合缓冲液重悬,依次加入5 μl膜联蛋白 V-FITC(Annexin V-FITC)和5 μl碘化丙啶(Propidium Iodide,PI),放置于室温避光条件下孵育15 min ,用流式细胞仪检测细胞凋亡情况。
1.6 LDH、SDH、SOD、ROS含量检测Con组、H/R组、SB203580组细胞按照3.3中方法处理后,待细胞复氧后,收集各组细胞培养液上清液及细胞,用二硝基苯肼显色法检测上清液中LDH含量,用硫代巴比妥酸比色法检测心肌细胞中MDA含量,用黄嘌呤氧化法检测细胞中SOD含量,DCFH-DA法检测细胞中ROS含量。检测步骤分别参照LDH、MDA、SOD、ROS含量检测试剂盒。
1.7 Western blot检测p38MAPK、p-p38MAPK、Cleaved Caspase-3表达Con组、H/R组、SB203580组细胞按照3.3中方法处理后,待细胞复氧后,将细胞培养液吸除后,加入裂解液充分裂解,转移至离心管中,14000 r/min,4℃离心10 min。将蛋白上清液吸取至新的EP管中,用BCA蛋白定量检测试剂盒检测蛋白浓度。将蛋白样品与等体积的2×Loading buffer在100℃煮沸5 min后进行电泳。聚丙烯酰胺凝胶电泳:每孔加入50 μg变性蛋白,浓缩胶中电压为80 V,分离胶中电压为120 V。转膜:90 V电压,4℃转膜70 min。封闭:5%牛血清白蛋白室温封闭60 min。一抗孵育:1:800倍稀释,4℃反应过夜。二抗孵育:1:1000倍稀释,室温孵育60 min。显色,凝胶成像分析仪采集图像,分析蛋白表达水平。蛋白表达水平=目的蛋白灰度值/β-actin灰度值
1.8 统计学处理所有实验重复3次,取平均值。所得的实验数据均采用SPSS 22.0统计学软件分析,数据以均数±标准差(±s)表示,多组间数据比较采用单因素方差进行分析,两组数据比较用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 SB203580在缺氧条件下恢复细胞增殖Con组、H/R组、SB203580组细胞存活率依次为:(100.43±8.57)%、(52.49±6.62)%、(75.17±6.37)%。H/R组、SB203580组细胞存活率均明显低于Con组,差异具有统计学意义(tH/R=7.668,PH/R<0.01,tSB=4.097,PSB<0.05)。SB203580组细胞存活率明显高于H/R组,差异具有统计学意义(t=4.276,P<0.05)(图1)。
2.2 SB203580在缺氧条件下减少细胞凋亡Con组、H/R组、SB203580组细胞凋亡率依次为:(4.41±0.91)%、(33.12±3.47)%、(12.24±2.40)%。H/R组、SB203580组细胞凋亡率均明显高于Con组,差异具有统计学意义(tH/R=13.862,PH/R<0.01,tSB=5.284,PSB<0.01)。SB203580组细胞凋亡率明显低于H/R组,差异具有统计学意义(t=8.572,P<0.01)(图2)。
2.3 SB203580在缺氧条件下恢复MDA水平Con组、H/R组、SB203580组MDA含量依次为:(0.39±0.67)mmol/L、(2.12±0.14)mmol/L、(1.25±0.07)mmol/L。H/R组、SB203580组MDA含量明显高于Con组,差异具有统计学意义(tH/R=20.580,PH/R<0.01,tSB=18.476,PSB<0.01)。SB203580组MDA含量明显低于H/R组,差异具有统计学意义(t=9.406,P<0.01)(图3)。
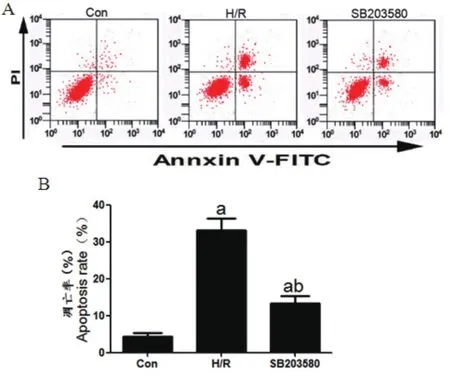
图2 细胞凋亡检测结果
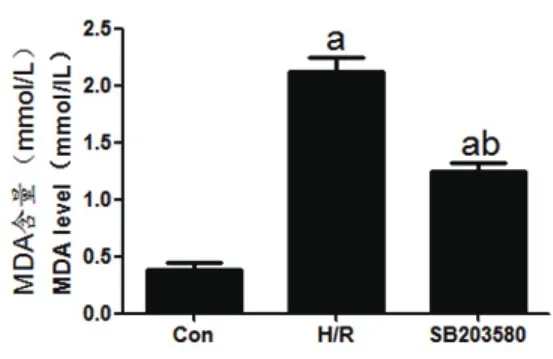
图3 细胞中MDA含量
2.4 SB203580在缺氧条件下降低细胞ROS水平,恢复SOD水平荧光强度越高表示ROS水平越高。Con组、H/R组、SB203580组荧光强度(ROS水平)依次为:78.19±7.17、277.72±24.25、180.78±17.68,SOD含量依次为:(165.36±9.89)U/mL、(89.44±8.79)U/mL、(130.23±8.97)U/mL。H/R、SB203580组ROS含量均明显高于Con组,SOD含量均明显低于Con组,差异均有统计学意义(tH/R-ROS=13.667,PH/R-ROS<0.01,tSB-ROS=9.314,PSB-ROS<0.01,tH/R-SOD=10.961,PH/R-SOD<0.01,tSB-SOD=4.557,PSB-SOD<0.05)。SB203580组ROS含量明显低于H/R组,而SOD含量明显高于H/R组,差异均具有统计学意义(tROS=5.595,PROS≤0.01,tSOD=6.280,PSOD<0.05)(图4)。
2.5 SB203580在缺氧条件下减少LDH外漏Con组、H/R组、SB203580组LDH含量依次为:(25.39±4.76)U/L、(95.21±6.14)U/L、(58.44±5.56)U/L。H/R组、SB203580组LDH含量均明显高于Con组,差异有统计学意义(tH/R=15.566,PH/R<0.01,tSB=7.821,PSB<0.01)。SB203580组LDH含量明显低于H/R组,差异具有统计学意义(t=7.689,P<0.01)(图5)。
2.6 SB203580在缺氧条件下降低p-p38MAPK、Cleaved Caspase-3水平Con、H/R、SB203580组p38MAPK水平依次为:0.83±0.08、0.82±0.04、0.84±0.06,p-p38MAPK水平依次为:0.12±0.04、0.28±0.02、0.19±0.01,Cleaved Caspase-3水平依次为:0.15±0.03、0.76±0.06、0.35±0.04。H/R、SB203580组p-p38MAPK、Cleaved Caspase-3水平均明显高于Con组,差异具有统计学意义(tH/R-p-p38MAPK=6.197,PH/R-p-p38MAPK<0.01,tSB-p-p38MAPK=2.941,PSB-p-p38MAPK<0.05,tH/R-Cleaved Caspase-3=15.750,PH/R-Cleaved Caspase-3<0.01,tSB-CleavedCaspase-3=6.928,PSB-CleavedCaspase-3<0.01)。SB203580组p-p38MAPK、Cleaved Caspase-3水平明显低于H/R组,差异具有统计学意义(tp-p38MAPK=6.971,Pp-p38MAPK<0.01,tCleavedCaspase-3=9.848,PCleavedCaspase-3<0.01)(图6)。
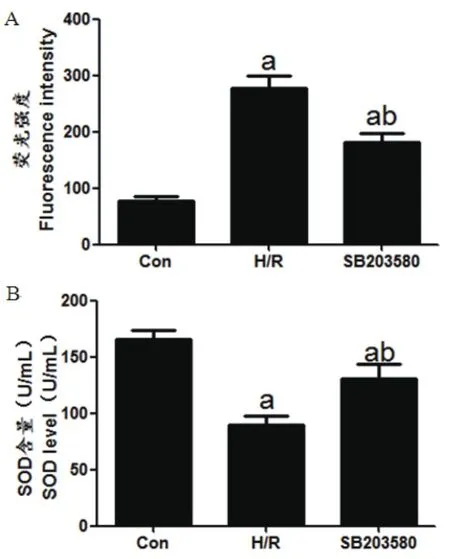
图4 细胞中ROS和SOD含量
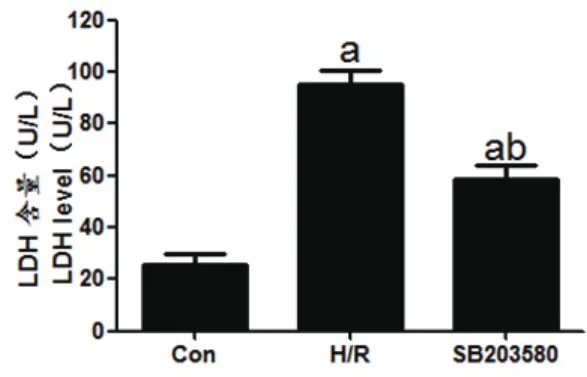
图5 培养液上清中LDH含量
3 讨论
心肌缺血再灌注损伤的发生与氧化应激、钙离子超载、炎症反应、心肌细胞凋亡等有关[14]。研究表明,心肌缺血后,恢复冠状动脉血液流通时,动脉血会将氧转运至缺血区,心肌细胞产生大量的ROS,引起氧化应激,加重心肌损伤,造成心肌细胞凋亡[15,16]。p38MAPK信号通路能够调控心肌细胞、血管内皮细胞、软骨细胞等多种细胞的生长和信号传递过程,参与心肌缺血再灌注、心室重构、动脉粥样硬化等多种心血管系统疾病的发生[17-19]。研究表明,p38MAPK在心肌梗死组织中磷酸化水平升高,p38MAPK信号通路抑制剂可以改善心肌缺血再灌注损伤[20,21]。p38MAPK信号通路磷酸化后生成p-p38MAPK发挥促进细胞凋亡的作用[22]。
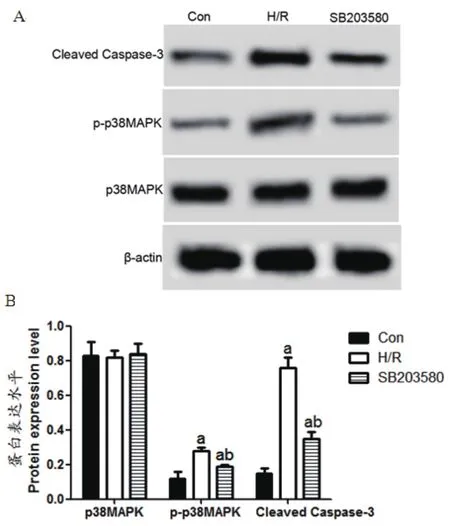
图6 细胞中p38MAPK、p-p38MAPK、Cleaved Caspase-3蛋白表达
心肌缺血再灌注损伤发生时会伴随大量的心肌细胞凋亡。细胞凋亡的发生与多种细胞因子的调控有关,Caspase蛋白家族是目前公认的与细胞凋亡有关的凋亡相关蛋白,其激活后能够促进细胞凋亡的发生[23,24]。Caspase-3是Caspase蛋白家族的成员之一,正常情况下以酶原的形式存在,当其活化后形成Cleaved Caspase-3后标志着细胞凋亡进入不可逆阶段[25-28]。本研究结果显示,缺氧复氧后的心肌细胞凋亡率大大增加,细胞存活率明显降低,细胞中Cleaved Caspase-3蛋白水平升高,而p38MAPK信号通路抑制剂作用后的心肌细胞凋亡率下降,细胞存活率升高,细胞中Cleaved Caspase-3蛋白水平降低。提示p38MAPK信号通路抑制剂能够部分逆转缺氧复氧诱导的心肌细胞凋亡。
正常情况下,细胞中氧化和抗氧化水平处于动态平衡状态,当细胞中氧自由基不能及时清除而造成氧自由基异常聚集,最终会引起氧化应激[29-32]。低浓度的ROS能够维持细胞中正常的信号转导,而ROS异常增多会导致细胞产生氧化应激,引起细胞凋亡发生[33-35]。SOD属于抗氧化系统的蛋白酶,能够特异性的清除机体内氧自由基,是氧自由基的天然清除剂[36,37]。当细胞发生氧化应激后,细胞内的脂质发生过氧化,破坏细胞膜通透性,使细胞浆内的LDH外漏,而MDA是脂质过氧化的产物[38-40]。本研究结果显示,缺氧复氧后心肌细胞中ROS、MDA水平升高,而细胞中SOD水平下降,培养液上清液中LDH含量升高,而p38MAPK信号通路抑制剂处理后能够部分逆转这一现象。这提示,p38MAPK信号通路抑制剂可以减轻缺氧复氧诱导的心肌细胞氧化损伤。
综上所述,p38MAPK信号通路抑制剂能够改善缺氧复氧诱导的心肌细胞凋亡和氧化损伤,为后续进一步探讨p38MAPK信号通路在心肌缺血再灌注损伤中的作用奠定了基础,为靶向p38MAPK信号通路治疗心肌缺血再灌注损伤提供了理论依据。本研究存在一定的局限性,只探讨了p38MAPK信号通路对缺氧复氧心肌细胞凋亡及氧化损伤的作用,后续试验中会进一步探讨其对心肌缺血再灌注炎症因子、钙超载等的影响。

