麦饭石水培养荞麦芽的发芽工艺及麦芽的抗氧化活性
张乐宏,付建瑞,李岩,李静媛,肖秧,单凌越,徐志刚
(1.青岛农业大学食品科学与工程学院,山东青岛 266109)(2.潍坊海润华辰检测技术有限公司,山东潍坊 261061)
麦饭石,表面粗糙不平,由大小不等、颜色不同的颗粒聚集而成,有斑点状花纹,色泽有灰白、淡褐肉红、黄白、黑等若干种,因其外貌与麦饭团貌似而得名[1]。牛佳[2]等的研究显示,麦饭石中含有Na、K、Ca、Cu、Mg、Mo等动物所需的常量元素,Pr、La、Ce、Sm、Nd、Gd、Eu等稀土元素,Ga、P、Se、Ba、Sr、Ge、Li、Zn、V、Cr、Nb、Ni、Ta、F、Co、Zr、Sn、Y和Mn等微量元素。
研究发现,麦饭石富含植物生长必须的多种常量、微量元素,如果用来浸种或喷施子叶,可加快种子萌发进度、根系生长速度、乃至生长周期,尤其可增加大豆、紫云英、花生、小稻和冬小麦等的产量[3]。用麦饭石水浸种白菜种子,可使其的发芽率增加[4]。利用麦饭石水生产的饮料,除了有益元素多,有害元素少等特点,在口感、味道等方面也更佳。因此,借助麦饭石自身丰富的元素优势,将其浸提液用于培养芽菜,促进芽菜生长,以期培育出营养元素丰富多样,口感更佳,营养均衡、安全、健康的芽菜具有一定意义和可行性。
荞麦芽是利用荞麦种子培育出的一种可食用“芽菜”,其不仅可作为蔬菜为人体提供维生素、矿物质等基本的营养元素,亦能提供游离糖、氨基酸、有机酸、黄酮等多种功能性成分[5~7]。WieslawWiczkowski[6]的研究表明,与下胚轴相比,在子叶中检测到了更高的黄酮含量,花青素的含量却并非如此,在下胚轴中花青素含量更高;普通荞麦芽的子叶富含木犀草素和芹黄素碳糖苷成分,这些物质的总含量大约超出了芦丁浓度的5倍。蒋亚莉[7]等的研究表明,荞麦芽中主要存在VB1、VB6和Vc,并随着生长的进行含量增加,并在第7 d达到最大。RajendraKarki[8]等的研究发现,荞麦芽能够通过抑制自由基和炎症介质达到预防炎症的效果。成少宁[9,10]等的研究表明,荞麦芽更具抗氧化活性。
本文对麦饭石水、矿泉水中的元素含量进行了分析,继而从浸种时间、培养温度和培养时间三个方面研究了这两种水对荞麦芽发芽情况的影响,从而确定了荞麦芽最佳发芽工艺。最后,对最佳发芽工艺条件下培育的荞麦芽进行了感官、物性、微量元素和抗氧化活性等方面的测试。本文将麦饭石的元素优势、荞麦芽培育及荞麦芽抗氧化活性研究结合在一起,旨在为荞麦芽的高效培育工艺的确立提供实验基础,并为麦饭石、麦饭石荞麦芽后期在优质芽菜、蔬菜饮品等食品领域的应用提供借鉴。
1 材料与方法
1.1 材料与试剂
麦饭石由青岛农业大学中韩食品生物技术研究中心提供;矿泉水购于崂山甜源连锁水站;甜荞麦、育苗盘、育苗纸等购于当地超市;Vc购于上海瑞永生物科技公司;邻二氮菲、硫酸亚铁、无水乙醇、邻苯三酚、双氧水、盐酸、无水磷酸二氢钠、无水磷酸氢二钠,均为分析纯,购于莱阳市康德化工有限公司。
1.2 仪器与设备
UV-2000紫外可见分光光度计,上海尤尼科仪器有限公司;TA-XT. Plus型物性测定仪,英国 Stable Micro Systems公司;恒温培养箱,重庆市太仓科技有限公司;生化培养箱,上海新苗医疗器械制造有限公司;物性测定仪,深圳市嘉盛科技有限公司;OHAUS STARTER 3100 pH计,奥豪斯仪器上海有限公司;HH-2数显恒温水浴锅,龙口市先科有限公司;TGL-16M高速台式冷冻离心机,湖南湘仪离心机仪器有限公司;Agilent ICP-MS 7700,安捷伦科技有限公司。
1.3 方法
1.3.1 麦饭石水的制备
研究表明,不同粒度、石水质量比、溶出时间及温度对麦饭石水中微量元素的溶出含量有巨大的影响[11]。本实验参考了郭兴忠等[11]的实验结果,用直尺量取直径 1~3 cm 的麦饭石,用矿泉水洗净烘干,于100 ℃条件下,按石水质量比1∶5,煮沸30 min,取水冷却备用。配置的麦饭石水一部分用于检测其微量元素含量,一部分用于培育荞麦芽。用于培育荞麦芽的麦饭石水配置后冷藏保存,使用前需待其恢复至室温,并且麦饭石水需在48 h内用完。
1.3.2 麦饭石水、矿泉水中元素的测定
参照付翠轻[12]等的研究,对矿泉水及方法 1.3.1所制备的麦饭石水中的元素含量进行测定。
1.3.3 荞麦芽最佳培养工艺的确定
以发芽率、腐烂率、总重量、发芽势为指标,确定培育荞麦芽的最佳浸种时间,培养温度,培养时间。1.3.3.1 荞麦芽培养工艺
用酒精将育苗盘和培养箱消毒并干燥用以备用,并在使用前用紫外线消毒15 min。选取充实饱满、颜色鲜亮、无虫蛀的荞麦种子,放置于洁净干燥的育苗盘中并放于日光下晾晒,并及时装于封口塑料袋中,防止回潮。将晒后的种子均分为实验组和对照组,实验组用麦饭石水培养,对照组用矿泉水培养。而后分别用麦饭石水和矿泉水在室温(22 ℃~25 ℃)下避光浸种。浸种后在恒温下避光培育。培育前3 d为催芽阶段,种子应用培养液润湿的育苗纸盖住,且早晚喷水20 mL,实验组喷施麦饭石水,对照组喷施矿泉水。3 d后可将盖在种子上方的育苗纸去除,并在育苗盘底盘注入100 mL水,实验组注入麦饭石水,对照组注入矿泉水,培养液需每天更换。培养过程中需对芽叶、芽茎喷水,每天喷两次每次20 mL,实验组喷施麦饭石水,对照组喷施矿泉水。每天记录生长状态。培养至一定天数后,测量两组荞麦芽的总重、发芽率、腐烂率、10 cm以上芽长重量、5 cm到10 cm芽长重量、5 cm以下芽长重量。
1.3.3.2 浸种时间对荞麦芽生长的影响
按1.3.3.1中的培养工艺培育荞麦芽,将浸种时间分别设定成8 h、12 h、16 h、20 h,培养温度为22 ℃,培养时间为7 d,每盘种子50 g。选取发芽率高、腐烂率低、总重大、长势好的荞麦芽的浸种时间作为最佳浸种时间。
1.3.3.3 培养温度对荞麦芽生长的影响
按1.3.3.1中的培养工艺培育荞麦芽,浸种时间为1.3.3.2中所得最佳浸种时间,培养温度分别设定为15 ℃、22 ℃、30 ℃,培育天数为7 d,每盘种子50 g。选取发芽率高、腐烂率低、总重大、长势好的荞麦芽的温度作为最佳培养温度。
1.3.3.4 培养时间对荞麦芽生长的影响
按 1.3.3.1中培养工艺培育荞麦芽,浸种时间为1.3.3.2中所得最佳浸种时间,培养温度为1.3.3.3中最佳培养温度,分别培养至5 d、7 d、9 d后选取发芽率高、腐烂率低、总重大、长势好的荞麦芽的培养时间作为最佳培养时间,每盘种子50 g。
1.3.3.5 最佳条件下培育荞麦芽
在确定荞麦芽的最佳浸种时间、培养温度、培养时间后,在此条件下按1.3.3.1中培养工艺培育荞麦芽,每盘种子50 g,测量其总重、发芽率、腐烂率、10 cm以上芽长重量、5 cm到10 cm芽长重量、5 cm以下芽长重量。
1.4 荞麦芽相关性质测定
在最佳条件下培育荞麦芽,实验组用麦饭石水培养,对照组用矿泉水培养。培育7 d后齐根剪断,去除种皮并收集备用。
1.4.1 最佳培养条件下荞麦芽感官评定
从收集的芽菜中随机抽取样品用于检测。参照[13]进行感官评价,分级标准为:

表1 荞麦芽的感官评价标准Table 1 Sensory evaluation standard of buckwheat sprouts
1.4.2 最佳培养条件下荞麦芽物性测定
分别选取两组长度均匀的新鲜荞麦芽10 g,使用TA-XT. Plus型物性测定仪测定两组荞麦芽的硬度、胶黏性、弹性、咀嚼性、恢复能力、粘结性等指标。
1.4.3 最佳培养条件下荞麦芽元素含量测定
将淘洗、晾干之后的荞麦芽打磨成浆,分别取0.50 g样品,加水定容至25 mL,参照付翠轻[12]等人的研究进行元素测定。
1.4.4 抗氧化活性测定
1.4.4.1 不同乙醇体积分数荞麦芽提取液DPPH·清除率的测定
将发芽7 d的荞麦芽按质量体积比1∶5进行打浆,用15%、35%、55%、75%、95%的乙醇溶液在60 ℃下震荡提取2 h。提取完成后过滤取上清液,并密封于棕色瓶内,低温(0~4 ℃)下避光储藏备用。参照Li等[14,15]的研究,分别对两组荞麦芽的DPPH·清除率进行测定。
1.4.4.2 最佳培养条件下荞麦芽乙醇提取液自由基清除率的测定
根据1.3.4.1所得最佳荞乙醇提取体积分数,对最佳培养条件下所培养的荞麦芽进行前处理。参照 Li等[14,15]的研究,分别对两组荞麦芽的DPPH·清除率进行测定。参照文镜等[16,17]人的研究,对·OH清除率进行测定。参照袁勤生等[18~20]的研究,对·O2-进行测定。
1.5 数据处理
试验数据以平均值±标准差(¯x±S.D.)表示,采用SPSS 17.0软件进行统计学分析。分析方法采用单因素方差分析和邓肯(Duncan)多重比较,显著性水平小于0.05时认为差异显著。
2 结果与讨论
2.1 麦饭石水与矿泉水中元素的测定

表2 麦饭石水中微量元素的测定Table 2 Determination of Trace Elements in Water Extract of Medical Stone
根据表2可知,不同元素的溶出效果不同。较之于矿泉水,麦饭石水中元素含量更为丰富:其中,微量元素硒、镁、铜、锶的增加率分别为 178.30%、19.50%、18.10%、39.00%,锰的增加率更是高达1689.10%;常量元素麦饭石水中钾、钙的增加率高达912.50%、30.30%,在矿泉水中未检测到的铬元素,在麦饭石水质宏得到检测。元素铁、钴、锌及有害元素镉、铅和砷等在两种水中均未得到检测。
石玉臣等[21]指出,麦饭石中,不同元素的溶出程度不同:其中,微量元素的溶出程度比常量元素高;对人体有益的微量元素,如 Li、Mn、Sr、Th、Se、Ge和Mo等溶出程度较高;对人体有害的元素Pb、Hg、As、Cd等溶出程度甚微,远低于生活饮用水质的限值。
闫平科等[22]的研究指出,麦饭石溶出性能的差异,受到麦饭石母岩的风化(该过程中,一些常量元素从矿物中析,另一些常量元素进入矿物内部)程度、矿物颗粒度、溶出时间、水溶液浓度等因素的影响。根据表2所呈现出的实验结果可知,麦饭石在矿泉水中不同元素的增加率不同可归因于其中元素的溶出性能的差异,而实验过程中,麦饭石中元素溶出性能亦因实验所用麦饭石的风化程度、元素含量、麦饭石颗粒大小、溶出温度、溶出时间、麦饭石水比等因素的影响而呈现差异。
2.2 荞麦芽最佳培养工艺的确定
2.2.1 浸种时间对荞麦芽生长的影响
由表3可知,与对照组相比,各个浸种时间的实验组中所培育的荞麦芽发芽率都较高,腐烂率都较低。对照组与实验组中,各个浸种时间条件下,浸种12 h的荞麦,培养7 d,荞麦芽发芽率最高、腐烂率最低;各个浸种时间条件下,培养7 d,芽长高于10 cm的荞麦芽重量占总芽重比例最高,芽长5~10 cm的荞麦芽重量占总芽重的比例其次,芽长低于5 cm的荞麦芽重量占总芽重的比例最低。由此可知,就浸种时间而言,浸种12 h的荞麦,其芽生长效果最好,其次为8 h、16 h、20 h。最终,将最佳浸种时间确定为12 h。

表3 浸种时间对荞麦芽生长的影响Table 3 Effect of Soaking Time on the Growth of Buckwheat Sprouts
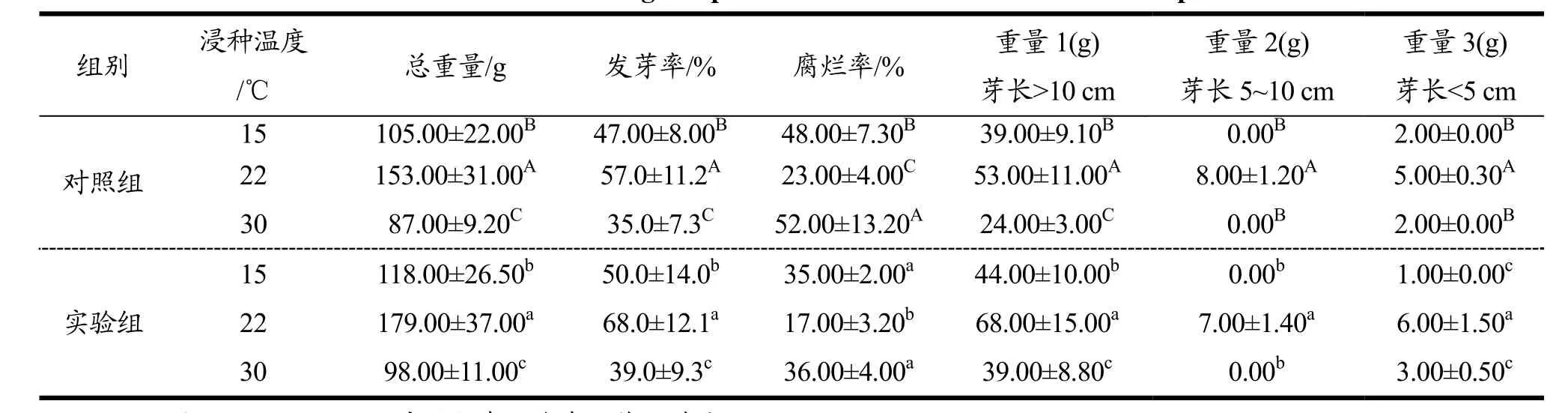
表4 培养温度对荞麦芽生长的影响Table 4 Effect of Cultivating Temperature on The Growth of Buckwheat Sprouts
2.2.2 培养温度对荞麦芽生长的影响
由表4可知,与对照组相比,各个培养温度条件下,实验组中荞麦的发芽率更高,腐烂率更低。对照组与实验组中,22 ℃培养条件下所培养的荞麦芽,发芽率最高,腐烂率最低。各个温度下所培养的荞麦芽,培养7 d,芽长高于10 cm的荞麦芽重量占总芽重比例最高,芽长5~10 cm的荞麦芽在15 ℃、30 ℃的培养条件下未出现。由此可知,就浸种温度而言,22 ℃条件下生长的荞麦,其芽生长效果最好,其次为15 ℃、30 ℃。最终,将最佳浸种时间确定为22 ℃。
2.2.3 培养时间对荞麦芽生长的影响
由表5可知,各培养天数条件下,随着培养天数的增加,总重、发芽率、腐烂率均逐渐增加,与培育天数7 d、9 d相比,培育5 d时发芽率明显较低,芽长显著矮小,但腐烂率也相对较低。与培育5 d的荞麦芽相比,培育9 d的荞麦发芽率稍有增加,芽长也稍高壮。
与对照组相比,对应培育天数条件下的对照组发芽率更高,腐烂率更低。据实验观察得知,与培育7 d的荞麦芽相比,培育7 d的荞麦发芽率也稍有增加,芽长而柔弱,且腐烂率增加。因此,将最佳培育天数确定为7 d。
2.2.4 最佳培养条件下培育的荞麦芽重量及发芽率
根据以上探究,将荞麦芽的最佳培育条件确定为:浸种时间为12 h,培养温度为22 ℃,培养时间为7 d。在此条件下,培育荞麦芽,结果见表 6:最佳培育条件下,实验组的生长状况优于对照组,实验结果与单因素实验的实验结果存在一致性。由表3~6可知,对照组、实验组的实验结果存在一致性:就发芽率和芽重而言,实验组高于对照组;就霉变率而言,对照组高于实验组。

表5 培养时间对荞麦芽生长的影响Table 5 Effect of Cultivating Time on The Growth of Buckwheat Sprouts

表6 最佳培养条件下培育的荞麦芽重量及发芽率Table 6 Weight and Germination Rate of Buckwheat Sprouts Cultivated under Optimum Conditions
何述详等[23]的研究发现,经由麦饭石溶出的水亦具有抑制真菌生长的作用[7]。籍凤秋等[24]的研究显示,用麦饭石制备的抗菌剂具有优异抗菌性和耐久性。据日本[25]有关资料显示,麦饭石能够促进植物的生长,提高其耐缺氧能力。刘墨祥等[26]的研究指出,以麦饭石作为矿物质肥料,可对农作物的生长发育起到促进作用。惠麦侠等[4,27,28]的研究指出,麦饭石中的可溶性元素能有效促进植物生根,帮助植物在短时间内较快产生根系,且利于缓苗,提高幼苗的成活率和质量。有关研究也指出,用麦饭石水提液培育小麦、黄豆、玉米,均使得这三种作物的发芽率得到提高,并促进了该三种作物的生长。此外,将麦饭石用于水稻盆栽及心里美萝卜的田间栽培试验结果也证实了麦饭石对农作物增产的效果。根据实验现象观察及表3~6的实验结果可知,实验组的腐烂率更低,产生霉菌的数量更少,根系更为发达,浓密,芽重更高,这可能归结于实验组所用的麦饭石水对霉菌的生长具有一定的抑制作用,且麦饭石水优化了荞麦芽的生长环境,提升了荞麦芽的发芽成活率,增强了实验组荞麦芽的生长能力,促进了荞麦芽重量的增加。
2.3 最佳培养条件下培育的荞麦芽性质测定
2.3.1 荞麦芽中微量元素的测定

表7 最佳培养条件下培育的荞麦芽中微量元素的测定Table 7 Trace Elements Determination of Buckwheat Sprouts Cultivated Under Optimum Conditions
由表7可知,对照组中有害元素铅的含量是实验组的 2.34倍。实验组中有益元素铬含量是实验组的6.22倍。与实验组相比,对照组锶、钾、铁和锌等元素含量高于实验组,但差异不明显。
与对照组相比,实验组中部分元素,比如硒、镁、钾、锰和铁等元素含量的减少,钙元素含量增加,可能原因是荞麦芽吸收这些元素用于满足自身代谢的需要,与此同时减少了这些元素在荞麦芽中的富集。这与刘墨祥[23~26]等研究中,麦饭石及麦饭石水提液促进植株自身生长发育和质量的研究结果存在一致性。且就安全性层面来讲,实验组的安全性更高,更符合健康的标准。
2.3.2 荞麦芽的感官测定
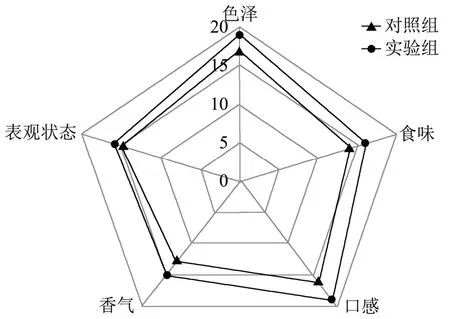
图1 最佳培养条件下培育的荞麦芽的感官评价Fig.1 Sensory Evaluation of Buckwheat Sprouts Cultivated Under Optimum Conditions
由图1可知,对照组表观状态、色泽、食味、口感、香气等指标得分分别为15、17、14、16、13,总体得分为75;实验组表观状态、色泽、食味、口感、香气等指标得分分别为16、19、16、19、15,总体得分为84。与对照组相比,实验组的表观状态、色泽、食味、口感和香气等指标都相对较好。根据表1所列的感官评价标准,感官评分越高,荞麦芽的感官品质越高。由此可知,由麦饭石水培养的荞麦芽,其感官品质优于矿泉水培养的荞麦芽。
据有关研究[23~26]显示,经由麦饭石或麦饭石水参与其发芽、生长的植物,其植株的质量可得到提升。图1中,实验组的感官评分的各项指标都高于对照组,这可能是麦饭石水较矿泉水更能促进荞麦芽质量提高,实验组吸收了麦饭石水中较多的元素进而促进荞麦芽自身感官品质提升的缘故。
2.3.3 荞麦芽的物性测定
由表8可知,两组荞麦芽的弹性小、恢复能力、粘结性,并且实验组的硬度、胶黏性、咀嚼度均显著大于对照组。硬度系指材料的弹性、塑性、强度和韧性等力学性能的综合指标,实验组的硬度高于对照组,这说明实验组的荞麦芽更具弹性、韧性,这与实验组所呈现的较高的恢复能力与弹性相符。与对照组相比,咀嚼性之间的显著性差异在一定程度上归因于两组之间胶粘性的显著性差异,较高的胶粘性决定了较高的咀嚼性。从物性测试的结果来看,实验组优于对照组,麦饭石水使得荞麦芽具备更好的物理特性,麦饭石水增进了荞麦芽物性方面的品质。
据表8和图1可知,感物性测试从荞麦芽物理性质指标方面对感官评价的结果进行了验证,该两组实验的结果存在一致性,较好的感官品质与较优的物性测试结果相呼应。

表8 最佳培养条件下培育的荞麦芽的物性测定Table 8 Physical Properties Determination of Buckwheat Sprouts Cultivated Under Optimum Conditions
2.3.4 荞麦芽的抗氧化活性测定
2.3.4.1 不同乙醇体积分数荞麦芽提取液DPPH·清除率的测定

图2 不同乙醇体积分数荞麦芽提取液清除DPPH·能力的测定Fig.2 Determination of free radical DPPH scavenging activity belonging to buckwheat sprouts solution extracted by different concentration ethanol
由图2可知,不同体积分数的乙醇对荞麦芽提取液DPPH·清除率的影响不同。对照组中,乙醇体积分数为 55%时,DPPH·清除率最高,75%、95%的乙醇体积分数与之接近。实验组中,乙醇体积分数为55%时,DPPH·清除率最高。无论是对照组,还是实验组,随着荞麦芽培养天数的增加,不同乙醇体积分数DPPH·清除率趋势相似,且DPPH·清除率最高点出现在第7 d。两组实验中,实验组DPPH·清除率最高点高于对照组DPPH·清除率最高点。
由图2可知,不同发芽时间下,荞麦芽55%的乙醇体积分数提取物清除 DPPH·的能力不同。实验组DPPH·清除能力高于对照组。培养时间为7 d的荞麦芽,其DPPH·清除能力最高,实验组较对照组高15%。
朴春红等[29]人的研究表明,随着发芽时间的延长,荞麦苗的抗氧化能力呈上升趋势,在发芽第 9 d时抗氧化能力达到最高值,荞麦苗抗氧化物质几种在40%的乙醇中,其他体积分数的乙醇中所溶解的抗氧化物质相对较少。由图2~3可知,最佳培芽时间为7 d,最佳提取乙醇体积分数为55%。本文实验结果与朴春红[29]等人的研究结果有相符的地方,也存在一定差异。究其原因,可能是朴春红[29]等人的研究对象为用一般清水于所培养的荞麦苗,而本文所采用的是矿泉水和麦饭石水所培育的荞麦芽,矿泉水与麦饭石水分别加速了荞麦种子的萌发过程,并促进了荞麦芽的生长发育,得以将其最优发芽时间提前。
2.3.4.2 最佳培养条件下荞麦芽 55%乙醇提取液自由基清除率的测定
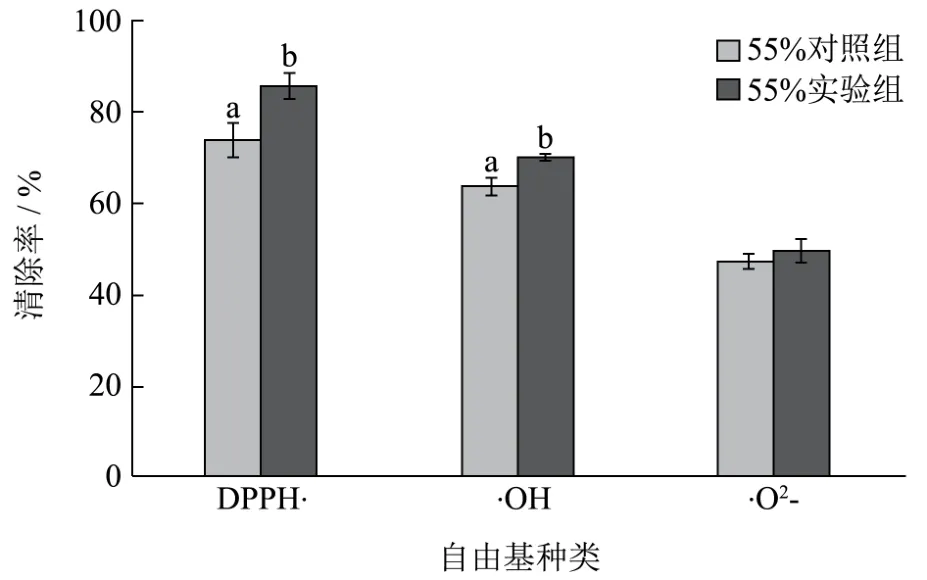
图3 最佳培养条件下荞麦芽55%乙醇提取液清除自由基能力的测定Fig.3 Determination of free radical scavenging activity belonging to 55% ethanol extracted solution of buckwheat sprouts cultivated under optimum cultivating condition
由图3可知,最佳培养条件下,最佳乙醇体积分数的荞麦芽提取液,实验组清除 DPPH·、·OH、·O2-的能力分别比对照组高14.90%、10.10%、5.20%。最佳培养条件下,最佳乙醇体积分数的荞麦芽提取液,实验组所具有的自由基清除能力更强。许效群等[30]的研究表明,燕麦发芽可增加可溶性糖、蛋白质、总酚、Vc等水溶性成分的含量,富集离子态的Fe和 Ca,Vc含量大幅上升,具有抗氧化活性的燕麦多酚含量得到显著增加。杨芙莲[31]等的研究指出,荞麦种子发芽期间,随着时间的增加,荞麦芽内部黄酮类物质含量呈升高趋势,在第7 d到达最大含量,7 d后有所下降。由图2~3中可知,培养7 d的荞麦芽在体积分数为55%乙醇的浸提作用下拥有较强的抗氧化活性,其原因在于体积分数为55%的乙醇能够更有效地浸提溶解培养7 d的荞麦芽内部所含有的抗氧化类物质。
3 结论
麦饭石水、矿泉水、实验组及对照组中元素测定的结果表明,麦饭石水中较为丰富的元素含量使其在培养荞麦芽方面更有潜在优势。物性测试、感官测评、芽中微量元素测定的结果表明,麦饭石水较矿泉水更能促进荞麦自身的萌发、生长发育及芽体的品质。最佳发芽工艺为:浸种12 h,培育温度22 ℃,培育时间7 d。荞麦芽清除自由基能力的测试结果表明,荞麦芽最佳乙醇浸提体积分数为55%,荞麦芽最佳发芽时间为7 d,麦饭石水培养的荞麦芽清除自由基的能力高于矿泉水培养的荞麦芽的能力。结合芽菜生长发育所需,利用各种天然资源,生产具有不同特色的芽菜有望为有机、绿色、安全、营养的芽菜提供一种方法借鉴。

