下肢动脉粥样硬化斑块内miRNA-199a-3p对外周血单核细胞的影响
颜雯 钟文清 许晓双 胡桂芳 杨美兰 程佳
动脉粥样硬化是多因素共同参与的血管壁的慢性炎症性疾病, 亦是脑卒中、冠心病、周围血管疾病的病理生理基础,可对人类健康造成严重危害[1]。动脉粥样硬化的病理显示,氧化低密度脂蛋白(OX-LDL)识别、吞噬以及泡沫细胞形成中单核-巨噬细胞的关键性和特征性尤为突出, 并对动脉粥样硬化发挥着重要作用[2]。MV是多种细胞分泌产生的膜囊泡, 表面蛋白具有抗原性, 易被多种受体细胞识别, 因其能转移来源细胞相关的DNA、蛋白质、miRNA、mRNA的能力而被认为是细胞间通讯、信息传递的有效载体[3]。研究表明[4], MV与动脉粥样硬化的关系密切, 其携带的miRNA可对靶细胞mRNA表达进行调控, 其中miRNA-199a-3p与单核细胞的炎症反应相关。本次研究通过对下肢动脉粥样硬化斑块内miRNA-199a-3p的检测, 并探讨其对外周血单核细胞的影响, 具体报告如下。
1 资料与方法
1.1 一般资料 选取2016年1月~2017年6月在本院就诊的下肢动脉粥样硬化闭塞症患者(实验组)和健康体检者(对照组), 各60例, 取外周血标本。实验组患者的入选标准:术前影像学检查[下肢血管彩超或CT血管成像(CTA)]确诊下肢动脉有动脉粥样硬化斑块并血管狭窄的患者;排除标准:合并严重肝肾功能不全者、恶性肿瘤及孕妇患者。实验组男36例, 女24例;年龄40~78岁, 平均年龄(66.9±5.2)岁。对照组男34例, 女 26例;年龄40~80岁, 平均年龄(67.2±4.8)岁。两组一般资料比较差异无统计学意义(P>0.05), 具有可比性。新鲜血管组织标本取自1例在本院就诊的下肢动脉粥样硬化闭塞症患者的截肢远端血管, 以其截肢近端血管作为对照。所有患者均自愿参加并签署知情同意书。
1.2 方法
1.2.1 miRNA-199a-3p表达水平检测 ①血管组织:取新鲜血管组织标本, 分别提取总RNA, 按照试剂盒说明书采用茎环引物的SYBR Green I实时荧光定量PCR方法检测miRNA-199a-3p水平。②MV:磷酸盐缓冲液(PBS)以1∶7的比例加入外周血中进行稀释, 100000 r/min离心, 2 h, 弃上清液, 沉淀为抽提的MV, PBS悬浮, -80℃保存, 以上述同样方法进行miR-199a-3p检测。③外周血单核细胞:6%右旋糖酐溶液加入新鲜外周血, 静置60 min, 上层液置入其他试管 , 加 入 Hank’s液 (无 Mg2+、Ca2+), 混匀 , 2000 r/min 离心, 10 min, 弃上清液, 洗涤2次;以CD68为单核细胞标志物, 分选并留取单核细胞, 以同样方法检测miR-199a-3p表达水平。
1.2.2 单核细胞培养及转染 复苏取自液氮罐中的人单核细胞T THP-1冻存管, 采用DMEM培养基(含10%胎牛血清)重悬, 并在细胞培养箱中进行培养, 5% CO2、温度37℃,离心后传代或换液, 维持细胞“单个、亮、圆”的悬浮状态。细胞对数生长期, 分设miRNA-199a-3p inhibitor组、miRNA-199a-3p mimics组、空白对照组, 各组设复孔6个,转染 miRNA-199a-3p inhibitor、miRNA-199a-3p mimics、FuGENE, 静置15 min, 置入细胞培养液中培养, 5% CO2、37℃, 3 d后提取RNA浓度及质量。采用超微量分光光度仪对提取的RNA 浓度及质量进行检测, miR-199a-3p表达水平经实时荧光定量PCR检测。
1.2.3 趋化因子检测 各组单核细胞提取总RNA, 逆转录为cDNA, 采用PCR检测MCP-1、RANTES、Fractalkine。
1.3 统计学方法 采用SPSS22.0统计学软件进行数据统计分析。计量资料以均数±标准差表示, 采用t检验;计数资料采用χ2检验。p<0.05表示差异具有统计学意义。
2 结果
2.1 miRNA-199a-3p表达水平
2.1.1 血管组织内miRNA-199a-3p表达水平 动脉粥样硬化斑块内miRNA-199a-3p表达水平(8.49±3.05)高于正常组织的(3.64±1.20), 差异有统计学意义(p<0.05)。
2.1.2 外周血单核细胞、MV内miRNA-199a-3p表达水平实验组外周血单核细胞、MV中的miRNA-199a-3p表达水平高于对照组, 差异有统计学意义(p<0.05)。见表1。
2.1.3 外周血单核细胞各组miRNA-199a-3p 表达水平miRNA-199a-3p inhibitor组外周血单核细胞中的miRNA-199a-3p表达水平低于空白对照组, miRNA-199a-3p mimics组外周血单核细胞中的miRNA-199a-3p表达水平高于空白对照组, 差异有统计学意义(p<0.05)。见表2。
2.2 单核细胞各组Fractalkine、RANTES、MCP-1的mRNA表达水平 检测Fractalkine、RANTES、MCP-1的mRNA表达水平, miRNA-199a-3p inhibitor组高于空白对照组, miRNA-199a-3p mimics组低于空白对照组, 差异有统计学意义(p<0.05)。见图 1。
表1 实验组和对照组外周血单核细胞、MV内miRNA-199a-3p表达水平比较

表1 实验组和对照组外周血单核细胞、MV内miRNA-199a-3p表达水平比较
注:与对照组比较, ap<0.05
组别 例数 单核细胞 MV实验组 60 0.89±0.11a 6.29±1.22a对照组 60 0.34±0.09 3.06±0.60

表2 外周血单核细胞各组 miRNA-199a-3p 表达水平比较( x-±s)
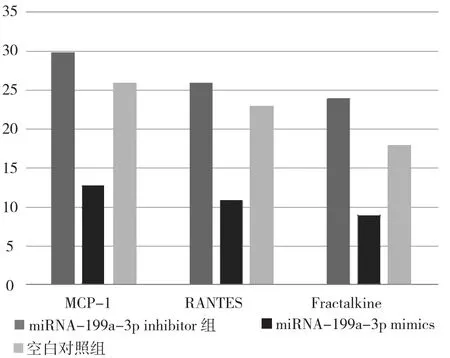
图1 外周血单核细胞各组Fractalkine、RANTES、MCP-1的mRNA表达水平
3 讨论
动脉粥样硬化是个多细胞多因子参加的血管慢性炎症过程, 其中单核巨噬细胞的诱导活化后粘附于血管内皮并迁徙至内膜下而转变为泡沫细胞, 进而释放大量的促炎因子加重局部的炎症反应, 是动脉粥样硬化的病变发展的第一步。miRNA-199a-3p在19号染色体p13.2的DNM2基因16号内含子内, 主要在胃癌、肝癌、膀胱癌等肿瘤细胞中高表达,而近期有研究发现miR-199a-3p可抑制上述炎症反应, 并减少泡沫细胞的形成, 而且发现部分预后良好的动脉粥样硬化患者血浆中含miRNA-199a-3p的外泌体浓度偏高, 在动脉粥样硬化的发生发展中miRNA-199a-3p有着重要影响[5,6]。本研究结果显示, 动脉粥样硬化斑块内miRNA-199a-3p表达水平(8.49±3.05)高于正常组织的(3.64±1.20), 差异有统计学意义(p<0.05)。实验组外周血单核细胞、MV中的miRNA-199a-3p表达水平高于对照组, 差异有统计学意义(p<0.05)。进一步证实动脉粥样硬化斑块内巨噬细胞表达的miRNA-199a-3p可通过MV形式分泌入外周血, 被单核细胞吞噬并产生影响。此外, 由于趋化因子RANTES、Fractalkine、MCP-1与泡沫细胞转化和动脉粥样硬化斑块形成密切相关[7,8], Fractalkine是CX3C家族趋化因子, 与受体CX3CR1结合, 在动脉粥样硬化中具促炎作用;MCP-1对平滑肌细胞增殖具有趋化和促进作用;RANTES与CCR5结合作用于T细胞、嗜酸粒细胞及单核细胞上, 可促进动脉粥样硬化斑块形成[9,10]。本研究发现, 外周血单核细胞经miRNA-199a-3p inhibitor和miRNA-199a-3p mimics成功转染后, miRNA-199a-3p表达水平分别上调、抑制, 同时, miRNA-199a-3p对外周血单核细胞内的Fractalkine、RANTES、MCP-1表达具有抑制作用。因此, 推测miRNA-199a-3p能够抑制上述动脉粥样硬化过程。
总之, 下肢动脉粥样硬化斑块内miRNA-199a-3p水平高表达, 其以MV形式分泌至外周血中, 对单核细胞中的趋化因子表达具有抑制作用, 是动脉粥样硬化的保护因素。

