人脑自适应多尺度功能连接的性别差异*
段凯凯 董昊铭 苗丽雯 苏学权 相 洁 左西年,7
人脑自适应多尺度功能连接的性别差异*
段凯凯1董昊铭2,3,4,5苗丽雯1苏学权6,7相 洁1左西年2,3,4,5,7
(1太原理工大学, 计算机科学与技术学院, 太原 030024) (2中国科学院行为科学重点实验室, 北京 100101)(3中国科学院大学, 心理学系, 北京 100049) (4中国科学院心理研究所磁共振成像研究中心, 北京 100101)(5中国科学院心理研究所, 脑与心智毕生发展研究中心, 北京 100101) (6广西师范学院, 体育学院, 南宁 530000) (7广西师范学院, 脑与教育重点实验室, 南宁 530001)
已有脑成像研究展示了男女脑功能差异, 但功能磁共振信号的频率划分通常基于主观经验, 使脑功能性别差异的生物学解释遭遇瓶颈。本文提出人脑自适应多尺度功能连接算法, 刻画功能连接的时空多尺度特性, 揭示出0.06~0.10 Hz的性别差异:男性较强的连接主要与边缘网络和腹侧注意网络有关, 女性较强的连接主要与腹侧注意网络、视觉网络和额顶网络有关。
性别差异; 功能连接; 脑网络; 功能磁共振成像; 低频特性

1 引言
近年来, 随着认知神经科学的快速发展和对功能磁共振成像(functional Magnetic Resonance Imaging, fMRI)了解的深入, 有关脑信号的频率研究也被广泛关注。fMRI信号来源于大脑血液中脱氧血红蛋白含量的动态变化, 是一种非平稳非线性变化的信号, 具有复杂的时频特征。另外, fMRI信号是大脑复杂的机理性反映, 不同频段节律信号的生理意义尚无定论, 对fMRI信号进行时频分析是当下一种较为热门的研究方向, 但是在已有的研究中, 研究人员多根据主观经验或经典方法将其划分, 缺乏统一的分频标准, 致使该领域内相关分频研究的可重复性较差, 同时由于经典算法对数据的假设较多, 未能充分发掘功能磁共振信号的自身特性, 也阻碍了我们进一步了解它的内在生理意义。例如, 在对fMRI低频成分的脑功能网络研究中, Wu等人(2008)用切比雪夫滤波器将fMRI信号分为12个频段, 并探讨了功能连接的频率特性, 发现具有高功能连接系数的脑功能活动集中在特定的低频段(0.01~0.06 Hz); Salvador, Suckling, Schwarzbauer和Bullmore (2005)以及Salvador等人(2008)基于傅里叶方法对信号分频揭示了较高功能连接系数的脑功能活动分布在低频段(<0.10 Hz); Achard, Salvador, Whitcher, Suckling和Bullmore (2006)利用小波变换方法分为6个频段, 证明了低频成分(0.03~0.06 Hz)的全脑相关性最高; Zuo等人(2010)基于滤波器方法揭示了低频振幅在(0.027~0.073 Hz)频段有更强的幅值; Liang等人(2012)采用滤波器方法验证了低频段(0.027~ 0.073 Hz)形成的脑网络比0.01~0.027频段形成的脑网络更稳定。上述研究均强调了fMRI信号低频成分的功能连接和网络特性, 但是在频率边界的界定上未能形成统一, 为后续的验证性和发现性研究设置了一定障碍。此外, 上述研究中采用的分频方法如傅里叶变换、切比雪夫滤波器等多假设信号线性平稳, fMRI信号并不能满足这一点, 这也限制了对其结果的解释和推广, 没有充分揭示fMRI信号的完整特性。
本文采用了一种数据驱动的多维集合经验模式算法对fMRI信号进行分频, 相比传统分频方法, 该算法以信号自身特性为出发点, 从时间维度和空间维度共同提取信号有效信息, 可以更加准确刻画出信号的物理过程。为展示这一新方法的应用, 我们针对“性别差异”这一生命科学, 特别是心理学, 领域中长期以来感兴趣的科学问题, 应用上述多尺度自适应的分频方法探究了大脑低频成分功能连接的性别差异, 尝试为该算法在脑功能领域的应用提供参考。
2 材料与方法
2.1 数据采集和预处理
本研究招募了66名健康右利手被试, 年龄范围18~35岁, 其中男性37例, 女性29例, 均无高血压、心脏病、脑血管病和神经精神类疾病, 均签署知情同意书。所有脑影像扫描均在中国科学院心理研究所磁共振中心完成, 磁共振扫描仪为GE (3T)MR750扫描仪, 扫描前用海绵垫将其头部固定好, 并告知在静息态磁共振扫描中保持头部不动, 注视屏幕中的十字, 不能入睡。人脑解剖形态的T1加权结构磁共振成像参数设置如下:翻转角为8度; 层厚为1 mm; 层间距为1 mm; 重复时间为6.896 mm; 回波时间为2.992 mm; 视野为256 mm, 采集矩阵为256 × 256。人脑静息态功能的磁共振成像参数设置如下:翻转角为10度; 层厚为3.5 mm; 层间距为0.5 mm; 回波时间为30 mm; 重复时间为2000 mm; 视野为220 mm, 采集矩阵为64 × 64。图像采用中国科学院心理研究所脑功能连接组及发展实验室研制的连接组计算平台(Connectome Computation System, CCS) (https:// github.com/zuoxinian/CCS) (Zuo et al., 2013; Xu et al., 2015)进行预处理, 首先结构像使用volbrain脑影像在线处理平台(http://volbrain.upv.es/)进行图像去噪, 信号值矫正, 颅骨分割等步骤, 再调用FreeSurfer (Fischl, 2012)的Recon-all程序对大脑皮层进行分割和二维表面重建。静息态fMRI图像预处理包括:(1)剔除每次扫描的前5个时间点共10 s的数据。(2)进行野点矫正, 扫描时间矫正、头动矫正, 其中头动使用平均帧平移(meanFD)进行量化, meanFD超过0.5 mm的数据将被排除(Jo, Saad, Simmons, Milbury, & Cox, 2010; Power, Schlaggar, & Petersen, 2015)。(3)使用基于灰白质边界的配准方法将个体的功能像配准至T1加权结构像(FreeSurfer:bbregister) (Greve & Fischl, 2009)。(4)对个体的功能像进行灰质、白质、脑脊液的分割(Fischl et al., 2002)。(5)回归个体白质和脑脊液平均时间序列、使用Frston24头动参数模型进行头动回归(Yan et al., 2013; Zang et al., 2007)。(6)进行时间序列的带通滤波(0.01~0.1 Hz)滤波。
2.2 分频脑网络的构建
本文采用快速多维集合经验模式分解(Fast Multi-Dimensional Ensemble Empirical Mode Decomposition, FMEEMD)方法对fMRI信号进行分频, 不同于传统的Fourier变换和小波变换方法, 完全以信号自身特征为依据进行分解, 分解过程中会产生不同特征尺度的本征模态函数(IMF)并对其进行Hilbert变换可得信号瞬时频率等特性, 是对信号的真实物理过程的反映(Wu, Huang, & Chen, 2009; Wu & Huang, 2009)。在求解fMRI信号的频段时, 对大脑的每个感兴趣区域(Region Of Interest, ROI)的BOLD信号分解得到IMF, 再进行Hilbert变换得到瞬时频率, 同时引入希尔伯特加权频率(Hilbert weighted frequency, HWF) (Xie & Wang, 2006)来反映IMF的平均振荡频率(Song, Zhang, & Liu, 2014)。具体计算方法如下:
(1)对每个IMF进行Hilbert变换如公式(1)所示
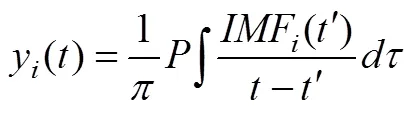
其中P代表柯西准则值。
(2)计算其解析信号:
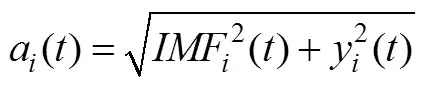
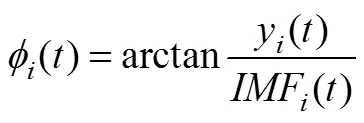
(3) IMF的瞬时频率计算如公式(5)所示:
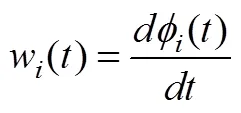
(4)每个IMF的m个数据点的HWF计算:
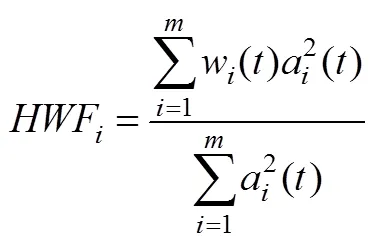
本文计算了每个ROI的IMF1到IMF5的HWF值, 得到整个大脑信号的IMF1到IMF5的频率分布, 采用了如图1所示的方法构建不同频段的脑网络, 主要过程包括数据预处理、根据脑图谱提取感兴趣区域的时间序列、时间序列分频处理、计算不同频段范围节点之间的关联矩阵形成脑网络、计算不同频段脑网络全局和局部特征等, 上述算法将随未来CCS的新版本发布。人脑连接组计划(Human Connect Project, HCP) (Glasser et al., 2016)提出的最新多模态皮层分区涵盖了迄今最为全面的多模态脑影像学信息, 基于此我们提取每个ROI内所有体素的平均时间序列作为该ROI的时间序列。HCP皮层分区将全脑皮层数据划分成360个ROI作为脑节点, 左右半脑各180个。由于功能像采集中颞极、眶额等部分的信号丢失, 最终剩余354个脑区。对每个被试的354个脑区的时间序列采用如上的FMEEMD方法进行分频处理, 得到4个频段的ROI的时间序列, 然后在各个频段下计算每对ROI时间序列之间的皮尔逊相关系数, 构建脑功能网络。
注:彩图见电子版, 下同
2.3 统计检验
将每个频段的功能连接矩阵通过fisher Z变换转换为Z值, 进行双样本(男女) t检验, 使用FDR矫正进行ROI级别的多重比较校正, 校正后的统计性显著性水平为0.05。为便于讨论研究发现, 最后再将功能连接矩阵涉及的HCP分区联系到Yeo的7个脑功能网络(Yeo et al., 2011), 即根据一个HCP的分区所占脑功能网络的比例来决定它的网络归属, 这样就可以结合脑区和网络来共同探讨不同频段的大脑功能连接的性别差异。
3 结果
3.1 不同频段的脑网络构建结果
采用FMEEMD方法对所有被试的数据分频范围显示频率范围0.01~0.10 Hz, 详细频率范围分布如图2所示。其中IMF1的频段范围为0.06~ 0.10 Hz, IMF2范围为0.036~0.06 Hz, IMF3范围为0.025~0.036 Hz, IMF4范围为0.01~0.025 Hz。
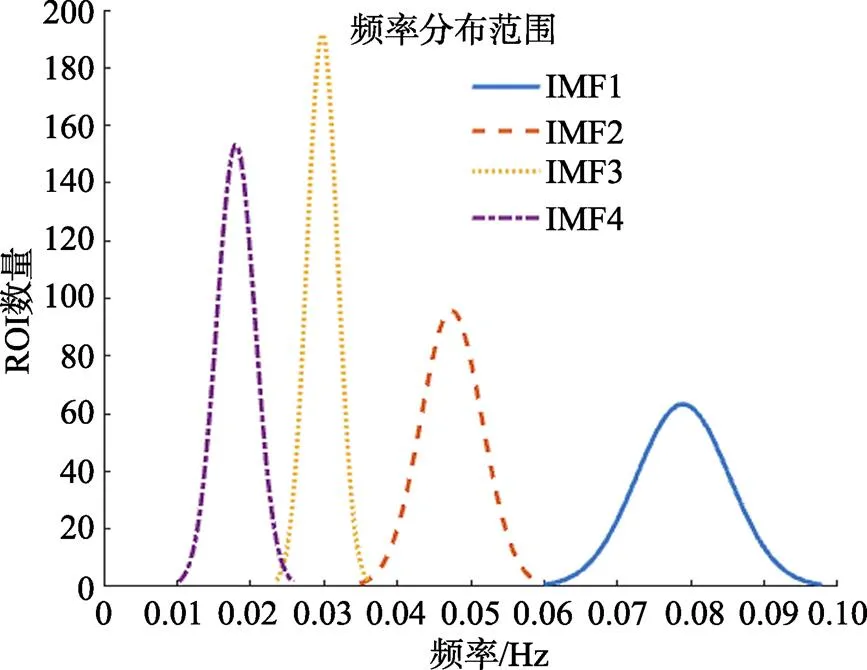
图2 频率范围分布
图3展示了4个频段上的组水平平均功能连接矩阵, 按照Yeo的7网络分区将所有脑区重新排序, 矩阵从左至右(从上至下)依次为视觉网络、感觉运动网络、背侧注意网络、腹侧注意网络、边缘网络、额顶控制网络和默认网络内脑区与其他脑区的组水平平均相关系数(z值)。研究结果显示:随着频率段降低, 网络间的功能连接逐步以负连接为主, 而网络内部区域之间也逐步出现较多的负连接, 七大皮层功能网络间模块化逐渐减弱, 在IMF1 (0.06~0.10 Hz)内可发现7个网络内的功能连接明显强于网络间的功能连接, 其中默认网络的网络间功能连接, 特别是与边缘网络之间的功能连接强于其他网络, 在该频段内, 网络间的长程连接数量和强度均多于其他频段; 在IMF2 (0.036~0.06 Hz)内, 全脑功能连接均有增强, 同时边缘网络、额顶控制网络和默认网络之间的网络间功能连接强度上升, 该三网络间的区分度下降; 在IMF3 (0.025~0.036 Hz)内, 网络间的区分度进一步下降, 只有视觉网络、感觉运动网络、背侧注意网络、腹侧注意网络保持了较好的网络间区分度, 同时网络内的功能连接矩阵也逐渐出现分化, 提示在各网络内也存在着具有不同连接特性的子模块; 在IMF4 (0.01~0.025 Hz)内, 只有视觉网络和感觉运动网络保持了较好的网络完整性, 默认网络保持了部分子模块特性, 其他网络则已经很难区分。
3.2 男女差异的统计检验结果
磁共振成像扫描期间, 男女未表现出显著的头动差异(= −0.58,= 0.57), 因此未将头动作为影响因素考虑在功能连接比较中。将不同频段下的功能连接矩阵经Fisher Z转换后做独立样本t检验检验性别差异, 发现仅在IMF1 (0.06~0.10 Hz)频段上功能连接在性别间有显著的差异(校正后), 其他频段并无显著性差异。精确显示差异的脑区位置可在HCP脑区ROI分布中定位, 为L_FOP1_ ROI和R_V3CD_ROI, L_6ma_ROI和L_10pp_ROI, L_6ma_ROI与 R_10pp_ROI, L_8BM_ROI与 R_8C_ROI。上述脑区详细位置信息和所属网络如表1所示, 性别差异数据信息如表2所示, 其中p值经FDR校正(< 0.05, 校正后)。研究结果显示男性较女性组的功能连接较强的脑区在左侧6ma和左右侧10pp区域, 而在左侧FOP1和V3CD、8BM和8C区域间的功能连接在女性中强于男性。进一步从网络视角发现, 男性大于女性的功能连接存在于腹侧注意网络和边缘网络的网络间功能连接, 女性比男性较强的功能连接则在腹侧注意网络和视觉网络、额顶控制网络的网络内功能连接, 在其他频段并未发现显著差异。
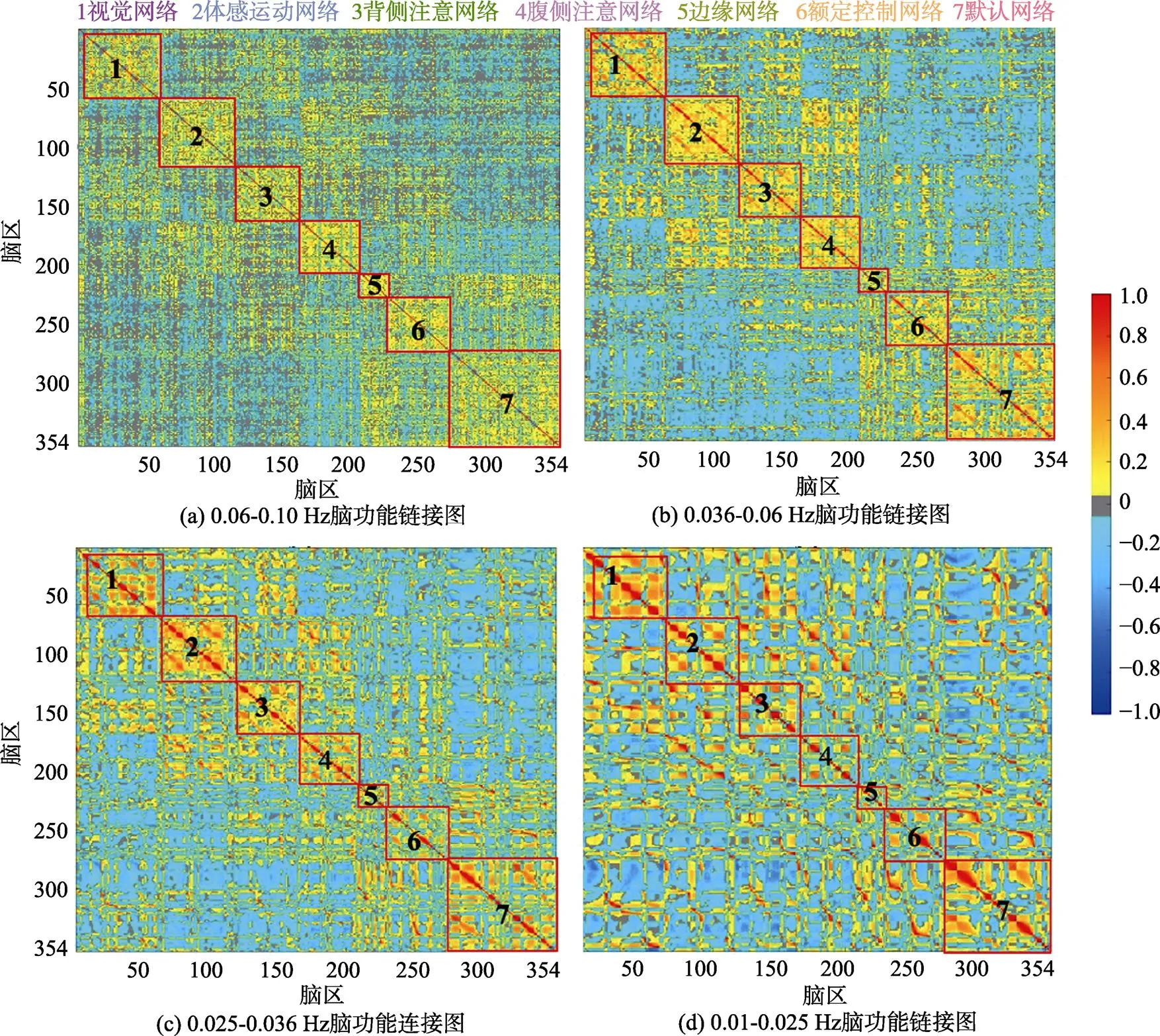
图3 不同频段的功能连接图

表1 脑区分布信息表
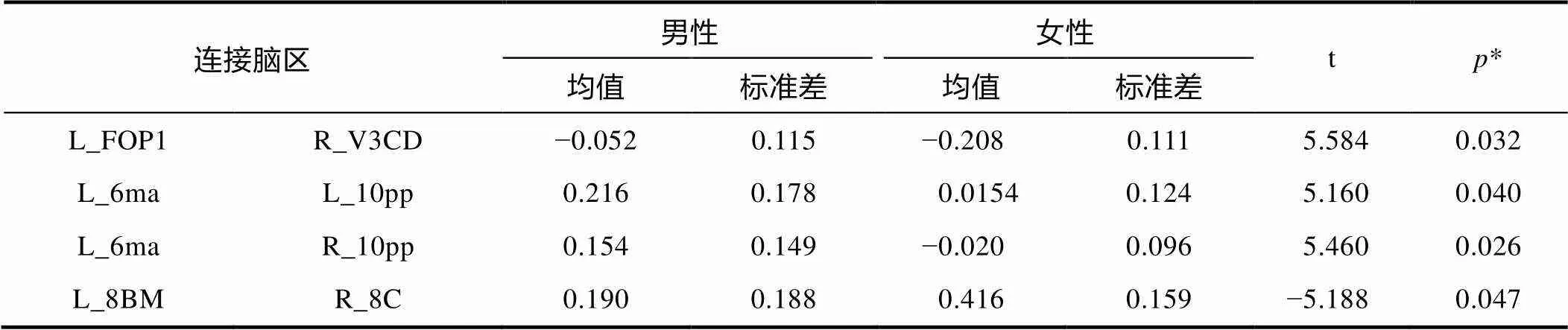
表2 功能连接性别差异结果
注:*经过FDR矫正
4 讨论
本研究首先使用FMEEMD方法对所有被试的功能磁共振数据进行了频率划分, 根据已有研究表明, fMRI的高频信号可能和头动、血流等因素有关, 同时不同预处理流程对分频结果产生较大影响, 由于本研究的主要目的并不在于使用FMEEMD分频方法区分fMRI原始信号中的噪音成分, 而是探究在不同频率段内fMRI信号可能具有的网络特性和男女差异, 因此使用了通常的数据预处理流程, 同时重点关注已有发现的具有较强生理意义的0.01~0.1 Hz低频段的信号。分频结果发现高频信号内具有较好的脑网络模块化, 同时网络间的功能连接较强, 高级认知皮层的模块化程度最强。而随着频率下降, 网络模块化趋势减弱, 但是局部连通性和网络内子模块化特性逐渐凸显, 最低频频段内, 只保留了初级感知觉皮层如视觉网络和感觉运动网络的模块化, 且网络内的子模块性最强, 如默认网络内的部分区域间功能连接在该频段内强度较高, 提示在该低频频段内的功能连接, 更倾向于反映初级感知觉皮层以及局部大脑区域间的功能连通性。因此, 我们认为, 不同频段内的大脑功能磁共振信号具有不同的功能特性, 这种功能特性可能对应着大脑认知功能的层级性。例如, 在高频成分内的较强的网络间连接可能反映的是不同网络间的信息传递性较强, 对应着高级认知功能协调不同大脑网络协同工作的特征; 随着频率降低, 皮层七大网络间模块化减弱, 可能反映在不同频段下人脑的模块化信息处理的尺度差别, 信息主要是相同认知功能的成分间传递; 而在最低频段内仅保留初级感知觉皮层的模块化, 而网络内不同成分间的连通性都已经较低, 可能预示着在该频段内信息只在负责特定具体功能的区域间具有较好的连通性, 而负责高级认知功能的网络模式已很难观察到。因此随着频段由高至低, 可能对应着大脑功能从高级认知控制(协调负责不同功能的脑区间活动)到复杂认知功能实现(实现特定认知能力)再到单一认知能力(初级感知觉加工)的功能层级性。在此基础上, 我们进一步分析了不同频段下功能连接的性别差异, 发现只在IMF1频段出现了差异, 且多为网络间的长程连接差异, 网络内功能连接差异体现在左右脑间的额顶控制网络内, 一定程度上也佐证了上述分频结果, 即IMF1较好保留了大脑网络特性, 能反映网络间的长程功能连接。
FOP1和V3CD区域间存在负向功能连接, 且具有显著的男女差异。该连接强度在男性中较弱, 女性中较强, 说明男性中该两区域间的功能关联性较低, 而在女性中存在反向的功能同步性。FOP1比周围区域的髓鞘化更强, 一般在进行运动相关任务时激活。该区域从属于腹侧注意网络, 主要负责自下而上的认知加工, 接收初级皮层的感觉信息输入并对其进行反应(Eckert et al., 2009)。V3CD区域属于枕外侧颞叶皮质, 毗邻视觉联络区V4 (Abdollahi et al., 2014; Malikovic et al., 2016), 有更多的髓磷脂和较少的皮层厚度, 负责对复杂的视觉的加工。我们认为, 女性在FOP1和V3CD间的反向功能同步性可能预示着在女性中处理复杂视觉信息的脑区与注意相关的脑区活动间存在一定的竞争关系, 而在男性中这两个区域间的关联性很低, 说明可能仅在女性中存在支持脑功能活动的竞争关系(Sorge & Totsch, 2017; Herlitz & Rehnman, 2008)。
在6ma区域和左右侧10pp区域间的功能连接在男性中显著强于女性, 6ma区域属于辅助运动区(SMA)的一部分, 在人体中SMA的神经元直接投射到脊髓上, 主要控制运动的内部生成规划、运动序列的规划和身体两侧的协调, 起到直接控制运动的作用, 如攀爬和跳跃等具体行为(Serrien, Strens, Oliviero, & Brown, 2002; 张琪涵等, 2014)。该区域也属于腹侧注意网络, 参与自下而上的认知调控。10pp区域位于眶额和额极皮质区域, 在HCP分区中该区域被划分为11个子区域, 10pp是其中一个, 眶额区域被认为是参与许多高级的认知工作, 比如未来行动的规划和组织, 以及类比的能力等, 是基于抽象的规划、情节记忆和短时记忆信息的基础(Bludau et al., 2014), 但是相较于眶额部其他区域, 10pp区在工作记忆、语言故事等任务中表现出了去激活, 仅在运动任务中表现出了一定的激活, 我们推测10pp区域可能在眶额皮层区域负责协调信息传入和认知规划的作用(van Essen, Glasser, Dierker, Harwell, & Coalson , 2012)。我们认为, 6ma和双侧10pp区域间的功能连接在男性中强于女性, 与上述FOP1和V3CD间的功能连接结果相呼应V3CD和FOP1间的功能连接是基本感知觉信息上传至高级认知控制区域的中转, 是信息开始进入腹侧注意系统自下而上加工的开始, 并且FOP1主要受运动相关任务激活, 而6ma区域则恰好是属于辅助运动区, 它和左右侧10pp区域的功能连接很可能是腹侧注意系统加工后的信息进入高级认知控制的通路, 之后再由眶额部分其他区域进行运动规划。该通路体现了从刺激输入, 到引起注意分配, 再到高级皮层形成运动规划的自下而上加工的完整信息加工通路。而该通路的连通性在女性中弱于男性, 暗示男性在接收外界刺激信息, 并由此作出相关反应的功能通路连通性强于女性, 也符合日常经验, 即男性更擅长、可以更迅速对外界输入的视觉信息进行组织并作出应对。
相比于男性, 女性在左侧8BM和右侧8C区域之间的功能连接更强。8BM和8C区域都属于额顶控制网络, 8BM区域主要位于前扣带回和内侧前额叶皮质的顶后侧。该区域在结构上髓鞘化程度较强, 在工作记忆任务中激活, 在数学问题背景中的激活强于听觉理解, 并且具有偏侧化趋势, 如在关联任务强于匹配任务的激活中, 右侧8BM的激活区域更广泛。8C区域主要位于背外侧前额叶皮质, 背外侧前额叶皮质是人类大脑皮层中负责高级认知功能的皮层, 主要负责执行和认知功能, 包括工作记忆和认知灵活性(Barbey, Koenigs, & Grafman, 2013)等, 是实施认知控制的最重要脑区之一。8C区域在结构上髓鞘化程度较低, 在工作记忆任务上局部激活较强, 我们推测, 左侧8BM和右侧8C之间的功能连接, 特别是半球间连接, 体现了大脑在高级认知成分, 特别是在工作记忆和数字加工上的脑区间协调及整合性上, 女性要强于男性。
综上所述, 我们认为FMEEMD方法可以有效地提取大脑功能磁共振时间信号的频率特性, 同时, 基于FMEEMD方法所得到的男女功能连接差异表明, 男性在由下至上的加工中具有较强的功能连通性, 而女性则在工作记忆相关的高级脑区间表现出了较强的半球间整合性。本研究具有一定的局限性, 例如样本量较少, 影像学结果无法通过多重比较校正, 可能会导致未在其他频段发现性别差异; 同时本研究结果基于静息态功能磁共振数据, 缺少行为数据和相关实验结果的佐证, 未能充分讨论脑影像结果在行为中的表现; 此外在方法学上, 我们使用了较为保守传统的数据预处理方式, 可能会导致一定的假阴性结果, 未来可以使用FMEEMD方法对原始高质量(如multiband)序列采集的功能磁共振数据进行分析, 探讨该方法在数据预处理上的应用前景。
5 结束语
本文采用FMEEMD分解方法有效避免了经验驱动方式中需要提前定义频段的缺陷。对大脑的静息态fMRI低频成分(< 0.1 Hz)进行分频, 得到了4个频率段范围, 从高到低依次为0.06~0.10 Hz, 0.036~0.06 Hz, 0.025~0.036 Hz和0.01~0.025 Hz, 并构建了4个频段的大脑功能网络, 讨论了网络内和网络间的功能连接属性, 随频率提高, 功能连接矩阵中的网络化程度上升, 网络内功能连接下降, 网络间功能连接增强。在此基础上, 我们进一步比较了不同频段内功能连接的性别差异, 结果显示在0.06~0.10 Hz频段上, 男性比女性较强的功能连接分别集中在腹侧注意网络和边缘网络间, 体现了自下而上的加工方式; 女性比男性较强在腹侧注意网络和视觉网络、以及额顶控制网络内的功能连接, 体现了高级皮层在认知功能上的协调和整合性。本研究展示了FMEEMD分频算法在功能磁共振数据上的应用, 为男女差异提供了基于影像的人脑功能连接组学证据。
张琪涵, 刘颖, 周菘, 章鹏, 彭国慧, 宋星, 白学军. (2014). 主运动区与辅助运动区在运动执行与运动想象任务中的作用:一个近红外光谱技术的研究. 见. 北京: 中国心理学会.
Abdollahi, R. O., Kolster, H., Glasser, M. F., Robinson, E. C., Coalson, T. S., Dierker, D., Orban, G. A. (2014). Correspondences between retinotopic areas and myelin maps in human visual cortex., 509–524.
Achard, S., Salvador, R., Whitcher, B., Suckling, J., & Bullmore, E. (2006). A resilient, low-frequency, small-world human brain functional network with highly connected association cortical hubs., 63–72.
Barbey, A. K., Koenigs, M., & Grafman, J. (2013). Dorsolateral prefrontal contributions to human working memory., 1195–1205.
Bludau, S., Eickhoff, S. B., Mohlberg, H., Caspers, S., Laird, A. R., Fox, P. T., Amunts, K. (2014). Cytoarchitecture, probability maps and functions of the human frontal pole., 260–275.
Eckert, M. A., Menon, V., Walczak, A., Ahlstrom, J., Denslow, S., Horwitz, A., & Dubno, J. R. (2009). At the heart of the ventral attention system: The right anterior insula., 2530–2541.
Fischl, B. (2012). FreeSurfer., 774–781.
Fischl, B., Salat, D. H., Busa, E., Albert, M., Dieterich, M., Haselgrove, C., Dale, A. M. (2002). Whole brain segmentation: Automated labeling of neuroanatomical structures in the human brain., 341–355.
Glasser, M. F., Coalson, T. S., Robinson, E. C., Hacker, C. D., Harwell, J., Yacoub, E., van Essen, D. C. (2016). A multi- modal parcellation of human cerebral cortex., 171–178.
Greve, D. N., & Fischl, B. (2009). Accurate and robust brain image alignment using boundary-based registration., 63–72.
Herlitz, A., & Rehnman, J. (2008). Sex differences in episodic memory., 52–56.
Jo, H. J., Saad, Z. S., Simmons, W. K., Milbury, L. A., & Cox, R. W. (2010). Mapping sources of correlation in resting state fMRI,with artifact detection and removal., 571–582.
Liang, X., Wang, J. H., Yan, C. G., Shu, N., Xu, K., Gong, G. L., & He, Y. (2012). Effects of different correlation metrics and preprocessing factors on small-world brain functional networks: A resting-state functional MRI study., e32766.
Malikovic, A., Amunts, K., Schleicher, A., Mohlberg, H., Kujovic, M., Palomero-Gallagher, N., Zilles, K. (2016). Cytoarchitecture of the human lateral occipital cortex: Mapping of two extrastriate areas hOc4la and hOc4lp., 1877–1897.
Power, J. D., Schlaggar, B. L., & Petersen, S. E. (2015). Recent progress and outstanding issues in motion correction in resting state fMRI., 536-551.
Salvador, R., Martínez, A., Pomarol-Clotet, E., Gomar, J., Vila, F., Sarró, S., Bullmore, E. (2008). A simple view of the brain through a frequency-specific functional connectivity measure., 279–289.
Salvador, R., Suckling, J., Schwarzbauer, C., & Bullmore, E. (2005). Undirected graphs of frequency-dependent functional connectivity in whole brain networks., 937–946.
Serrien, D. J., Strens, L. H. A., Oliviero, A., & Brown, P. (2002). Repetitive transcranial magnetic stimulation of the supplementary motor area (SMA) degrades bimanual movement control in humans., 89–92.
Song, X. P., Zhang, Y., & Liu, Y. J. (2014). Frequency specificity of regional homogeneity in the resting-state human brain., e86818.
Sorge, R. E., & Totsch, S. K. (2017). Sex differences in pain., 1271–1281.
Van Essen, D. C., Glasser, M. F., Dierker, D. L., Harwell, J., & Coalson, T. (2012). Parcellations and hemispheric asymmetries of human cerebral cortex analyzed on surface-based atlases., 2241–2262.
Wu, C. W., Gu, H., Lu, H. B., Stein, E. A., Chen, J. H., & Yang, Y. H. (2008). Frequency specificity of functional connectivity in brain networks., 1047–1055.
Wu, Z. H., & Huang, N. E. (2009). Ensemble empirical mode decomposition: A noise-assisted data analysis method., 1–41.
Wu, Z. H., Huang, N. E., & Chen, X. Y. (2009). The multi- dimensional ensemble empirical mode decomposition method., 339–372.
Xie, H. B., & Wang, Z. Z. (2006). Mean frequency derived via Hilbert-Huang transform with application to fatigue EMG signal analysis., 114–120.
Xu, T., Yang, Z.,Jiang, L. L., Xing, X. X., Zuo, X. N. (2015). A connectome computation system for discovery science of brain., 86-95.
Yan, C. G., Cheung, B., Kelly, C., Colcombe, S., Craddock, R. C., Di Martino, A., Milham, M. P. (2013). A comprehensive assessment of regional variation in the impact of head micromovements on functional connectomics., 183–201.
Yeo, B. T. T., Krienen, F. M., Sepulcre, J., Sabuncu, M. R., Lashkari, D., Hollinshead, M., Buckner, R. L. (2011). The organization of the human cerebral cortex estimated by intrinsic functional connectivity., 1125–1165.
Zang, Y. F., He, Y., Zhu, C. Z., Cao, Q. J., Sui, M. Q., Liang, M., Wang, Y. F. (2007). Altered baseline brain activity in children with ADHD revealed by resting-state functional MRI., 83–91.
Zuo, X. N., Di Martino, A., Kelly, C., Shehzad, Z. E., Gee, D. G., Klein, D. F., Milham, M. P. (2010). The oscillating brain: Complex and reliable., 1432–1445.
Zuo, X. N., Xu, T., Jiang, L. L., Yang, Z., Cao, X. Y., He, Y., Milham, M. P. (2013). Toward reliable characterization of functional homogeneity in the human brain: Preprocessing, scan duration, imaging resolution and computational space., 374–386.
Sex differences in adaptive multi-scale functional connectivity of the human brain
DUAN Kaikai1; DONG HaoMing2,3,4,5; MIAO Liwen1; SU Xuequan6,7; XIANG Jie1; ZUO XiNian2,3,4,5,7
(1College of Computer Science and Technology, Taiyuan University of Technology, Taiyuan 030024, China) (2CAS Key Laboratory of Behavioral Science, Institute of Psychology, Beijing 100101, China) (3Department of Psychology, University of Chinese Academy of Sciences, Beijing 100049, China)(4Magnetic Resonance Imaging Research Center, Institute of Psychology, Chinese Academy of Sciences, Beijing 100101, China) (5Research Center for Lifespan Development of Mind and Brain, Institute of Psychology, Chinese Academy of Sciences, Beijing 100101, China) (6Institute of Physical Education, Guangxi Teachers Education University, Nanning 530000, China) (7Key Laboratory of Brain and Education, Guangxi Teachers Education University, Nanning 530001, China)
Recent advances on functional magnetic resonance imaging (fMRI) demonstrated sex differences in the brain function. However, no standard on fMRI signal’s frequency division limited further biologically plausible explanation of these observations. In this work, we proposed a fast-multi-dimensional ensemble empirical mode decomposition to extract their multi-scale features of fMRI signal. We found that: this method can perform adaptive frequency allocation for the resting-state fMRI signal, whereby the built multi-scale function network in the frequency brain of 0.06 ~ 0.10 Hz showed significant sex differences regarding its connectivity; males had strong functional connectivity primarily within the limbic network and ventral attention network whereas females presented their strong functional connectivity mainly related to the visual network, ventral attention network and frontoparietal control network. These findings present a new method for the analysis of functional MRI images and provided brain imaging evidence on sex differences in functional connectomics.
sex differences; functional connectivity; brain network; functional magnetic resonance imaging; low frequency characteristics
2018–01–22
* 国家自然科学基金(61503272, 61305142, 61373101)、山西省自然科学青年基金(2015021090, 201601D202042)、山西省重点研发计划项目(201603D111014)、博士后基金(2016M601287)、虚拟现实技术与系统国家重点实验室开放课题(BUAA-VR-15KF-16)和山西省回国留学人员科研资助项目(No.2016-037)资助。
左西年, E-mail: zuoxn@psych.ac.cn; 相洁, E-mail: xiangjie@tyut.edu.cn
B845
10.3724/SP.J.1042.2018.01567

