不同油脂体结构及性质的差异
周 鑫,韩宛君,李东飞,崔春利,江连洲,侯俊财*
油料作物是植物油脂和蛋白质的重要来源[1],油料加工业衔接了农业、工业与服务业的发展,一直是我国优先发展产业[2]。因此,提高植物油料产品转化率和加工利用水平,开发以植物油料油脂、蛋白质资源为基质的良好理化特性产品,对延伸农业产业链,促进农业增效,打造绿色经济具有现实意义和深远影响。
大豆、花生、葵花籽是我国主要的油料作物,也是食用油脂的主要来源[3]。大豆中含有脂肪15%~20%,其中80%为不饱和脂肪酸(unsaturated fatty acid,UFA),亚油酸质量分数高达50%,且磷脂含量丰富;大豆中含有高达40%的蛋白质,大约是其他植物的1~6 倍[4]。大豆油脂是多种保健食用油以及高级化妆品所用原料,大豆蛋白也已广泛用于儿童和保健食品等生产[5]。大豆产品与养殖、医药和食品等生产密切相关[6]。花生脂肪质量分数约为45%~60%,其UFA高达80%以上,并含有丰富的磷脂和VE[7];花生中含有24%~36%的蛋白质,氨基酸比例均衡[8]。在我国,榨油占花生总消费利用的50%~60%,而深加工用量只占10%[9]。葵花籽脂肪质量分数在45%~60%之间,UFA高达85%以上,其中油酸占38%、亚油酸占55%左右[10],VE含量比例均衡,易被人体吸收,其油脂在国际上被视为优质油脂[11]。葵花籽中含有21%~31%的蛋白质,其分离蛋白具有较好的起泡和乳化性质[12],开发潜力很大[13]。目前,葵花籽在我国主要消费方式是榨油,高附加值、深加工产品较少。
油脂体是油料作物种子中储藏脂肪的重要器官,由中性脂类、环绕中性脂的磷脂和嵌插在磷脂层中的蛋白质组成[14]。油脂体因其独特的结构和组成,且易提取、较稳定的特性,可作为天然健康的油脂-蛋白结合体应用于食品、医药、饲料以及化妆品等领域[15],也可利用油脂体蛋白质表达系统生产外源蛋白质,市场前景广阔[16]。因此,关于油脂体组成和结构分析及功能开发已成为研究焦点,但目前关于系统性地比较不同油料作物之间油脂体结构及性质差异的研究鲜有报道。且不同油料作物来源油脂体的组成、结构及理化稳定性存在差异,而这些差异会影响其功能性和利用率。基于此,本实验以大豆、花生和葵花籽源油脂体为研究对象,对其种子及油脂体的显微结构进行比较,分析了不同源油脂体性质差异,为扩大油脂体在食品工业应用提供理论基础。
1 材料与方法
1.1 材料与试剂
花生、葵花籽 市售;大豆(东农52 号)由东北农业大学大豆研究所提供;化学试剂均为分析纯。
1.2 仪器与设备
HK-02万能粉碎机 广州鸿兴机械有限公司;Zetasizer Nano ZS Zeta电位分析仪 英国马尔文公司;L8800氨基酸自动分析仪、JEM-1200EX透射电子显微镜日本日立公司;PowerpacTMBasic型电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 油脂体的制备
大豆、花生和葵花籽油脂体的提取步骤参照崔春利等[17]的方法。种子经蒸馏水浸泡约12 h后,以含0.4 mol/L蔗糖、0.5 mol/L氯化钠、0.5 mol/L Tris-HCl缓冲液为研磨介质用组织捣碎机研磨。将匀浆物过滤,获得滤液,接着以10 000 r/min离心30 min,收集上层乳状物悬浮在0.1%吐温20中,分装于离心管,等量的0.5 mol/L Tris-HCl缓冲液置于离心桶上层后离心;收集乳状物悬浮于9 mol/L尿素中,室温下在振荡器上振荡10 min后分装于离心管中离心;重复上述过程2 次,收集上层乳状物,即得到油脂体(在上述提取过程中Tris-HCl缓冲液的pH值均为7.5)。
1.3.2 透射电子显微镜观察
大豆、花生和葵花籽种子分别制作超薄切片并在2.5%戊二醛溶液(pH 6.8)中固定6~8 h,磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 7.2)冲洗后,于2%锇酸溶液中固定2 h,随后经PBS多次漂洗,丙酮梯度脱水,Epon 812环氧树脂包埋和铀、铅双重染色。采用JEM-1200EX透射电子显微镜对超薄切片进行观察。
1.3.3 油脂体光学显微观察
新鲜油脂体均匀溶解于去离子水中,取一滴乳液于载玻片上,盖上盖玻片(滤纸吸取多余乳液),在光学显微镜下用×100的油镜观察并拍照。
1.3.4 蛋白含量的测定
参照GB 5009.5—2010《食品中蛋白质的测定》中的凯氏定氮法[18]。
1.3.5 脂肪含量的测定
参照GB/T 5009.6—2003《食品中脂肪的测定》中的索氏抽提法[19],抽提溶剂为无水乙醚。
1.3.6 氨基酸含量的测定
参照GB/T 5009.124—2003《食品中氨基酸的测定》方法[20]。将油料作物种子干燥、研磨、过筛;新鲜油脂体冻干。准确称取50 mg处理样品至水解管中,加入10 mL HCl溶液(6 mol/L),N2吹1 min,封管;水解管于(110±0.5)℃烘箱中水解22~24 h,冷却至室温;水解样品过滤至50 mL容量瓶中,水解管及滤纸经纯水洗涤3 次;收集合并滤液,定容。准确量取1 mL滤液,于60 ℃条件下真空脱酸浓缩,加入等量缓冲液并均匀混合,经0.2~0.45 μm滤膜过滤至测样瓶中(500~1 000 μL)上机测试。
1.3.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
油脂体的SDS-PAGE分析参照Nikiforidis等[21]的方法,并加以改进。SDS-PAGE分离胶为13%,浓缩胶为5%。油脂体乳液(1 mg/mL)经6.25 mmol/L Tris-HCl缓冲溶液(2% SDS、10%甘油、0.1%溴苯酚蓝、5%β-巯基乙醇)处理,煮沸5 min,并进行两次冻融循环,经离心分离得到含有油脂体蛋白质(3~4 mg/mL)的下层清液,对该清液进行SDS-PAGE。电泳凝胶采用0.25%考马斯亮蓝(R250)进行染色,CH3OH/CH3COOH溶液脱色。
1.3.8 Zeta电位和平均粒径的测定
油脂体Zeta电位和平均粒径的测定参照Iwanaga等[22]的方法。1 g新鲜油脂体,均匀悬浮于39 g Tris-HCl缓冲液(10 mmol/L,pH 7.0)中,悬浮液于室温条件下存储24 h后,进行Zeta电位和平均粒径的测定。
1.3.8.1 Zeta电位的测定
将油脂体悬浮液稀释至0.005%,用Zetasizer Nano ZS Zeta电位分析仪进行Zeta电位的测定。
1.3.8.2 平均粒径的测定
油脂体悬浮液稀释至合适的浓度,采用Mastersizer 2000激光粒度仪进行平均粒径的测定。
1.3.9 乳化性质的测定
油脂体乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)的测定参照Pearce等[23]的方法并加以改进。4 mL样品稀释液与1 mL大豆油均匀混合,10 000 r/min均质1 min,分别取200 μL静置0 min及10 min时的底部乳化液,加入到10 mL 1% SDS溶液中,充分混匀,使用UV-6100紫外分光光度计于500 nm波长处测定吸光度。
EAI和ESI计算公式如下:


式中:A500nm为波长500 nm处时的吸光度;c为蛋白质量浓度/(g/mL);φ为油相所占的体积分数(φ=1/5);A10为静置10 min后乳状液吸光度;A0为静置0 min后乳状液吸光度;n为稀释倍数50 倍。
1.3.10 圆二色性(circular dichroism,CD)光谱测定
油脂体蛋白质二级结构分析参照王辰等[24]的方法,将油脂体蛋白质配制成一定质量浓度的蛋白溶液,0.25 mL SDS(1 mol/L)加入到0.5 mL蛋白溶液中,充分混合,再加入9.25 mL蒸馏水,混合均匀,同时配制空白溶液。CD光谱扫描范围为240~180 nm,温度25 ℃,速率100 nm/min,光程0.1 nm,灵敏度100 mdeg/cm。油脂体蛋白质二级结构含量参照Reed等[25]的方法进行计算。
CD光谱各峰指认依据为:α-螺旋结构在192 nm附近有一正谱带,208 nm和222 nm波长处有两个负峰;β-折叠在216 nm波长处附近有一负谱带,185~200 nm有一正谱带;β-转角在206 nm左右有一正谱带[26]。
1.4 统计分析
所有实验均平行3 次,采用SPSS Statistix 17.0软件进行数据分析,用LSD 0.05进行平均数之间显著性差异分析,P小于0.05表示差异显著,采用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 不同油料作物种子细胞微观结构
大豆、花生和葵花籽种子细胞微观结构见图1。成熟的油料作物种子细胞中含有大量灰色蛋白体和白色油脂体,小的油脂体紧密围绕在较大体积的蛋白体周围,油脂体外层清晰包裹着边界膜。大豆种子细胞中蛋白体较多、体积较大,油脂体数量多且分布均匀,直径分布在0.1~2.0 μm之间,多数呈球形或者椭球形;花生种子细胞内蛋白体相对较少,油脂体间排列相对紧密,大体积油脂体较多,直径分布在0.3~4.0 μm,且多数呈椭球形或不规则形状;葵花籽种子细胞中蛋白体积较小,油脂体分布密集,直径分布在0.3~3.0 μm,大多呈不规则状,这与Hu Zhiyong等[27]的结果相一致。

图1 大豆、花生和葵花籽种子超微结构Fig. 1 Ultrastructures of soybean, peanut, and sunflower seeds
2.2 不同油料作物油脂体离体微观结构

图2 大豆、花生和葵花籽油脂体高倍显微观察(×100)Fig. 2 Microscopic observation of soybean, peanut and sunflower oil bodies (× 100)
由图2可见,油脂体经过缓冲溶液提取后,可均匀分散于水介质中,且仍能保持结构完整性和独立性。不同油料作物来源油脂体大小差异较大,同一油料来源油脂体大小也不相同。由高倍显微镜图像可以看出,花生油脂体体积最大,大豆油脂体体积最小。研究显示,油脂体体积与油脂体膜蛋白体积的大小以及表达量相关,而油脂体膜蛋白组分的多元化可能是导致同一来源油脂体体积大小不同[28]。
2.3 不同油料作物油脂体组成成分
2.3.1 不同油料作物油脂体基本组成

表1 大豆、花生和葵花籽油脂体组成成分Table 1 Chemical compositions of soybean, peanut and sunflower oil bodies%
由表1可见,大豆油脂体蛋白质含量显著高于花生和葵花籽油脂体(P<0.05),而脂肪含量则显著低于后两者(P<0.05);大豆油脂体中蛋白质与脂肪比例(0.086∶1)显著高于花生油脂体(0.018∶1)和葵花籽油脂体(0.028∶1)(P<0.05);油脂体中蛋白质和脂肪的比例与种子中蛋白质和脂肪的比例呈正相关关系,油脂体的蛋白质含量与脂肪含量呈负相关[29];3 种油脂体的蛋白质含量均低于种子蛋白质含量,而脂肪含量则相反。说明油脂体在提取过程中,保留了种子中的大部分脂肪,而绝大部分的外源蛋白质则被去除[30]。不同油料作物油脂体的基本组成含量之间存在差异,这与油脂体种子来源中的蛋白含量有关[31]。Tzen等[14]的研究结果显示,油脂体的大小主要由三酰甘油酯与蛋白质的比例决定,油脂体蛋白(尤其是Oleosin蛋白)含量越高的物种,油脂体体积越小,与本研究结果一致。
2.3.2 不同油料作物种子及油脂体的氨基酸组成

注:疏水性氨基酸指Val、Met、Ile、Leu、Tyr、Phe和Pro的总量。同行数据肩标字母不同表示差异显著(P<0.05)。表3同。
表2显示,大豆种子中总氨基酸含量、疏水氨基酸总量以及测得的17 种氨基酸含量均显著高于花生和葵花籽种子(P<0.05);葵花籽种子中Thr、Met、Ile含量显著高于花生种子(P<0.05)。3 种油料种子中Glu含量最高,其次是Asp。大豆、花生和葵花籽种子中疏水氨基酸总量占总氨基酸百分比分别为36.76%、34.39%和36.80%。
由表3可见,除了Tyr、His和Arg以外,大豆油脂体中其余氨基酸含量、总氨基酸含量和疏水氨基酸总量均显著高于花生油脂体和葵花籽油脂体(P<0.05);葵花籽油脂体中Asp、Glu、Leu、Lys、His和Pro含量均显著高于花生油脂体(P<0.05),其他氨基酸含量间无显著性差异(P>0.05)。大豆、花生和葵花籽油脂体中含量最高的氨基酸分别为Val、Tyr和Glu。大豆油脂体中极性氨基酸Glu、Asp和Thr等含量显著高于花生油脂体和葵花籽油脂体(P<0.05),而花生油脂体中极性氨基酸含量最低。3 种油脂体中疏水性氨基酸总量占总氨基酸含量的比例分别为55.81%、64.29%和52.23%。大豆油脂体中Glu、Asp和Thr以及疏水氨基酸总量均显著高于花生油脂体和葵花籽油脂体(P<0.05)。
3 种油料作物油脂体中氨基酸总量均远低于种子中氨基酸总量,且大豆油脂体中Glu、Asp和Thr酸以及疏水氨基酸总量均显著高于花生和葵花籽油脂体(P<0.05),这与其含有较高含量的蛋白质有关。

注:疏水性氨基酸指Val、Met、Ile、Leu、Tyr、Phe和Pro的总量。同行肩标字母不同表示差异显著(P<0.05)。
2.4 不同油料作物油脂体SDS-PAGE图谱
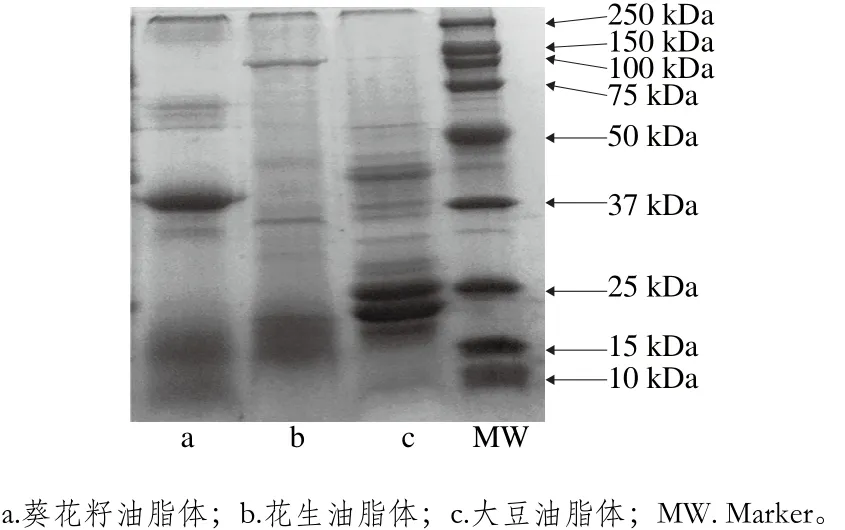
图3 大豆、花生和葵花籽油脂体蛋白SDS-PAGE图谱Fig. 3 SDS-PAGE profiles of proteins in soybean, peanut and sunflower oil bodies
由图3可见,3 种油脂体蛋白质组成存在差异,大豆和葵花籽油脂体蛋白质均存在多条谱带。大豆油脂体蛋白质分子质量主要分布在15~30 kDa和35~50 kDa之间,花生油脂体蛋白质分子质量大多分布在15~25 kDa和30~37 kDa之间,葵花籽油脂体蛋白质分子质量主要分布于15~25、35~45 kDa以及50~75 kDa之间。大豆油脂体蛋白质中Oleosin蛋白分子质量大约在17、18 kDa和24 kDa左右,花生和葵花籽油脂体蛋白质只含有17 kDa和18 kDa Oleosin蛋白,大豆油脂体蛋白质中Oleosin含量明显高于花生和葵花籽油脂体蛋白质;大豆和葵花籽油脂体中均含有Caleosin蛋白(25~35 kDa)和Steroleosin 蛋白(39~41 kDa),而花生油脂体在39~41 kDa之间并未出现明显条带图谱。此外,大豆和葵花籽油脂体中携带的贮存蛋白较多。
油脂体表面的镶嵌蛋白主要分为3 类:Oleosin蛋白(15~26 kDa)、Caleosin蛋白(27 kDa)和Steroleosin族蛋白(39~41 kDa),高于41 kDa的蛋白质一般为外源蛋白质(即贮存蛋白)[32]。本研究SDS-PAGE图谱显示,大豆、花生和葵花籽油脂体中均含有Oleosin蛋白,且大豆油脂体蛋白质中Oleosin含量显著高于花生和葵花籽油脂体蛋白质(P<0.05);大豆和葵花籽油脂体中还含有Caleosin蛋白和Steroleosin蛋白,而花生油脂体电泳图谱中并未出现明显的Steroleosin蛋白条带;3 种油脂体中均存在贮存蛋白质;花生油脂体更为纯净。Nikiforidis等[33]的研究结果表明,油脂体在提取过程中不仅含其自身结构油脂体蛋白质,而且还携带有多种外源性蛋白质,而外源蛋白质的存在,同样影响其稳定性[34]。油脂体在提取及清洗过程中,不同来源蛋白质受提取条件及清洗剂的影响不同,且油脂体携带的外源蛋白质因其来源不同而有差异,这是导致3 种油脂体中蛋白组成差异的主要原因。
2.5 不同油料作物油脂体Zeta电位和粒径分布

图4 大豆、花生和葵花籽油脂体Zeta电位Fig. 4 Zeta potential of soybean, peanut and sunflower oil bodies
由图4可见,大豆油脂体的Zeta电位为(-36.53±0.57)mV,显著高于花生油脂体(-26.6±0.66)mV和葵花籽油脂体(-34.5±1.09)mV(P<0.05)。Zeta电位可以反映乳液体系中乳滴的表面电荷和乳滴之间相互作用力的大小,Zeta电位(正或负)越高,体系越稳定,乳滴之间越不易凝结或聚集[35]。油脂体中的Oleosin蛋白带正电的区域与带负电的磷脂及游离脂肪酸通过盐桥相连,而负电基团则裸露在油脂体表面,因此油脂体整体带负电[14]。在中性环境下,大豆油脂体的Zeta电位显著高于花生和葵花籽油脂体(P<0.05)。不同油料作物来源的油脂体表面蛋白质种类和含量有差异,且氨基酸组成也不相同,这可能是导致3 种油料作物油脂体表面电荷量差别较大的主要原因[36]。

图5 大豆、花生和葵花籽油脂体粒径分布Fig. 5 Particle-size distribution profiles of soybean, peanut and sunflower oil bodies
油脂体粒径分布见图5,3 种油脂体粒径均呈单峰分布状态。大豆油脂体的粒径多分布在0.3~2.3 μm,体积平均粒径D[4,3]为0.93 μm;花生油脂体的粒径分布相对较宽,多集中在0.6~6.3 μm,D[4,3]为2.58 μm;葵花籽油脂体的粒径分布多集中于0.4~3.27 μm,D[4,3]为1.64 μm。3 种油脂体在离体条件下的粒径大于其在种子细胞内的粒径。
2.6 不同油料作物油脂体乳化性质
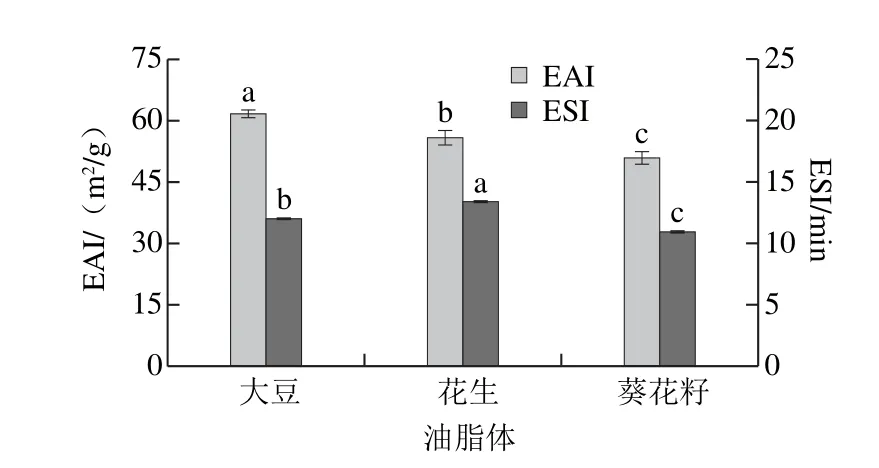
图6 大豆、花生和葵花籽油脂体EAI及ESIFig. 6 EAI and ESI of soybean, peanut and sunflower oil bodies
由图6可见,大豆、花生和葵花籽油脂体的EAI分别为(61.59±1.11)、(55.77±1.83)m2/g和(50.86±1.61)m2/g。其中,大豆油脂体的EAI显著高于花生和葵花籽油脂体(P<0.05),而花生油脂体的ESI(13.39±0.04)min)则显著高于大豆和葵花籽油脂体((12.00±0.09)min和(10.93±0.08) min)(P<0.05),葵花籽油脂体的EAI和ESI均最低。
3 种油脂体中,大豆油脂体的EAI最高,可能是由于大豆油脂体中较高的蛋白含量和疏水性氨基酸总量增加了油脂体的界面膜厚度,提高了界面强度[24],使得单位质量的大豆油脂体能够乳化更多体积的油脂。花生油脂体具有较好的ESI可能是由油脂体蛋白质的结构和分子内无序结构含量不同、舒展状态一致、疏水区域裸露情况有差异导致的。油脂体蛋白质分子中无序结构越多,吸附在油脂体表面的疏水基团就越多,这在一定程度上能够维持其ESI[37]。
2.7 不同油料作物油脂体蛋白质CD光谱分析
本实验采用240~180 nm远紫外光谱测定油脂体蛋白质的CD谱,结果如图7所示。在测定波长区域内,3 种油料作物油脂体均在波长190~200 nm之间出现正谱带,在193 nm附近出现正峰,而在208 nm和222 nm附近出现单一负峰。

图7 大豆、花生和葵花籽油脂体蛋白质CD光谱Fig. 7 CD spectra of proteins in soybean, peanut and sunflower oil bodies
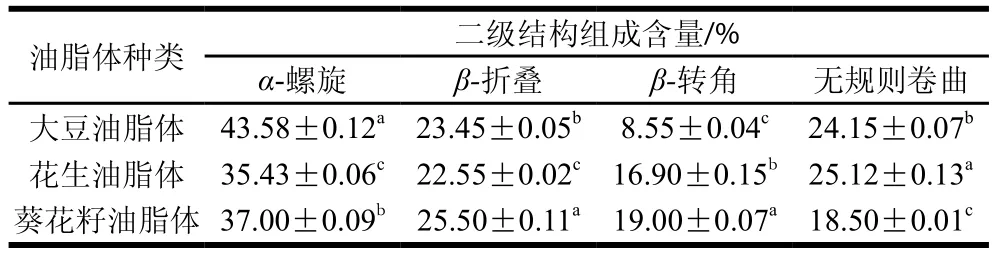
表4 大豆、花生和葵花籽油脂体蛋白质二级结构组成Table 4 Secondary structure composition of proteins in soybean,peanut and sunflower oil bodies
由表4可知,大豆油脂体蛋白质α-螺旋结构含量为(43.58±0.12)%,显著高于花生(35.43±0.06)%和葵花籽油脂体蛋白质(37.00±0.09)%(P<0.05);花生油脂体蛋白质的无规则卷曲含量显著高于大豆和葵花籽油脂体蛋白质(P<0.05);而葵花籽油脂体β-折叠((25.50±0.11)%)和β-转角结构含量((19.00±0.07)%)均显著高于大豆(23.45±0.05)%、(8.55±0.04)%和花生油脂体蛋白质((22.55±0.02)%、(16.90±0.15)%)(P<0.05)。3 种油料作物油脂体蛋白质二级结构间存在差异,但均以α-螺旋结构含量为最高。与Tzen等[38]油脂体蛋白质组成及结构的研究结果一致。大豆油脂体中α-螺旋结构含量显著高于花生和葵花籽油脂体(P<0.05),花生油脂体中蛋白质的无规则卷曲含量显著高于大豆和葵花籽油脂体蛋白质(P<0.05)。这说明,大豆油脂体蛋白质的分子结构更为紧密,而花生油脂体蛋白质的分子结构相对疏松,肽链更加舒展,这有利于其内部疏水基团的暴露及表面蛋白膜的形成[39],这可能是花生油脂体ESI较高的原因之一。
3 结 论
本实验结果表明,不同油料作物来源油脂体具有相似的组成和结构;大豆油脂体中蛋白质和脂肪比例(0.086∶1)显著高于花生(0.018∶1)和葵花籽油脂体(0.028∶1)(P<0.05),而平均粒径((0.93±0.07) μm)却显著低于花生((2.58±0.06)μm)和葵花籽油脂体((1.64±0.03)μm)(P<0.05);大豆油脂体疏水氨基酸总量最高,花生油脂体疏水氨基酸总量最低大豆油脂体Zeta电位、乳化稳定性以及EAI均显著高于花生和葵花籽油脂体(P<0.05);大豆油脂体蛋白质α-螺旋结构含量((43.58±0.12)%)显著高于花生((35.43±0.06)%)和葵花籽油脂体蛋白质((37.00%±0.09)%)(P<0.05);而花生油脂体蛋白质的β-折叠和无规则卷曲含量最高。本研究比较了大豆、花生和葵花籽种子及油脂体组成成分的差异和油脂体的性质,为其在以后的加工生产中提供了理论支持。

