铜绿假单胞菌对龙葵中Cd的亚细胞分布和化学形态的影响
张海利,王 涛,邹路易,郁红艳,顾文秀,滕 跃*
(1.江南大学环境与土木工程学院,江苏 无锡 214122;2.江南大学化学与材料工程学院,江苏 无锡 214122)
Cd污染主要来自于人类的农业和工业活动,如废水灌溉、金属矿石的开采和冶炼等[1]。由于Cd具有生物毒性强、分布范围广、不能被生物降解且迁移性强等特点,使其易被植物吸收并积累,从而通过食物链富集,危害人类健康[2]。因此,Cd污染及其修复技术得到全球越来越多的关注[3]。
植物修复是一种成本低、环保的污染土壤修复技术,主要应用超积累植物修复受污染土壤。现已发现大量植物物种可超量积累重金属[4-5],但植物修复在实践过程中仍存在局限性,其修复效率受多种因素的影响,如植物生长缓慢、生物量小、对重金属的耐受性有限等[6],而使用植物-微生物联合修复重金属污染土壤,是提高植物修复效率的有效方法[7-8]。
铜绿假单胞菌是一种具有金属抗性的菌种,Zhang等[9]从煤矿区的污染土壤中分离出两株铜绿假单胞菌菌株ZGKD5和ZGKD2,均对Cd、Cu、Zn、Ni和Pb表现出高耐受性。且大量研究表明,在植物修复盆栽实验中,铜绿假单胞菌可促进植物生长,提高Cd积累量。例如,Liang等[10]的研究中,接种从重金属污染的污泥中分离的铜绿假单胞菌显著增强紫堇的Cd积累;Xie等[11]研究表明,接种铜绿假单胞菌ATCC 9027可缓解Cd的毒性,促进苎麻生长,并提高Cd积累;Biswas等[12]研究表明,从废水中筛选出的铜绿假单胞菌KUJM具有多重重金属抗性潜力,并促进扁豆种子生长,具有用于污染土壤植物修复的潜能。关于铜绿假单胞菌的研究均处于对植物生长和积累总量的水平,而铜绿假单胞菌如何影响植物重金属积累和分布的其他方面仍不确定。
Cd超积累植物龙葵生长周期短、生物量大,且已被证明其耐受并吸收土壤中Cd[13],具有良好的应用前景[14-16]。研究表明,植物的金属耐受性和解毒机制可通过亚细胞分布限制毒素或改变其化学结构实现[17-19]。然而,铜绿假单胞菌对龙葵中Cd积累和分布的影响尚无报道。本研究以龙葵和从Cd污染土壤筛选出的铜绿假单胞菌为研究材料,采用差速离心法和化学试剂逐步提取法,通过研究龙葵各部位中Cd的积累、亚细胞分布和化学形态,来分析铜绿假单胞菌对其的影响,探讨铜绿假单胞菌作用下龙葵对Cd的耐受机制,期望为龙葵在植物修复中的应用提供理论参考。
1 材料与方法
1.1 供试材料
盆栽实验用土取自江苏省江阴市农田土,风干后过2 mm筛。土壤理化性质:pH 5.59,总氮 1 g·kg-1,有机质 27.35 g·kg-1,速效磷 18.81 mg·kg-1,速效钾75.46 mg·kg-1,Cd 2.64 mg·kg-1。
供试菌株为课题组从Cd污染土壤中已筛选出的Cd耐受性细菌,利用BLAST软件将测得Cd耐受细菌基因序列与GenBank上相关的16S rDNA序列进行同源性比较,得出此菌与Pseudomonas aeruginosa铜绿假单胞菌同源性为99%。
1.2 实验设置与处理
盆栽实验土壤的Cd含量设4个水平分别为0、25、50、100 mg·kg-1,不同Cd浓度的土壤分为接种和不接种铜绿假单胞菌两种情况,共8个处理,每个处理3次重复。Cd以CdCl2溶液的形式加入已过筛的土壤中充分搅拌,稳定2周后进行高温灭菌(121℃,30 min)处理。将灭菌后的土壤装入塑料盆(直径18 cm,高11.5 cm)中,每盆均装土2 kg。挑选优良的龙葵种子于70%的乙醇中浸泡30 min,无菌蒸馏水清洗3次,再于2%的NaClO2溶液中浸泡10 min后用蒸馏水洗净,表面灭菌后种植盆中。接种组每周以细菌悬浮液的形式接种铜绿假单胞菌。将培养于LB固体培养基中的铜绿假单胞菌转移至盛有50 mL的LB液体培养基的锥形瓶中,于恒温振荡器(150 r·min-1,37 ℃)中振荡48 h,富集后离心(6000 r·min-1,4 ℃)10 min收集细菌细胞,再用生理盐水洗涤两次获得OD600值近似为0.6的接种物(约108CFU·mL-1),每盆接种5 mL做接种处理[11,20]。所有实验均在自然光照的温室中进行,60 d后收获植物,自来水冲洗后,去离子水洗净,吸干表面水分。
1.3 植物亚细胞组分的分离
植物亚细胞组分的分离采用差速离心法,参考Weigel等[21]的方法,并略加改动。称取根、叶鲜样各0.2 g,加入 20 mL 预冷提取液[Tris-HCl(pH 7.5)50 mmol·L-1,蔗糖 250 mmol·L-1,DTT 1 mmol·L-1],研磨匀浆后3000×g下离心15 min,沉淀为细胞壁组分(F1);取上清液在12 000×g下离心30 min,沉淀为细胞器组分(F2);上清液即为细胞可溶组分(F3)。全部操作在4℃下进行。
1.4 植物Cd化学形态提取
植株Cd的化学形态分析采用化学试剂逐步提取法。准确称取根、叶鲜样0.2 g,加入20 mL提取液研磨匀浆后转入50 mL锥形瓶中,25℃恒温振荡22 h后,在5000×g下离心10 min,倒出上清液,再加入20 mL提取液,25℃恒温振荡2 h,在5000×g下离心10 min,倒出上清液,合并两次上清液得该提取态组分样品。沉淀加入下一种提取液进行下一轮的提取。5种提取液依次为:(1)80% 乙醇(FⅠ),提取硝酸盐/亚硝酸盐,氯化物和氨基苯酚镉等无机Cd;(2)去离子水(FⅡ),提取水溶性Cd,Cd-有机酸络合物和Cd(H2PO4)2;(3)1 mol·L-1NaCl溶液(FⅢ),提取果胶和蛋白质结合的Cd;(4)2% 醋酸(FⅣ),提取未溶解的镉磷酸盐,包括CdHPO4和Cd3(PO4)2;(5)0.6 mol·L-1盐酸(FⅤ),提取草酸镉;最后为残留态(FⅥ)[22]。
1.5 Cd含量测定
将差速离心法和化学试剂逐步提取法分离得到的沉淀和上清液分别在电热板上70℃加热至近干,加入10 mL HNO3消煮至澄清,去离子水定容后使用ICP测定[23]。所有数据均使用SPSS 19进行单因素方差分析,使用Duncan新复极差法(SSR)在显著水平小于0.05时作多重比较分析,使用Origin 8软件绘图。
2 结果与分析
2.1 龙葵对Cd的富集与特征
由表1可知,在未接种处理中,植株各部Cd含量均随土壤中Cd浓度的增加而呈上升趋势。植株茎和叶中富集的Cd含量随土壤中Cd浓度的增加呈线性上升趋势,两者的富集能力并无下降或趋于饱和的现象。而龙葵根部在中低Cd浓度处理(0~50 mg·kg-1)时上升较快,在高Cd浓度处理(100 mg·kg-1)时趋于平缓。同时随着土壤中Cd浓度增加,根-茎的转运系数逐渐增加,而茎-叶的转运系数逐渐降低。
接种铜绿假单胞菌可以促进Cd更多地向叶转移。随着土壤中Cd浓度的增加,接种处理的龙葵叶中Cd含量为未接种的1.14~1.60倍。除土壤Cd浓度为50 mg·kg-1外,根的Cd含量较未接种处理降低8.23%~23.82%。在低Cd浓度(0~25 mg·kg-1)中,接种处理增加茎中Cd含量,而中高Cd浓度(50~100 mg·kg-1)中,接种处理减少茎中的Cd含量。同时随土壤Cd浓度增加,接种处理的根-茎转运系数为未接种处理的1.13~1.22倍,茎-叶转运系数为未接种的1.02~1.68倍。即接种铜绿假单胞菌可以促进植株内Cd向叶的转移,使得龙葵叶中对Cd的富集能力加强。
2.2 龙葵中Cd的亚细胞分布
由表2可知,各亚细胞组分的Cd含量随着土壤中重金属浓度的增加而增加,且大多数Cd存在于细胞壁和可溶性组分中。龙葵根部各亚细胞组分Cd的分配比例为F1>F3>F2,即根中Cd主要分布于F1(细胞壁)中,且在高浓度(100 mg·kg-1)下,接种处理的根部F1组分中Cd的分配比例为未接种的1.42倍。同时随着土壤中Cd浓度的增加,接种处理的根部F2组分(细胞器组分)中Cd的分配比例较未接种减少4.37%~27.85%。叶的亚细胞组分中Cd的分配比例为F3>F1>F2,即叶中Cd主要分布于F3(可溶组分)中,且接种处理可显著增加可溶组分中Cd的含量。同时与根部类似,接种处理中叶的F2组分(细胞器组分)Cd的分配比例较未接种减少12.90%~45.74%。
2.3 龙葵中Cd的化学形态分布
由图1可知,龙葵根部Cd的化学形态分布受到土壤中Cd浓度的影响,且以醋酸、盐酸提取态和残留态Cd为主导。而醋酸、盐酸提取态和残留态Cd对植物没有或基本没有毒害作用,是不活跃的化学形态。由图2可以看出,土壤中Cd浓度为中低浓度(0~50 mg·kg-1)时,接种处理增加各提取态Cd的含量;土壤Cd为高浓度(100 mg·kg-1)时,接种处理使根中各化学形态Cd含量急剧降低,并低于未接种处理(FⅢ除外)。
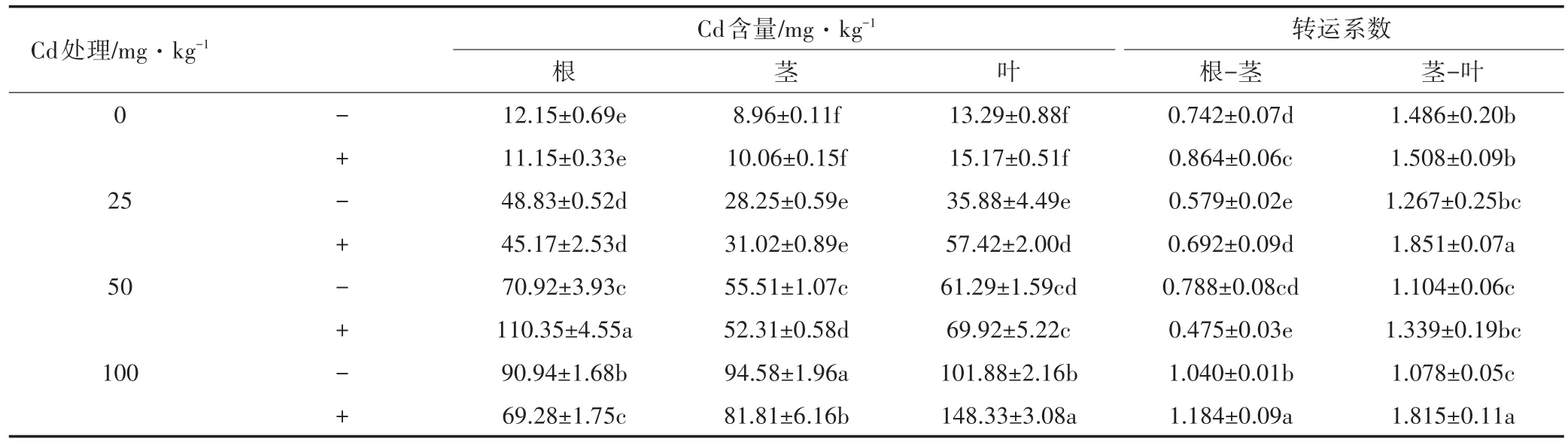
表1 龙葵根、茎、叶中的Cd含量Table 1 The content of Cd in roots,stems and leaves of Solanum nigrum

表2 Cd在龙葵根、叶中的亚细胞分布Table 2 Subcellular distribution of Cd in roots and leaves of Solanum nigrum

图1 龙葵根系中各提取态Cd含量分配比例Figure 1 The percentage of each extractable forms of Cd in roots of Solanum nigrum
由图3、图4可知,随着土壤中Cd浓度的增加,叶中各化学形态Cd含量呈增加趋势,且以活跃态(乙醇、去离子水和氯化钠提取态)Cd为主导。通过接种处理,非活跃态(醋酸、盐酸提取态和残留态)Cd在叶中分配比例较未接种呈增加趋势。且叶中较活跃的氯化钠提取态Cd分配比例较未接种减少20.17%~26.19%,活性较低的醋酸提取态Cd分配比例较未接种基本呈增加趋势。即接种处理可促进叶中Cd由活跃态向非活跃态的转移。
3 讨论
植物吸收何种化学形式的金属以及植物如何将其分布到各组分中是影响重金属污染土壤植物修复效果的重要因素之一。因此我们通过盆栽实验,研究铜绿假单胞菌对超积累植物龙葵中Cd的亚细胞分布和化学形态的影响。
研究表明,在Cd胁迫下,接种处理增加龙葵叶中的Cd含量,且龙葵根-茎、茎-叶的转运系数为未接种的1.02~1.68倍和1.13~1.22倍,促进植株中Cd由根部向地上部分的转移。转运系数是评估超积累植物从土壤中摄取金属和将其从根部向地上转移能力的重要参数。可以看出,接种铜绿假单胞菌促进了龙葵Cd的转移过程,有助于减少根中Cd的积累量,从而减少重金属对根部的抑制作用,促使土壤中更多Cd被龙葵摄取,这与Shi等[24]的报道一致。

图2 龙葵根部各提取态Cd含量Figure 2 The content of each extractable forms of Cd in roots of Solanum nigrum
龙葵对Cd的耐受性受其在植株中分布情况的影响。研究表明,Cd胁迫下,龙葵各部的Cd主要分布在细胞壁和可溶组分中。本研究中龙葵根部各亚细胞组分Cd含量的分配比例为F1>F3>F2,其中F1(细胞壁)组分的Cd比例最高为58.31%,同时在高Cd浓度(100 mg·kg-1)下,接种处理中根部细胞壁组分的Cd比例较未接种提高42.22%。因此,高Cd胁迫下,细胞壁的保护作用显著。细胞壁是保护原生质体免受重金属毒性的第一道屏障,主要由纤维素、半纤维素、果胶和蛋白质组成,表面倾向于带负电[25],是重金属螯合的有效点位。而将Cd隔离于细胞壁中是植物耐受Cd的机制之一[26]。据报道,微生物的接种可以影响植物中Cd的亚细胞分布,如Wang等[27]的研究表明,与未处理的植物相比,接种Arbuscular Mycorrhizal增加了根细胞壁中37.2%~80.5%的Cd,且细胞器中的Cd水平降低,与我们的研究结果相似。接种处理促进龙葵根中吸收的Cd更多地滞留在细胞壁上,进入原生质体的Cd又大多被主要由液泡组成的可溶性组分区隔化,从而细胞器组分的Cd比例较未接种降低,最高达27.85%。这减少了Cd对细胞的毒害作用,提高了龙葵对Cd的耐性。因此推测Cd胁迫下,接种铜绿假单胞菌可强化龙葵根中细胞壁的滞留作用,将Cd更多地存储在植株生物活性较低的场所,从而达到对植株的保护。

图3 龙葵叶片中各提取态Cd含量分配比例Figure 3 The precentage of each extractable forms of Cd in leaves of Solanum nigrum

图4 龙葵叶片中各提取态Cd含量Figure 4 The content of each extractable forms of Cd in leaves of Solanum nigrum
不同化学形态的Cd具有不同的毒性程度和迁移能力,以乙醇、去离子水和氯化钠提取的Cd具有较高的迁移能力并且对植物细胞的毒性高于醋酸、盐酸提取态和残留态的Cd[27]。本研究中,龙葵根部Cd化学形态分布以低活性态(醋酸、盐酸提取态和残留态)为主导,且土壤中Cd处于高浓度(100 mg·kg-1)时,接种铜绿假单胞菌使根中各化学形态Cd含量急剧降低,而叶中Cd含量显著增高。由此可进一步验证接种可促进Cd由根向叶的转移,提高龙葵对Cd的耐受性。
叶中各亚细胞组分Cd的分配比例为F3>F1>F2,其中F3组分(可溶组分)的Cd比例最高为73.01%。接种铜绿假单胞菌可增强叶中可溶组分的Cd含量,可溶组分主要由液泡组成,液泡已被认为是重金属积累的主要场所[26],这种植物将吸收的Cd隔离于液泡中的过程称为液泡区室化。因此可以认为液泡区室化在龙葵叶对Cd的解毒机制中占有重要地位,且接种处理可促进龙葵叶的液泡区室化作用。Wang等[27]的研究中,接种AM真菌处理的紫花苜宿在叶的可溶组分中积累更多的Cd,同我们的研究结果类似。同时,接种处理通过将Cd转化为低活性形态,提高龙葵叶对Cd的耐受性,与Li等[28]的研究结果相似。在Cd胁迫下,接种处理增加植株叶中低活性形态(醋酸、盐酸提取态和残留态)Cd的比例,并且降低活性较高的氯化钠提取态的Cd比例。这说明Cd胁迫下,接种铜绿假单胞菌可以促使进入龙葵叶的Cd由结合态更多地向活性更低且难溶于水的磷酸盐、草酸镉和残渣态转化,降低叶中Cd的毒性和迁移能力,从而减轻Cd对植物的毒害。
4 结论
接种铜绿假单胞菌提高了龙葵地上部分的Cd含量,促进了Cd由根部向地上部分的转移,增加了根中细胞壁组分和叶中可溶组分的Cd含量,同时降低根和叶中细胞器组分的Cd比例。此外,接种铜绿假单胞菌增加了叶中低活性形态Cd的比例。综上所述,本研究表明,接种铜绿假单胞菌可通过改变Cd在植株中的分布和形态比例,促进根的细胞壁滞留作用和叶的液泡区室化作用,促进叶中Cd向活性更低的形态转变,从而加强龙葵对Cd的耐受性。

