ApoJ基因修饰的BMSCs移植对脑出血大鼠C3表达的影响
刘茂春,刘 亮,普 娟,陈 慧,徐 斌,刘学良,郑晓梅
脑出血(intracerebral hemorrhage,ICH)是指原发性非外伤性脑实质出血,是急性脑血管病中的危重类型,严重威胁着人类的健康,且至今缺乏决定性的治疗策略,目前对脑出血治疗的探索仍是研究的热点与难点[1]。研究[2]表明继发性脑损伤是ICH后神经损伤的主要原因,而补体级联反应在其中发挥着重要作用。近年来,细胞移植和基因疗法给脑出血的治疗带来了新的希望。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是干细胞移植治疗脑出血的理想细胞供体和转基因细胞载体[3]。近来,载脂蛋白J(apolipoprotein J,ApoJ)在多种中枢神经系统疾病中的神经保护作用逐渐引起大家的重视[4],但目前国内外关于ApoJ在脑出血方面的研究并不多。ApoJ具有确切的补体调节功能,它能否通过抑制脑出血后的补体激活发挥神经保护作用,是本研究的出发点。
本课题组前期实验成功利用脂质体介导重组pEGFP-N1-ApoJ质粒转染大鼠BMSCs,经免疫细胞化学法、RT-PCR和Western blot等技术证实转染后的BMSCs能够稳定大量表达ApoJ蛋白[5-8];并将转染细胞移植入大鼠脑出血部位,通过Western blot检测发现转染细胞能够在ICH大鼠脑组织内表达ApoJ蛋白[9],证实转染后的BMSCs具有活性。在前期研究的基础上,该实验利用ApoJ基因修饰的BMSCs干预大鼠ICH模型,通过免疫组化和RT-PCR法检测补体C3的表达,旨在探讨ApoJ对脑出血大鼠的神经保护作用机制。
1 材料与方法
1.1实验动物与主要试剂6~8周龄SPF级雄性SD大鼠73只(1只细胞培养,72只造模),体质量250 g左右,购自西南医科大学实验动物中心。α-MEM 培养基(美国HyClone公司),胎牛血清(美国Gibco公司),重组质粒pEGFP-N1-ApoJ(上海生博生物医药科技有限公司),脂质体LipofectaminTM2000及TRIzol Reagent试剂盒(美国Invitrogen 公司),PrimeScriptTMRT reagent Kit with gDNA Eraser及SYBR® Premix Ex TaqTM试剂盒(北京TaKaRa 公司),兔抗大鼠C3多克隆抗体(武汉博士德公司),HRP标记山羊抗兔IgG(武汉阿斯本生物技术有限公司),DAB显色试剂盒(北京中杉金桥生物技术有限公司)。
1.2实验方法
1.2.1BMSCs的分离和培养 颈椎脱臼处死大鼠,75%乙醇浸泡5 min,无菌分离股骨和胫骨,去两端骨骺,用注射器吸取α-MEM培养基反复冲洗骨髓腔,冲洗液1 000 r /min 离心5 min,弃上清液,用含10%胎牛血清的新鲜α-MEM培养基重悬细胞,接种于培养瓶,于37 ℃、5% CO2饱和湿度孵育箱中培养,24 h首次半量换液,72 h全量换液,以后每3 d换液1次。每日于倒置显微镜下观察贴壁细胞形态及生长状况,当细胞增殖达80%~90%融合时,按1 ∶3比例传代培养。
1.2.2重组质粒转染BMSCs及转染效果的评价 将生长良好的第3代BMSCs以(4~5)×106/个接种至6孔板,待细胞70%~80%融合时,按参考文献[6]的转染方法,用3 μl脂质体LipofectaminTM2000介导1.6 μg重组pEGFP-N1-ApoJ质粒瞬时转染BMSCs。转染后24、48、72 h分别在荧光显微镜下观察细胞的绿色荧光蛋白表达情况,并选择10个荧光分布均匀的视野,计算转染效率,转染率=10个视野转染阳性细胞数之和/10个视野细胞总数。收集转染效率最高的细胞悬液,行流式分选后,调整细胞浓度为2×107个/ml备用。
1.2.3大鼠ICH模型的建立 腹腔注射3%水合氯醛(0.3 ml/100 g)麻醉大鼠,俯卧位固定于脑立体定位仪上,定位右侧尾状核(以前囟为中心,向后0.2 mm,右侧旁开3 mm,深6 mm),钻孔,断尾取血,采用经典的“改良二次注血法”注血,第一次匀速注血20 μl(耗时2 min,留针7 min),第二次注血30 μl(耗时4 min,留针10 min),然后缓慢拔针,缝合切口。造模后2 h用改良神经功能评分法(modified neurological severity score,mNSS)对大鼠进行神经缺失评分,8分以上视为造模成功。
1.2.4实验分组与细胞移植 造模后24 h,将72只ICH大鼠随机分为3组:ApoJ/BMSCs组、BMSCs组和NS组,每组24只。3组分别移植30 μl ApoJ基因修饰的BMSCs悬液(6×105个)、BMSCs悬液(6×105个)和生理盐水至脑出血部位(方法:再次麻醉、固定大鼠,原骨孔处垂直进针,分别在进入5、6、7 mm时各缓慢匀速推入细胞悬液10 μl,留针10 min后缓慢拔针,缝合皮肤)。各组再根据移植后再喂养时间不同,分为1、3、5、7 d 4个亚组,每亚组6只。
1.2.5组织取材 相应时间点腹腔麻醉各亚组大鼠,直接断头取脑,用于免疫组织化学染色的脑组织标本用4%多聚甲醛固定,然后常规脱水、透明、石蜡包埋、切片(片厚5 μm);用于RT-PCR检测的组织标本放入-80 ℃冰箱保存备用。
1.2.6免疫组织化学染色 切片脱蜡至水,1 mmol/L EDTA缓冲液中微波加热行抗原修复,3% H2O2室温孵育10 min(以清除内源性过氧化物酶活性),5% BSA封闭20 min,滴加一抗 (兔抗大鼠C3多克隆抗体,1 ∶150) 4 ℃过夜,加二抗 (HRP标记山羊抗兔IgG,1 ∶200)37 ℃孵育50 min,以上各步骤结束时均用PBS洗3次,每次5 min;然后加DAB溶液显色10 min,最后苏木精复染,梯度酒精脱水干燥,二甲苯透明,中性树胶封片。在Olympus光学显微镜下观察,胞质或胞核呈棕黄色者为阳性细胞,并应用 Image Pro Plus 6.0专业图像分析软件测量C3的累积光密度值(IOD),从而对C3蛋白的表达进行半定量分析。
1.2.7荧光实时定量PCR 取血肿周围脑组织约100 mg,利用TRIzol试剂提取总RNA;取10 μl RNA按PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒说明书进行反转录合成第一链cDNA;采用SYBR® Premix Ex TaqTM试剂盒进行PCR 扩增,反应体系为:2×qPCR Mix 5.0 μl、引物工作液1.0 μl、cDNA模板1.0 μl、ddH2O 2.8 μl、Rox 0.2 μl,反应条件为:预变性 95 ℃ 1 min,变性95 ℃ 15 s、退火58 ℃ 20 s、延伸72 ℃ 45 s,循环40次;熔解曲线60 ℃→95 ℃,每20 s升温1 ℃。每个样品均作3个复孔,同时扩增GAPDH作内参。用ΔΔCT法计算补体C3 mRNA 的表达量。引物由武汉金开瑞生物工程有限公司设计与合成,引物序列如表1。

表1 GAPDH、C3引物序列

2 结果
2.1BMSCs分离及形态学观察骨髓细胞初始分离时,悬浮于培养液中,呈圆形或椭圆形,大小不一。原代培养24 h换液后可见细胞基本贴壁,呈圆形、短梭形或多角形等多种形态(图1)。之后3~5 d圆形细胞明显减少,梭形细胞为主,呈放射状排列的细胞集落并互相融合。第6天梭形细胞集落增多,细胞融合达90%以上,呈旋涡状排列(图2)。经多次换液和传代,细胞不断纯化,传至第3代时,可得到纯度高、形态均一、生长良好的BMSCs(图3)。
2.2转染后荧光观察及转染效率的测定转染后随时间的延长,表达绿色荧光蛋白的阳性细胞逐渐增多,72 h时绿色荧光表达最强(图3、4),转染效率最高,约36%左右。
2.3免疫组化结果各组各时间点脑出血灶周边区都可见补体C3蛋白表达,C3主要表达于神经元、神经胶质细胞、血管内皮细胞及中性粒细胞的胞质。ApoJ/BMSCs组和BMSCs组在1、3、5、7 d随时间的延长,C3蛋白的表达逐渐降低,其中ApoJ/BMSCs组各时间点C3蛋白的表达低于同时间点BMSCs组和NS组,BMSCs组又低于同时间点NS组,差异均有统计学意义(P<0.05)(表2、图5)。

表2 各组不同时间点C3蛋白的表达变化
与BMSCs组比较:*P<0.05;与NS组比较:#P<0.05

图1 BMSCs原代培养第1天 ×200 图2 BMSCs原代培养第6天 ×40 图3 第3代BMSCs ×100 图4 第3代BMSCs转染72 h ×100
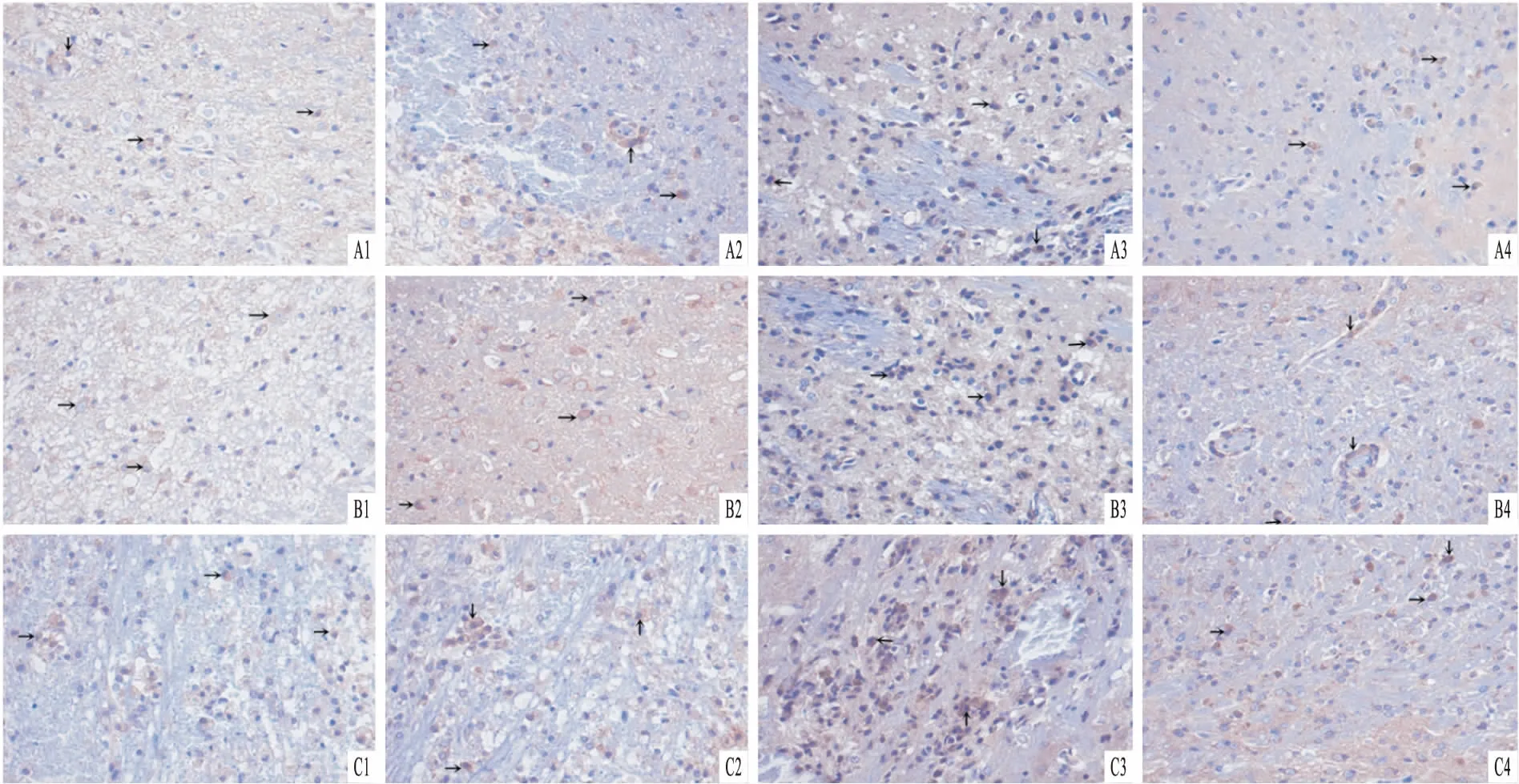
图5 C3在各组脑组织中的表达情况 ×200A:ApoJ/BMSCs组;B:BMSCs组;C:NS组;1:1 d;2:3 d;3:5 d;4:7 d

表3 各组补体C3的mRNA表达
与BMSCs组比较:*P<0.05;与NS组比较:#P<0.05
2.4PCR结果随时间的延长,ApoJ/BMSCs组和BMSCs组补体 C3 mRNA 的表达逐渐降低,其中ApoJ/BMSCs组各时间点C3 mRNA的表达明显低于同时间点BMSCs组和NS组,BMSCs组又低于同时间点NS组,差异有统计学意义(P<0.05),见表3、图6。各组补体C3和内参GAPDH的mRNA 表达扩增图谱,见图7。
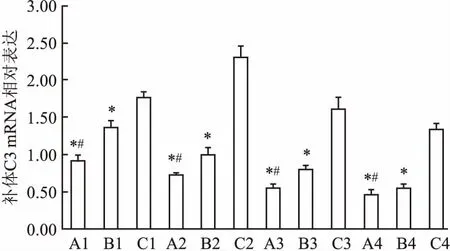
图6 各组补体C3 mRNA 的相对表达水平A:ApoJ/BMSCs组;B:BMSCs组;C:NS组;1:1 d;2:3 d;3:5 d;4:7 d;与NS组比较:*P<0.001; 与BMSCs组比较:#P<0.001
3 讨论
载脂蛋白J是一种广泛存在于各种组织和体液中的多功能糖蛋白,具有众多生物学功能,主要包括:转运脂质、抗动脉粥样硬化、调节补体、抑制氧化应激、抗凋亡、保护细胞膜、促进损伤组织修复及调节生殖等[10]。ApoJ作为一种非典型热休克蛋白,脑损伤后其表达的上调是一种机体内源性应激保护反应[11]。但具体的神经保护作用机制目前尚未完全明确,有学者认为可能与其补体调节功能有关。前期郑晓梅 等[12]研究发现ApoJ对脑出血大鼠的内源性保护作用可能是通过抑制补体激活而实现的。
补体C3是补体系统发挥作用的核心,可作为补体活化的指标。补体系统通过3条激活途径产生补体受体1的配体(C3b)[13],最终形成膜攻击复合物(membrane attack complex,MAC)C5b-9,MAC损伤胞膜导致靶细胞溶解死亡[14]。脑出血后补体激活诱导细胞膜攻击,导致炎症反应、细胞凋亡、血脑屏障破坏和脑水肿[15-16]。研究[17]显示应用补体抑制剂治疗脑出血效果显著,而ApoJ作为确切的补体抑制因子,可能成为脑出血新的治疗措施。

图7 补体C3和内参GAPDH的mRNA 表达扩增图谱A:补体C3; B:内参GAPDH
本研究旨在探讨ApoJ对脑出血大鼠的神经保护作用机制。前期研究已经证实外源性ApoJ能够成功转染BMSCs,且携带ApoJ基因的BMSCs能够在ICH大鼠脑组织内表达ApoJ蛋白,本实验的转染结果与文献[5-8]结果一致,证实转染成功。本实验利用外源性ApoJ干预大鼠ICH模型,通过免疫组化和RT-PCR法分别检测C3蛋白和mRNA的表达变化。结果显示,ApoJ/BMSCs组和BMSCs组的C3表达随时间的延长逐渐降低,其中ApoJ/BMSCs组又显著低于同时间点BMSCs组。表明ApoJ/BMSCs组和BMSCs组均能下调C3的表达,但ApoJ/BMSCs组下降更为显著,从而推测ApoJ基因修饰的BMSCs较单纯BMSCs更能抑制脑出血后的补体级联反应。其实早在1989年Jenne et al[18]便已发现ApoJ可通过结合补体C5b-7而终止补体级联反应。2016年Huang et al[4]通过侧脑室注入人重组ApoJ蛋白干预脑损伤大鼠模型,发现ApoJ可通过抑制脑损伤后补体激活和氧化应激反应,减轻炎症反应、保护血脑屏障和减轻脑水肿,促进大鼠神经功能恢复,本实验结果与之相符。
本研究证实了ApoJ对脑出血大鼠的神经保护作用是通过抑制补体激活机制而实现的,是否还有其他机制的参与需要进一步深入研究,这为进一步研究ApoJ对脑出血的治疗作用提供了新的理论依据。

