Transwell法检测细胞侵袭迁移能力实验中的影响因素
唐秋琳,毕 锋
(四川大学 华西医院肿瘤分子靶向治疗研究室,四川 成都 610041)
恶性肿瘤至今仍是世界医学界一大难题,每年全世界有数以千万计的人罹患恶性肿瘤,并且呈逐年增长态势。人类对恶性肿瘤的抗争不仅体现在医疗手段的不断改进,更希望从分子细胞水平探究肿瘤发生的机制[1-3]。恶性肿瘤细胞的生物学特性包括形态学改变,细胞增殖抑制消除,细胞的浸润性、永生性、异质性及遗传改变等。现代细胞分子生物学应用目前的技术手段,针对肿瘤的生物学特性,在实验室体外研究中,对肿瘤的恶性生物学表型,都建立了相应的检测方法。其中,浸润性是指肿瘤细胞扩张性行为,包括迁移能力和侵袭能力,我们在体外培养的肿瘤细胞仍保持有这种性状[4]。在与正常组织混合培养时,能浸润入其他组织细胞中,并有穿透人工隔膜生长的能力。因此,可以使用人工隔膜(Transwell)对肿瘤细胞的迁移及侵袭能力进行检测。Transwell®即底部具有聚碳酸酯膜的活置式培养小室,膜可以将细胞在孔板内的培养空间分隔,分上下层培养液以膜相隔,实验利用聚碳酸酯膜的通透性,小室内外的培养成分可以相互渗透,相互影响,应用不同孔径的聚碳酸酯膜可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等研究[5-6],不同的厂家有不同的商品名,其原型为Boyden chamber[7],目前已逐渐为Transwell所取代,如图1所示。
作为一种商品化实验材料,Transwell有生产商的使用说明,但在实际应用过程中发现,许多细节问题还需从实践中总结获得,目前缺乏文章系统地对Transwell小室在侵袭及迁移实验技术上进行详细地分析,本文根据自身实践经验,主要对使用Transwell对肿瘤细胞进行侵袭和迁移检测过程中容易遇到并忽略的细节进行解析,并总结相应的解决方案,以辅助广大科研工作者顺利完成该部分的实验工作。
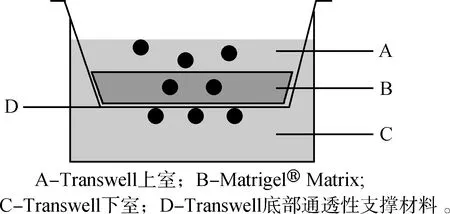
图1 Transwell®细胞侵袭检测示意图
1 材料和方法
1.1 材料
细胞株,可以用于具有贴壁性能的细胞,本实验中所使用的为非小细胞肺癌细胞株NCI-H1299;DMEM高糖及1640培养基(GIBICO);新生牛血清及胎牛血清(GIBICO);胰酶、PBS、结晶紫染液、4%多聚甲醛固定液;Transwell小室及Matrigel基质胶(均购自Corning公司);24孔板(购自Eppendorf公司)棉棒、眼科镊和倒置显微镜。
1.2 方法
1.2.1 细胞侵袭检测
1)铺胶,将融解的Matrigel胶与无血清培养基按照一定比例(详见结果部分)混合,均匀铺至Transwell小室底部(上室面),置于37培养箱进行凝固约2~4 h,使其呈凝胶状;2)接种细胞,将生长至对数期的细胞消化,计数,无血清培养基稀释至一定比例,均匀接种至Transwell小室底部,再将Transwell小室放入加了10%FBS培养基的孔板中培养;3)细胞染色,培养细胞24~48 h后,取出Transwell小室,用棉签擦拭小室内部细胞及残余的Matrigel胶,PBS清洗3次,多聚甲醛对小室底部背面穿过的细胞进行固定,结晶紫对其进行染色,镜检计数并分析作图。
1.2.2 细胞迁移检测
与侵袭实验不同的唯一区别在于不使用Matrigel基质胶,其余步骤相同。
2 结果
2.1 肿瘤细胞侵袭试验中铺胶过程中的影响因素
Matrigel matrix基质胶来源于EHS小鼠肉瘤,其主要成分为层粘连蛋白、Ⅵ型胶原蛋白、巢蛋白、接触蛋白和肝素硫酸多糖等模拟细胞外基质的成分,并通过铺在Transwell小室底部形成与天然基质膜结构相似的膜结构,上室接种细胞不能自由穿过,必须分泌水解酶,并通过变形运动才能穿过这种铺有Matrigel的滤膜,这与体内情况同样较为相似,用于模拟体内细胞基底膜的结构、组成和物化功能性质。
2.1.1 Matrigel基质胶的预冷
细胞侵袭实验中常有下室穿透细胞聚团严重现象,原因之一是因为基质胶的铺胶操作不当导致胶面不平,比较常用的Corning公司的Matrigel matrix基质胶凝胶凝固点在14℃附近,因此在操作时应特别注意以下3个方面问题。1)基质胶常规保存温度为-20℃,Matrigel matrix收到后应进行分装,且只能分装一次,整个分装过程要在冰上进行,且以后每次实验时拿出本次用量的已经分装好的基质胶,该次实验用不完的基质胶要扔掉,不可以留作下次使用;使用时提前一晚置于4℃冰箱使其逐渐融解,融解过程中不得用手触碰或温浴管壁。2)铺胶时所有相关材料,如移液枪,枪头最好能在-20℃或4℃冰箱提前预冷,整个操作过程尽量在冰上进行。3)铺胶时轻柔匀速,尽量保证胶面平齐且将小室底部全部铺满以免造成假阳性结果,胶面不可用枪头搅动,避免胶面不平或气泡产生。
2.1.2 Martrigel基质胶的稀释比例
几乎所有的在线实验方案中,均提到Matrigel胶的稀释比例应该为1∶1~1∶8之间(主要指 Corning Matrigel basement membrane matrix®),但就Matrigel中所含蛋白的工作浓度而言,这样的说法不太严谨,对此本文专门咨询了Corning厂商及技术支持,推荐Matrigel matrix用于细胞体外侵袭实验的基质胶蛋白浓度一般在200~300 μg/mL,而商品中蛋白浓度一般在8~12 mg/mL(具体批次浓度不同,需联系生产商),需要稀释到很低的倍数,有的实验需要低至30倍的稀释,凝胶凝固后只有很薄的一层,肉眼几乎无法分辨,且会析出水相,在使用前需小心吸出水相。但是也有国外文献称侵袭实验所使用Matrigel基质胶蛋白浓度为5~6 mg/mL[6]。本文针对在非小细胞肺癌细胞株NCI-H1299和A549的试验中,所使用Matrigel胶浓度约为2 mg/mL,在接种细胞4×104/孔(24孔板)的条件下,可获得较适宜的穿膜细胞量,因此建议,具体最适浓度需进行梯度浓度预实验,根据自己的实验条件,如细胞的侵袭能力、细胞生长状态、接种细胞数量多少等条件进行优化,以获得较为适量的穿膜细胞。
2.2 肿瘤细胞侵袭迁移试验中细胞接种过程中的影响因素
2.2.1 接种细胞
1)侵袭/迁移能力弱的细胞在铺板前可以撤去血清饥饿12~24 h。2)细胞计数时一定要尽量严格,以保证各孔细胞密度均匀,为了避免各孔间由于细胞计数引入的误差,一般需要重复三个副孔。3)种细胞时尽量从孔的中间位置滴加,力度柔和,速度尽量慢,以免冲击力太大破坏胶面;同时避免气泡产生。
2.2.2 注意Transwell小室底部气泡的产生
Transwell小室在放入孔板时,常常会因为液体表面张力的原因在小室底部形成气泡,气泡导致的底部液面不均会严重影响细胞侵袭和迁移能力,因此在放置小室时,应轻柔匀速,若发现底部产生气泡,不要拍打板子(这样做会使刚铺好的细胞重新聚团),而应将小室轻轻提起,重新放置直至无气泡。
2.3 肿瘤细胞侵袭迁移试验中细胞染色过程中的影响因素
2.3.1 棉签擦拭Transwell小室内部的方法
过大或过小的棉签都不利于擦拭小室底部,尤其是棉花较为松散的医用棉签,掉落的纤维会影响实验结果的可读性,应该选用大小适中较为紧实的棉签,使用前稍微沾湿,沿一个方向(如顺时针)从边缘向中心捻动棉签进行擦拭,擦拭完立即换一根新的棉签重复上述步骤,不应一根棉签反复擦拭。直至镜下观测到确已将凝胶及未迁移的细胞团擦拭干净。
2.3.2 结晶紫染色及漂洗时间
在结晶紫染色前,应将小室内外PBS稍吸干,令小室底面细胞稍干(水分风干即止),再进行染色,效果较好。染色及PBS漂洗时间应根据实验情况多加摸索,确定最佳的染色及脱色时间。理想的染色结果是细胞均匀着色,形态整齐,Transwell小室膜背景干净,能清楚地看到微孔,如图2所示;染色后将小室稍风干,置于滴加了甘油封片剂的载玻片上,倒置显微镜下观测;也可将底部膜用手术刀片仔细分离,置于正置显微镜下观测,效果更好(但使用此方法后,Transwell小室将不能回收再利用)。

图2 穿膜细胞的形态(×100)
2.4 Transwell小室回收利用的处理方法及对结果的影响
从上文可知,Transwell 小室底部为具有一定孔径的聚碳酸酯膜等支撑材料,因此,在不影响细胞生长及染色的前提下,小室在预实验中,可以重复利用3~5次,具体处理方法为:1)棉签初步清除小室底部已着色细胞后,小室置于1%胰酶中摇动浸泡过夜;2)棉签再次擦拭,流动水轻柔冲洗后,浸泡于75%乙醇中备用;3)使用前,流动水清洗,晾干,紫外线消毒,正反面各照2 h以上。注意:1)不能使用微波炉消毒或超声清洗,会破坏孔径,导致穿膜细胞数误差;2)棉签擦拭力度要适中,力量过大导致的孔膜破损或变形,该小室即不能再次利用。
2.5 问题分析
2.5.1 穿膜细胞过多可能的原因
1)细胞铺板数量过多,应做梯度接种预实验确定合适的细胞接种数。2)细胞过多导致无法计数时的解决方案:如穿膜细胞过多无法计数,在染色后可用33%醋酸脱色,洗脱结晶紫在酶标仪上590 nm 处测定其OD值,可间接反映细胞数,避免样本浪费,但如若需要迁移/侵袭图片,仍需重复试验。
2.5.2 穿膜细胞太少可能的原因
1)需考虑细胞的侵袭能力。基质金属蛋白酶(matrix metalloproteinases,MMPs)属于基质金属蛋白酶家族[8],几乎能降解ECM中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用。如果多次重复试验均未见细胞侵袭结果,可以检测一下该细胞株基质金属蛋白酶MMPs的表达情况。2)细胞接种数量过少,应做梯度接种预实验确定合适的细胞接种数。3)穿膜细胞由于粘附贴壁能力不强,落到下室孔板培养液中,可以在膜下表面涂纤维粘连蛋白(fibronectin,FN)增加细胞贴壁性能及趋化能力。4)小室放入孔板中时,下部带有气泡,导致趋化作用消失,细胞无法穿膜。5)Transwell小室孔径的选择需要重新确认。Transwell小室底部的通透性支持物(膜)存在不同材料制成及不同孔径大小,应根据实验具体要求选择不同的系统,具体选择标准可在线查询(Transwell通透性支持物的使用和选择手册,www.Corning.com/lifescience)。
2.5.3 穿膜细胞不均匀可能的原因
1)基质胶在操作过程中由于器材或环境温度过高导致的提前凝聚,会使胶面不平整,细胞聚团(铺胶过程详见2.1.1节)。2)接种过程中,细胞悬液应匀速轻柔滴加至孔中央,并避免因孔板震动导致的细胞聚团(24孔板),或进行“十字”摇动使细胞均匀(6孔板)。
3 结束语
肿瘤细胞的侵袭是一个体内复杂的过程,肿瘤细胞株的侵袭性被认为与其转移潜能密切相关,之前对肿瘤细胞侵袭迁移的研究主要通过二维模式(细胞平面培养)进行,而事实上,体内的侵袭迁移过程是发生在三维(3D)的自然环境中,环境因素包括肿瘤细胞和细胞外基质成分(细胞外基质)以及肿瘤微环境。因此,目前关于侵袭技术的前沿研究主要体现在实验模拟体内三维状态下,检测细胞的侵袭迁移机制,如在一个三维微环境下检测乳腺癌细胞的侵袭能力并确定入侵的癌细胞数量,以及在此过程中药物对迁移和侵袭能力的影响[9]。或利用重力,将细胞悬液制成球体,嵌入到三维基底膜材料混合物中,对球体进行药物/抑制剂作用或改变细胞外基质(ECM)成分,从而完成癌细胞侵袭实验[10]。
肿瘤细胞的迁移也在一定程度上体现了肿瘤细胞的转移能力,并且在生理发育过程中具有重要意义。在胚胎发育期间单个细胞和细胞集群可以移动相对较长的距离,细胞迁移在伤口愈合和许多成年动物的免疫过程中也起到关键作用。另一方面,不受控制的恶性细胞的迁移也会导致癌症的入侵。
在肿瘤细胞侵袭迁移能力检测上,Transwell小室检测法因为简便易行,重复性高,目前是公认度比较高的方法,因此应认识到,Transwell不等同于侵袭或迁移检测,而仅是方法之一。但也有学者发现,虽然Matrigel matrix基质胶已经很好地模拟了真实情况下胞外基质的构成,且广泛用于侵袭、体外血管生成或体外成瘤实验,但是与自然胞外基质相比,Matrigel胶仍缺乏主要粘连蛋白链中的粘连蛋白a1,以及无法达到自然产生的不溶性基底膜结构的完整性[6,13],在使用过程中应当注意。综上所述,虽然Transwell目前作为一种通用的检测细胞侵袭迁移能力的实验技术被广泛用于肿瘤研究中,但其仍有许多局限性,不断探索开发新的实验技术手段,方能满足发展迅速的肿瘤基础研究需求。

