紫茎泽兰叶片水浸液对蚕豆的化感效应
万宁佳 李可念 陈劲松

摘要: 外来入侵植物可以通过淋溶、自然挥发、根系分泌和植株凋落物分解等途径向周围环境释放化感物质,抑制伴生植物的生长、发育。该研究以不同浓度紫茎泽兰(Eupatorium adenophorum)叶片水浸液处理蚕豆(Vicia faba)种子,研究紫茎泽兰叶片水浸液对蚕豆根尖细胞微核、染色体畸变、细胞凋亡、蚕豆幼苗叶片叶绿素和N含量、光合生理特性、生物量的影响。结果表明:(1)紫茎泽兰叶片水浸液处理显著抑制蚕豆根尖的伸长和细胞的有丝分裂,并诱导蚕豆根尖细胞染色体畸变和细胞微核的产生,有丝分裂指数随着叶片水浸液浓度增加而减小,根尖细胞微核率随叶片水浸液浓度增加而增大,高浓度叶片水浸液处理对蚕豆根尖细胞的凋亡及坏死有明显影响。(2)紫茎泽兰叶片水浸液处理引起蚕豆幼苗叶片的叶绿素和N含量显著降低,并导致蚕豆幼苗最大净光合速率和生物量的显著下降。总之,紫茎泽兰叶片水浸液可能引起蚕豆根尖的氧化损伤和抑制根尖的伸长,且叶片水浸液的抑制作用呈现一定的剂量效应。紫茎泽兰叶片水浸液对蚕豆根尖的损伤和抑制作用可能影响了植株对氮素的吸收,进而对蚕豆幼苗光合生理表现以及生物量积累产生显著负面效应。-
关键词: 外来入侵植物, 染色体畸变, 根尖微核, 叶片N含量, 潜在最大净光合速率-
中图分类号: Q948.1
文献标识码: A
文章编号: 1000-3142(2018)12-1641-10
外来入侵生物对入侵地生态系统的结构、功能及生态环境产生严重的干扰与危害,成为全球变化的一个重要组成部分。紫莖泽兰(Eupatorium adenophora)是一种世界性的强入侵性有毒杂草,为多年生草本植物。自20世纪50年代入侵中国,现已广泛分布于云南、贵州、广西、四川、西藏等地,成为危害最严重的外来入侵植物之一。早在2003年,紫茎泽兰在国家环保总局和中国科学院联合发布的《中国第一批外来入侵物种名单》中就已经名列第一位(谢全喜等,2013),它的入侵严重危害了农、林、牧业生产(王亚麒等,2016)。外来入侵植物的根、茎或叶的提取物中往往含有化感物质,对多种植物具有强烈的化感作用,显著抑制植物的生长发育,研究这些提取物对伴生植物生长、发育以及繁殖的影响,是探讨外来入侵植物化感效应的重要途径之一(郑丽和冯玉龙,2005)。入侵植物提取物中的化感物质可以抑制其伴生植物的纺锤体装配、降低有丝分裂指数,并诱导伴生植物体内产生微核及各种类型的染色体畸变(Nishida et al,2005;胡婉君等,2011)。紫茎泽兰叶片提取物抑制了伴生植物种子根尖边缘细胞的产生,诱导了根尖边缘细胞凋亡,从而削弱了根尖边缘细胞对根尖的保护(马金虎等,2018)。根尖细胞结构与根对土壤中营养元素吸收密切相关,范倩和黄健国(2018)的研究显示紫茎泽兰提取物显著抑制了伴生植物N等营养元素的吸收。氮素作为调节植物生长发育的必需元素,对植物的生命活动产生巨大影响。Feng et al(2007)的研究显示N等元素的吸收与植物光合能力呈显著正相关。然而,目前尚未见有从化感物质影响伴生植物根系营养物质吸收的角度来研究紫茎泽兰的化感作用的相关报道。
本研究以细胞遗传学的理想材料蚕豆(Vicia faba)为对象,研究其种植区域内常常共生的紫茎泽兰叶片水浸液对其的化感效应,旨在验证紫茎泽兰叶片水浸液损伤了蚕豆根尖细胞,进而影响蚕豆幼根对N等营养元素的吸收,最终对蚕豆幼苗叶片氮含量、光合速率乃至生物量积累产生负面影响假说,有助于丰富和发展外来入侵植物紫茎泽兰化感作用的生理机制,为外来入侵植物的防治提供理论依据。
1材料与方法
1.1 材料与培养处理
供试紫茎泽兰叶片采集于西昌学院周边荒地(101°46′—102°25′E、27°32′—28°10′N),蚕豆(Vicia faba)种子(成胡14#)购自成都市种子市场。实验用土壤为四川师范大学生命科学学院实验用地表层浮土。
将紫茎泽兰叶片洗净,晾干后粉碎备用。在室温20~25 ℃下,取10 g紫茎泽兰叶片粉末置于小烧杯中,加入100 mL蒸馏水浸泡36 h,过滤,即得0.100 g·mL-1母液。取母液配制浓度为0.001、0.005、0.025、0.050 g·mL-1的紫茎泽兰叶片水浸液放入4 ℃冰箱备用,以蒸馏水为对照CK。
挑选250粒均匀饱满、大小一致、健康无损伤的蚕豆种子,漂洗消毒后均匀置于铺有湿润纱布的洁净磁盘中以报纸覆盖,放入25 ℃的培养箱中避光培养至种子露白(胡婉君等,2012),而后平均分为5组,每组50粒种子,转移至培养皿中,覆盖土壤。分别将20 mL蒸馏水与4种不同浓度的紫茎泽兰叶片水浸液浇于培养皿中,置于培养箱中,25 ℃避光培养。
1.2 测定指标及方法-
1.2.1 蚕豆根尖伸长72 h后每处理随机选择20粒种子用游标卡尺测定蚕豆种子根长。-
1.2.2 蚕豆根尖微核率、有丝分裂指数及DNA凝胶电泳每处理选取6个根尖制片观察根尖细胞染色体畸变并对根尖细胞微核数及处于有丝分裂各时期的细胞数进行计数。按照公式计算微核率和有丝分裂指数(胡婉君等,2011;丁晓雯等,2010;吴亚娟和何兴金,2012)。
微核率=具有微核的细胞数观察的细胞总数×1000‰;
有丝分裂指数=分裂期进行分裂的细胞数观察的细胞总数-×100%。-
1.2.3 蚕豆根尖细胞DNA凝胶电泳采用天根试剂盒提取不同浓度紫茎泽兰叶片水浸液处理过的蚕豆根尖细胞DNA。以DNA marker Ⅱ作参照,进行凝胶电泳,最后经凝胶成像系统得出电泳结果。-
1.2.4 蚕豆幼苗光合能力将剩余萌发蚕豆种子播种于直径10 cm、高12 cm的塑料钵中,基质为沙土,在自然光下培养,定期浇灌1/2霍格兰营养液[大量元素:0.82 g·L-1 Ca(NO3)2·4H2O,0.50 g·L-1 KNO3,0.136 g·L-1 KH2PO4·2H2O,0.493 g·L-1 MgSO4·7H2O,2.5 mmol·L-1 铁盐(EDTANa和FeSO4·7H2O)。微量元素: 1.81 mg·L-1 MnCl2·4H2O,2.86 mg·L-1 H3BO4,0.22 mg·L-1 ZnSO4·7H2O,0.08 mg·L-1 CuSO4·5H2O,0.02 mg·L-1 H2MoO4·7H2O)],在幼苗高度长至25 cm高时,选取第五片完全展开的成熟叶片进行光合能力的测定(彭玲等,2018)。每处理重复6次。
采用GFS-3000便携式光合仪(Walz,Effeltrich,德国)测定其光响应曲线,空气流速设置为750 μmol·s-1,风扇设置为7档,叶室内的空气相对湿度为60%,温度25 ℃。使用面积为3 cm2的圆形叶室。
GFS-3000开机后先进行ZP和MP调零,排除外界与仪器对测量结果的影响。设置光照强度(PPFD)为800 μmol·m-2·s-1,CO2为400 μmol·mol-1对叶片进行光适应诱导30 min。适应结束后保持CO2浓度不变,依次设置光照强度为1 600、1 300、1 000、800、600、400、300、200、150、100、50、30、10、0 μmol·m-2·s-1,测定不同光照强度下的光合速率(Pn),每光照强度测定3次,取平均值,以Pn对PPFD作图,得到Pn-PPFD曲线。
最大净光合速率(Pmax):采用非直角双曲线模型(Lambers et al, 1998)对测得的Pn-PPFD曲线进行拟合得到Pmax。公式如下:
Pn=φPPFD+Pmax-φPPFD+Pmax2-4φθPmaxPPFD2θ-Rd。
式中,θ、Φ、Rd分别表示光响应曲线的凸度(或曲率)、表观量子产额(μmolCO2·μmol-1),即光响应曲线初始部分(PPFD=0~200 μmol·m-2·s-1)的斜率、暗呼吸速率。-
1.2.5 蚕豆幼苗叶片叶绿素含量、叶片N含量及总生物量选取成熟度一致、完全展开的蚕豆幼苗叶片,采用二甲基亚砜(DMSO)法(桂富荣等,2011)测定其叶绿素含量,每处理重复6次。在实验结束后将蚕豆幼苗于80 ℃烘干至恒重,测定其总生物量,每处理重复20次。烘干后的蚕豆叶片粉碎后,采用元素分析仪(MACRO-CUBE 德国)测定叶片氮含量,每处理重复6次。
1.3 数据分析
采用单因素方差分析(One-way ANOVA)分析不同浓度紫茎泽兰叶片水浸液处理对蚕豆根尖氧化损伤参数(根长,微核率和有丝分裂指数等)和蚕豆幼苗叶片参数(叶绿素含量,叶片氮含量和最大净光合速率)的影响(SPSS 20.0),并用Origin 9.0软件作图。
2结果与分析
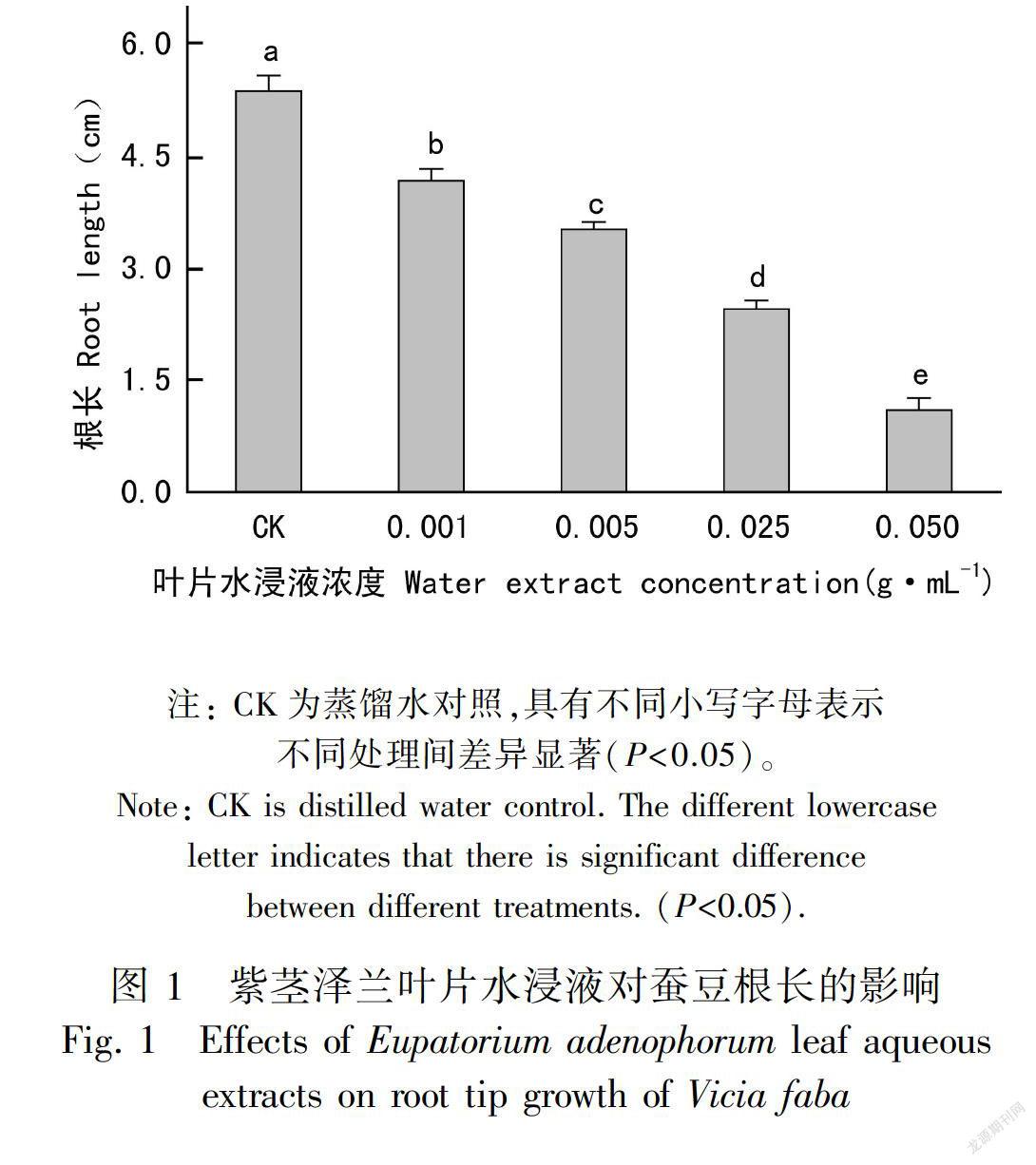
2.1 紫茎泽兰叶片水浸液对蚕豆种子根尖的影响-
2.1.1 蚕豆根尖伸长处理72 h后,紫茎泽兰叶片水浸液显著抑制蚕豆种子幼根的伸长,且这种影响与紫茎泽兰叶片水浸液浓度呈正相关。当紫茎泽兰叶片水浸液浓度达到0.050 g·mL-1时,蚕豆根尖长度仅为对照的20.5%(图1)。-
2.1.2 染色体畸变与对照组正常分裂细胞相比,经紫茎泽兰叶片水浸液处理后蚕豆幼苗根尖分生区细胞出现了染色体畸变。其中,间期发现了微核,前期发现了断片,中期发现了微核与游离染色体断片,后期发现了染色体的多极分裂,末期出现染色体断片等(图2)。-
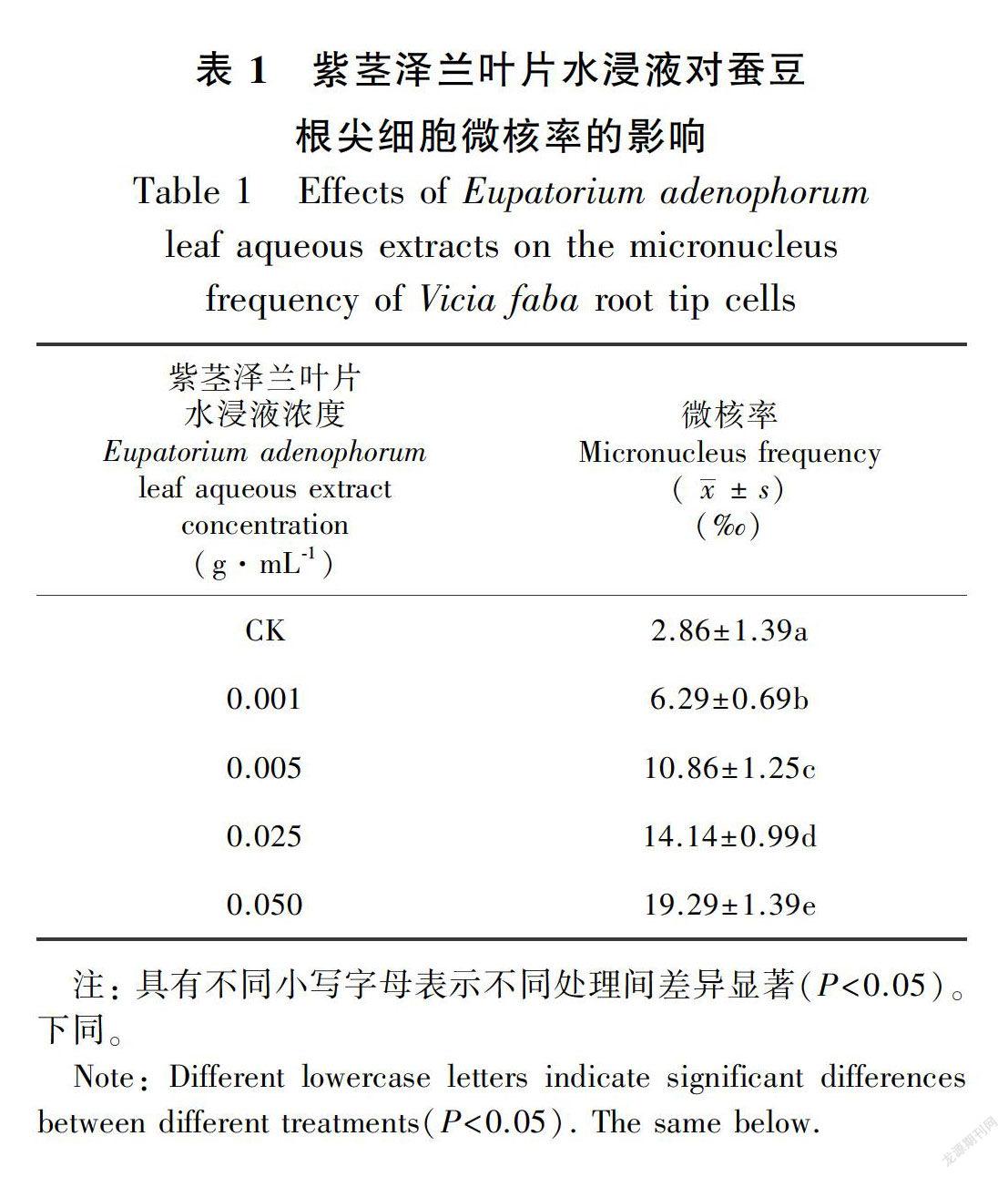
2.1.3 微核率处理72 h后,紫茎泽兰叶片水浸液显著增加了蚕豆种子根尖细胞的微核率,且这种影响与紫茎泽兰叶片水浸液浓度呈正相关。当紫茎泽兰叶片水浸液浓度达到0.050 g·mL-1时,蚕豆根尖微核率增加了85.2%(表1)。-
2.1.4 有丝分裂指数经紫茎泽兰叶片水浸液处理后,蚕豆幼苗根尖分生区细胞有丝分裂过程明
顯受阻。紫茎泽兰叶片水浸液处理72 h蚕豆根尖总有丝分裂指数随水浸液浓度增大而显著下降。当紫茎泽兰叶片水浸液浓度为0.050 g·mL-1时,总有丝分裂指数仅为对照组35.6%;其中紫茎泽兰叶片水浸液对有丝分裂前期的影响最为明显(表2)。-
2.1.5 DNA凝胶电泳种子经紫茎泽兰叶片水浸液处理,电泳图谱上出现DNA梯状条带和弥散型拖尾带。电泳图谱上出现DNA梯状条带或弥散型拖尾带分别是细胞凋亡和坏死的DNA电泳特征,表明蚕豆根尖细胞出现明显的凋亡与坏死情况,但与紫茎泽兰叶片水浸液浓度无显著关系。(图3)。
2.2 紫茎泽兰叶片水浸液对蚕豆幼苗的影响-
2.2.1 蚕豆幼苗生物量积累相比于对照,当紫茎泽兰叶片水浸液浓度为0.001、0.005 g·mL-1时,对蚕豆幼苗总生物量积累没有显著影响;随紫茎泽兰叶片水浸液浓度升高,蚕豆幼苗生物量显著下降,当紫茎泽兰叶片水浸液浓度达到0.050 g·mL-1时,蚕豆幼苗生物量积累仅为对照的55.3%(图4)。
2.2.2 叶片叶绿素含量紫茎泽兰叶片水浸液显著影响蚕豆幼苗叶片叶绿素含量,表现为叶绿素a、叶绿素b含量以及总叶绿素含量随紫茎泽兰叶片水浸液浓度增加而降低,当紫茎泽兰叶片水浸液浓度达到0.050 g·mL-1时,蚕豆幼苗叶片总叶绿素含量仅为对照的37.3%(图5)。-
2.2.3 叶片N含量紫茎泽兰叶片水浸液显著影响蚕豆幼苗叶片氮素含量,相比于对照,不同浓度的紫茎泽兰叶片水浸液都导致蚕豆幼苗叶片氮素含量显著下降,但不同浓度间无显著差异(图6)。-
2.2.4 蚕豆幼苗光响应曲线紫茎泽兰叶片水浸液处理后,蚕豆幼苗叶片的光补偿点无明显差异,但光饱和点显著下降(图7)。-
2.2.5 蚕豆幼苗潜在最大净光合速率蚕豆幼苗叶片潜在最大净光合速率随紫茎泽兰叶片水浸液浓度增加显著下降,当水浸液浓度达到0.050 g·mL-1时,蚕豆幼苗叶片的最大净光合速率仅为对照的26.1%。
3讨论
3.1 紫茎泽兰叶片水浸液对蚕豆根尖营养元素吸收的影响
外来植物入侵能够通过释放化感物质影响伴生植物生长实现其成功入侵和扩张(Abhilasha et al,2008;万欢欢等,2011)。化感物质有很多种,一旦进入土壤,就会对伴生植物生长造成影响,且这种影响在一定区域内长期存在(胡婉君等,2011)。细胞毒性是化感物质作用的一个重要特性,化感物质与受体植物细胞表面相互作用,破坏细胞的内部结构,干扰细胞有丝分裂,导致受体植物生长发育受阻。在受到诱变剂、致畸致突变剂等外界因素胁迫的情况下,伴生植物处于分裂期的根尖细胞会出现微核(micronucleus)、染色体断裂或纺锤丝形成受阻等多种染色体畸变(Tian et al,2007),同时,细胞发生不同程度的凋亡,最终影响伴生植物根尖的伸长。本研究结果显示,随着紫茎泽兰叶片水浸液处理浓度的升高,蚕豆根尖细胞的微核率逐渐增加,同时根尖细胞有丝分裂指数逐渐下降,这一结果说明,紫茎泽兰叶片水浸液对蚕豆种子根尖分裂细胞产生细胞毒性,从而抑制种子根尖生长, 最终抑制蚕豆根尖营养元素
的吸收,导致蚕豆在与紫茎泽兰的竞争中处于劣势,这可能是紫茎泽兰成功入侵的重要机制之一(Gao et al,2013;Wang et al,2013)。
化感胁迫诱导细胞凋亡,当受到某些高毒性的化感物质胁迫时,受体植物细胞出现细胞凋亡的特征。在植物中,凋亡类细胞死亡通常包括细胞DNA含量变化和DNA降解,电泳结果会产生DNA弥散型拖尾带与梯状条带。本研究结果表明,不同浓度紫茎泽兰叶片水浸液处理下的蚕豆根尖出现DNA梯状和弥散型拖尾带,说明细胞受损已达到DNA被降解的程度,紫茎泽兰叶片水浸液浓度为0.05 g·mL-1时,蚕豆根尖DNA降解最为严重。另外,马金虎等(2018)的研究报道,紫茎泽兰提取物抑制了伴生植物根边缘细胞的产生,并诱导了根尖边缘细胞凋亡,因而破坏了根边缘细胞对根尖的保护系统,最终导致根尖肿胀变形。本研究中较高浓度的紫茎泽兰叶片水浸液处理使蚕豆幼苗根加粗、褐化、变黑、烂根,乃至死亡,与其结果类似。
3.2 紫茎泽兰叶片水浸液对蚕豆幼苗生长的影响
光是植物生长必需的生态因子之一,植物对光的吸收能力和光合作用过程的适应能力在很大程度上体现了植物生长与竞争的能力。入侵植物化感作用影响伴生植物生长的途径之一是影响其光合作用,进而影响伴生植物生长(Zhou & Yu,2006;柴强和黄高宝,2003)。光补偿点和饱和点反映了植物对光照的适应范围(董志新等,2007)。本研究结果显示随紫茎泽兰叶片水浸液浓度的增加,蚕豆的潜在最大净光合能力下降,同时光饱和点显著下降,最终表现为随紫茎泽兰叶片水浸液浓度的增加蚕豆幼苗生物量积累显著下降,说明紫茎泽兰产生的化感物质降低了蚕豆幼苗的光合能力,同时缩小了其对光照的适应范围,进而影响了蚕豆幼苗生长。另有研究表明相比于本地物种,入侵物种自身具有更高的光合能力和较宽的光合生态幅(朱慧和马瑞君,2009),有些外来物种具有比本地种更强的光能利用率和光合响应机制,从而使它们具有很强的入侵潜力(Poorter,2001)。因此我们推测,紫茎泽兰能够释放化感物质抑制伴生植物的光合速率,同时通过提高自身的光合速率,迅速积累有机物质,以快速生长方式获得竞争优势,使其在不同生境条件下形成单优势种群。
叶绿素是光合作用过程中最重要的光合色素,在整个过程中起着能量接受和转换的作用,将光能转换为化学能,其含量的高低直接决定了光合作用的强度,是植物有机营养的基础(应小芳和刘鹏,2005;张力文等,2012)。叶绿素a 是光合反应中心复合体的最主要组成部分,起执行能量转化的作用;叶绿素b 是光合色素蛋白复合体的重要部分,主要捕获和传递光能,一般情况下,植物叶绿素a/叶绿素b=3。本研究结果显示隨紫茎泽兰浓度的增加,叶绿素逐渐下降,但叶绿素a与叶绿素b的比值逐渐增加,这说明紫茎泽兰叶片水浸液对叶绿素b的影响大于叶绿素a,主要降低了蚕豆幼苗叶片捕获光能的能力,进而影响了光合能力(Lichtenthaler,1987)。另外,本研究结果显示,不同浓度紫茎泽兰叶片水浸液对叶片N含量无显著差异,可能的原因是N素是合成叶绿素的主要元素,而紫茎泽兰导致光合器官中的N素分配发生了变化(Urban et al,2006;Evans & Seemann,1989;Field,1986)。但这一推测还需进一步实验数据证明。
综上所述,本研究的结果显示紫茎泽兰叶片水浸液导致蚕豆根尖细胞损伤,蚕豆幼根对N等营养元素的吸收作用减弱,最终对蚕豆幼苗叶片氮含量、光合速率乃至生物量积累产生负面影响,该结果有助于丰富和发展外来入侵植物化感作用机制,推进外来入侵植物的对农业生产潜在影响的认识。大量研究表明,植物生长调节剂(如茉莉酸,脱落酸,油菜素内酯等)有助于增强作物对多种胁迫环境(如干旱胁迫,盐胁迫,低温胁迫等)的抗性(Estradamelo et al,2015;Shahzad,2011;Janeczko et al,2007),但植物生长调节剂是否会增加作物对化感胁迫抗性的研究少见报道。为进一步丰富和发展对入侵植物的认识,还应继续开展相关研究。
-
参考文献:-
ABHILASHA D, QUINTANA N, VIVANCO J, et al, 2008. Do allelopathic compounds in invasive Solidago canadensis s. l. restrain the native European flora? [J]. J Ecol, 96(5): 993-1001.-
CHAI Q, HUANG GB, 2003. Review on action mechanism affecting factors and, applied potential of allelopathy [J]. Acta Bot Boreal-Occident Sin, 23(3):509-515. [柴强, 黄高宝, 2003. 植物化感作用的机理、影响因素及应用潜力 [J]. 西北植物学报, 23(3):509-515.]-
DING XW , LI H, WANG HY, 2010. Effect of cyclophosphamide on micronucleus rate in Vicia faba root tips [J]. Food Sci, 31(1):194-197. [丁晓雯, 李红, 王海燕, 2010. 环磷酰胺对蚕豆根尖细胞微核率的影响 [J]. 食品科学, 31(1):194-197.]-
DONG ZX, HAN QF, JIA ZK, et al, 2007. Photosynthesis rate in response to light intensity and CO2 concentration in different alfalfa varieties [J]. Acta Ecol Sin, 27(6):2272-2278. [董志新, 韩清芳, 贾志宽, 等, 2007. 不同苜蓿 (Medicago sativa L.) 品种光合速率对光和CO2浓度的响应特征 [J]. 生态学报, 27(6):2272-2278.]-
EVANS JR, SEEMANN JR, 1989. The allocation of protein nitrogen in the photosynthetic apparatus: costs, consequences, and control [J]. Plant Biol, (8):183-205.-
ESTRADAMELO AC, CHAO, REID MS, et al, 2015. Overexpression of an ABA biosynthesis gene using a stress-inducible promoter enhances drought resistance in petunia [J]. Hortic Res, 2(1):15013.-
FAN Q, HUANG JG, 2018. Allelopathy and fertilizer efficiency of compost made from Ageratina adenophora on wheat [J]. Sci Agric Sin, 51(4):708-717. [范倩, 黄建国, 2018. 紫茎泽兰对小麦的化感作用及腐熟肥效 [J]. 中国农业科学, 51(4):708-717.]-
FENG, YL, AUGE, H, EBELING, SK, 2007. Invasive Buddleja davidii allocates more nitrogen to its photosynthetic machinery than five native woody species [J]. Oecologia, 153(3): 501-510.-
FIELD C, 1986, The photosynthesis-nitrogen relationship in wild plants [J]. On Econ Plant Form Function: 25-55.-
GAO XM, ZHAO,YJ, YANG XJ, et al, 2013. Linking trait differences to community dynamics: evidence from Eupatorium adenophorum and co-occurring native species during a three-year succession [J]. PLoS ONE, 8(1): e50247.-
GUI FR, JIANG ZL, JIN JB, et al, 2011. Allelopathic effect of Ageratina adenophora on seed germination of nine herbaceous specie [J]. J Bios, 20(4):331-336. [桂富榮, 蒋智林, 金吉斌, 等, 2011. 紫茎泽兰化感作用对9种草本植物种子萌发的影响 [J]. 生物安全学报, 20(4):331-336.]-
HU WJ, MA DW, WANG YN, et al, 2011. Allelopathicpotential of volatile oil from Chenopodium ambrosioides L. on root tip cells of Vicia faba [J]. Acta Ecol Sin, 31(13):3684-3690. [胡婉君, 马丹炜, 王亚男, 等, 2011. 土荆芥挥发油对蚕豆根尖细胞的化感潜力 [J]. 生态学报, 31(13): 3684-3690.]-
HU WJ, MA DW, WANG YN, et al, 2012. Oxidative damage of volatile oil from Chenopodium ambrosioides on Vicia faba root tip cells [J]. Chin J Appl Ecol, 23(4):1077-1082. [胡琬君, 马丹炜, 王亚男, 等, 2012. 土荆芥挥发油对蚕豆根尖细胞的氧化损伤 [J]. 应用生态学报, 23(4):1077-1082.]-
JANECZKO A, GULLNER G, SKOCZOWSKI A, et al, 2007. Effects of brassinosteroid infiltration prior to cold treatment on ion leakage and pigment contents in rape leaves [J]. Biol Plant, 51(51):355-358.-
LAMBERS H, CHAPIN FS, PONS TL, 1978.Plant physiological ecology [M]. New York: Springer-Verlag.-
LICHTENTHALER HK, 1987. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes [J]. Methods Enzymol, 148: 351-383.-
MA JH, YANG WX, SUN LL, et al, 2018. Physiological mechanisms of the allelochemical stress to three weed species caused by Eupatorium adenphorum extracts [J/OL]. Acta Ecol Sin, (10):1-10 [2018-05-17]. Q.20180201.1625.058. html. [马金虎, 杨文秀, 孙亮亮, 等, 2018. 紫茎泽兰提取物对3种杂草化感胁迫的生理机制 [J/OL]. 生态学报, (10):1-10 [2018-05-17]. Q.20180201.1625.058. html.]-
NISHIDA N, TAMOTSU S, NAGATA N, et al, 2005. Allelopathic effects of volatile monoterpenoids produced by Salvia leucophylla: inhibition of cell proliferation and DNA synthesis in the root apical meristem of Brassica campestris seedlings [J]. J Chem Ecol, 31 (5): 1187-1203.-
PENG L, LIU JJ, WANG F, et al, 2018. Effects of nitrate nitrogen supply on the growth,photosynthetic characteristics and 15N absorption,utilization of Malus hupehensis seedlings [J]. Chin J Appl Ecol, 29(2):522-530. [彭玲, 刘晶晶, 王芬, 等, 2018. 硝酸盐供应水平对平邑甜茶幼苗生长、光合特性与15N吸收、利用的影响 [J]. 应用生态学报, 2018, 29(2):522-530.]-
POORTER L, 2001. Light-dependent changes in biomass allocation and their importance for growth of rain forest tree species [J]. Funct Ecol, 15(1), 113-123.-
SHAHZAD NA, 2011. The role of jasmonic acid (JA) and abscisic acid (ABA) in salt resistance of maize (Zea mays L.) [M]. Germany: Vvb Laufersweiler Verlag.-
TIAN YH, FENG YL, LIU C, 2007. Addition of activated charcoal to soil after clearing Ageratina adenophora stimulates growth of forbs and grasses in China [J]. Trop Grassl, 41: 285-291.-
URBAN L, MONTPIED P, NORMAND F, 2006, Season effects on leaf nitrogen partitioning and photosynthetic water use efficiency in mango [J]. J Plant Physiol, 163(1):48-57.-
WAN HH, LIU WX, WAN FH, 2011. Allelopathic effect of Ageratina adenophora (Spreng.) leaf litter on four herbaceous plants in invaded regions [J]. Chin J Eco-Agric, 19(1): 130-134. [萬欢欢, 刘万学, 万方浩, 2011. 紫茎泽兰叶片凋落物对入侵地4种草本植物的化感作用 [J]. 中国生态农业学报, 19(1): 130-134.]-
WANG WB, WANG RF, LEI YB, et al, 2013. High resource capture and use efficiency and prolonged growth season contribute to invasiveness of Eupatorium adenophorum [J]. Plant Ecol, 214(6): 857-868.-
WANG YQ, JIAO YJ, CHEN DM, et al, 2016. Effects of Eupatorium adenphorum extracts on seed germination and seedling growth of pasture species [J]. Acta Pratac Sin, 25(2) : 150-159. [王亚麒, 焦玉洁, 陈丹梅, 等, 2016. 紫茎泽兰浸提液对牧草种子发芽和幼苗生长的影响 [J]. 草业学报, 25(2):150-159.]-
WU YJ, HE XJ, 2012. Allelopathic potential of the invasive plant Ageratum conyzoides with Vicia-micronucleus test [J]. Plant Prot, 38(1):24-30. [吴亚娟, 何兴金, 2012. 利用蚕豆根尖微核试验研究入侵植物胜红蓟的化感作用潜力 [J]. 植物保护, 38(1):24-30.]-
XIE QX, ZHANG JM, ZHANG W, 2013. Research progress on invasive species Eupatorium adenophorum Sprengel [J]. Anim Husb Feed Sci, 34(9):85-89. [谢全喜, 张建梅, 张文, 2013. 入侵物种紫茎泽兰研究进展 [J]. 畜牧与饲料科学, 34(9): 85-89.]-
YING XF, LIU P, 2005. Effects of aluminum stress on photosynthetic characters of soybean [J]. Chin J Appl Ecol, 16(1):166-170. [应小芳, 刘鹏, 2005. 铝胁迫对大豆叶片光合特性的影响 [J]. 应用生态学报, 16(1):166-170.]-
ZHANG LW, ZHONG GC, ZHANG L, et al, 2012. A study on photosynthesis and photo-response characteristics of three Salvia species [J]. Acta Pratac Sin, 21(2):70-76. [张力文, 钟国成, 张利, 等, 2012. 3种鼠尾草属植物光合作用-光响应特性研究 [J]. 草业学报, 21(2):70-76.]-
ZHEN L, FENG YL, 2005. Allelopathic effects of Eupatorium adenophorum Spreng. on seed germination and seedling growth in ten herbaceous species [J]. Acta Ecol Sin, 25(10): 2782-2787. [郑丽, 冯玉龙, 2005. 紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响 [J]. 生态学报, 25(10): 2782-2787.]-
ZHU H, MA RJ, 2009. Photosynthetic characteristics comparison between an invasive plant, Lantana camara L. and associated species [J]. Acta Ecol Sin, 29(5): 2701-2709. [朱慧, 馬瑞君, 2009. 入侵植物马缨丹(Lantana camara)及其伴生种的光合特性 [J]. 生态学报, 29(5):2701-2709.]-
ZHOU YH, YU JQ, 2006. Allelochemicals and photosynthesis [M]. Allelopathy: Springer Netherlands: 127-139.

