RP-HPLC法测定猕猴桃根中儿茶素和表儿茶素含量
王敏,马玉梅,周晓松
(1.安顺职业技术学院应用医药系,贵州安顺561100;2.深圳市泰康制药有限公司,广东深圳518110)
猕猴桃根为猕猴桃科植物中华猕猴桃(Actinidia chinensis Planch)的干燥根[1],具有很好的保健用途和药用价值。可以烧水当保健茶喝;是养生膳食原料、保健填充材料、养生药酒原料以及中药制药原料,也经常用于养生花草茶、泡脚泡澡等,还可与其它膳食原料做成健康养生膳食,如猕猴桃粥对胃癌病人有特殊补益作用[2-5]。具有清热解毒,活血散结,祛风利湿的功效,主要用于风湿性关节炎,淋巴结结核,跌打损伤,痈疖[6-11]。中华猕猴桃分布在中国东部地区,陕西省广泛栽培,栽植面积超过100万亩,约占全国60%以上[12]。研究[13]表明,猕猴桃根含熊果酸、齐墩果酸、琥珀酸、胡萝卜甙以及精氨酸、赖氨酸、亮氨酸、丙氨酸和黄烷类,香豆素等多种成分元素。目前,有多篇文献[14-18]研究了猕猴桃根中的黄酮类、齐墩果酸、大黄素等成分的检测,但是针对猕猴桃根中黄烷类成分儿茶素和表儿茶素的同时检测未见报道。本试验建立了同时测定猕猴桃根中黄烷类成分儿茶素和表儿茶素的反相高效液相色谱法,本法操作专一、快速、简便、结果准确,适用于猕猴桃根的质量控制。此外,使用上述方法,本研究还分析了不同采收季节猕猴桃根中黄烷类成分儿茶素和表儿茶素含量变化。为猕猴桃根的科学开发利用奠定基础,为临床有效、合理、安全使用猕猴桃根提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
以贵州产的初春和秋冬采集的猕猴桃根为材料,粉碎,过三号筛待用。
1.1.2 试剂
标准品儿茶素(catechin,含量99.2%,批号:110877-201604)、表儿茶素(L-epicatechin,含量 100.0%,批号:110878-200102):中国食品药品检定研究院;甲醇(色谱纯)、乙腈(色谱纯)、乙酸(色谱纯)、乙酸乙酯(分析纯):国药集团化学试剂有限公司;水:纯化水。
1.1.3 仪器与设备
Agilent1260液相色谱仪、AgilentTC-C18(250mm×4.6 mm,5 μm)色谱柱:美国安捷伦公司;METTLER TOLEDO AG135型电子天平:瑞士梅特勒-托利多。
1.2 方法
1.2.1 样品溶液的制备
精密称取过三号筛的猕猴桃根粉末5.032 5 g,加水200 mL回流提取5 h,过滤,滤液用乙酸乙酯振摇提取3次,每次120 mL,合并乙酸乙酯液,蒸干,用50%甲醇溶解并定容至100 mL容量瓶中,作为样品溶液。
1.2.2 对照品溶液的制备
精密称取儿茶素对照品10.01 mg和表儿茶素对照品10.05 mg至20 mL容量瓶中,加50%甲醇溶解并稀释至刻度,摇匀,即得500 μg/mL的对照品储备液。
1.2.3 色谱条件
色谱柱:Agilent TC-C18,4.6 mm×250 mm,5 μm。流动相为A:乙腈,B:1%乙酸水溶液,采用梯度洗脱。流动相A 的比例为:0~50 min,5%~15%;50 min~50.01 min,15%~5%;50.01 min~60 min,5%。流动相 B 的比例为:0~50 min,95%~85%;50 min~50.01 min,85%~95%;50.01 min~60 min,95%。流速 1.0 mL/min,柱温30.0℃,进样体积10 μL。检测波长为280 nm。
1.2.4 线性关系考察
分别精密吸取对照品储备液取 4、2、0.4、0.08、0.02 mL置10 mL容量瓶中,用50%甲醇定容至刻度。按1.2.3色谱条件,取各浓度对照溶液10 μL进入液相色谱仪,以浓度(μg/mL)(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,计算出标准曲线的相关系数(R2)和线性回归方程。
1.2.5 重复性试验
精密称取同一批猕猴桃根粉末样品6份,按1.2.1的方法平行制备6份样品溶液,按1.2.3色谱条件进样10 μL,记录峰面积,并计算儿茶素和表儿茶素含量及相对标准偏差(relative standard deviation,RSD)。
1.2.6 回收率试验
精密称取同一批已知儿茶素和表儿茶素含量的猕猴桃根粉末样品9份,同时分别按高(1∶1.5)中(1∶1)低(1∶0.5)3个质量比定量加入儿茶素和表儿茶素对照品,按1.2.1的方法平行制备9份样品溶液,按1.2.3的色谱条件进样10 μL,根据测定结果中儿茶素和表儿茶素的含量计算相应的平均回收率(%)及RSD(%)值。
2 结果与分析
2.1 反相高效液相色谱法(reversed-phase high performance liquid chromatography,RP-HPLC)定量分析方法的建立
2.1.1 检测波长的选择
儿茶素和表儿茶素在210 nm~350 nm均有吸收峰,但280 nm处的吸收峰最大,因此选择检测波长为280 nm。
2.1.2 流动相的选择
本试验参考文献[19],比较研究了甲醇、乙腈与不同浓度的酸(乙酸)作为流动相,对儿茶素和表儿茶素对照品以及猕猴桃根中各组分色谱峰的分离效果,其中以乙腈(A)-1.0%乙酸水溶液(B)分离效果较好。经过多次梯度洗脱试验发现,洗脱程序为:流动相A的比例为 0~50 min,5%~15%;50 min~50.01 min,15%~5%;50.01 min~60 min,5%。流动相 B 的比例为:0~50 min,95%~85%;50 min~50.01 min,85%~95%;50.01 min~60 min,95%。试验结果表明,采用如上梯度洗脱程序,猕猴桃根中各组分色谱峰峰形尖锐,对称性好。
2.2 RP-HPLC定量分析的方法学考察
2.2.1 线性关系考察
儿茶素线性回归方程:Y=12.961X-6.642 8相关系数:R2=0.999 9,在 1.0 μg/mL~198.6 μg/mL 的范围内线性关系良好。表儿茶素线性回归方程:Y=12.391X-6.578 5 相关系数:R2=0.999 9,在 1.0 μg/mL~201.0 μg/mL的范围内线性关系良好。考察结果见表1、图1、图2。
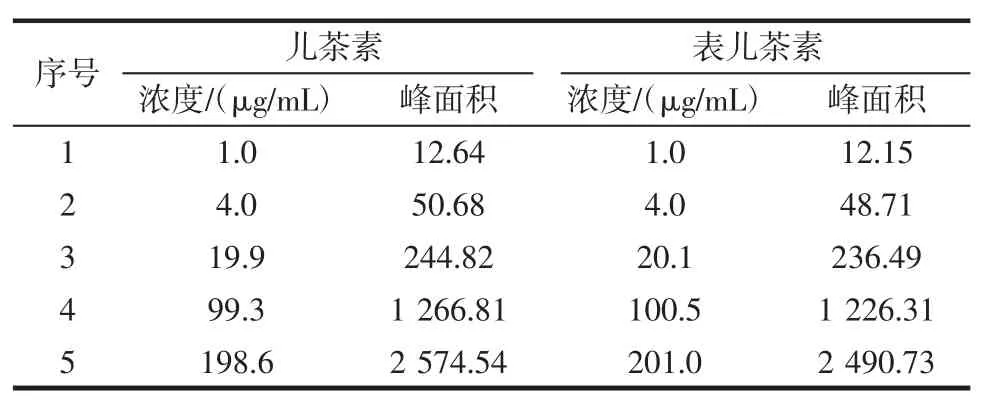
表1 儿茶素与表儿茶素进样浓度与峰面积Table 1 Injection concentration and peak area of catechin and L-epicatechin

图1 儿茶素线性关系图Fig.1 Linear relationship of catechin

图2 表儿茶素线性关系图Fig.2 Linear relationship of L-epicatechin
2.2.2 重复性试验
重复性试验结果见表2。

表2 儿茶素与表儿茶素重复性试验Table 2 Repeatability tests for catechin and L-epicatechin
2.2.3 回收率试验
儿茶素回收率99.16%,RSD0.66%;表儿茶素回收率100.99%,RSD0.74%,均在允许范围内。试验结果见表3、表4。

表3 儿茶素回收率试验Table 3 Recovery tests for catechin

表4 表儿茶素回收率试验Table 4 Recovery tests for L-epicatechin
2.3 不同采收季节猕猴桃根中黄烷类成分儿茶素和表儿茶素含量
不同采收季节猕猴桃根中黄烷类成分儿茶素和表儿茶素含量见表5。
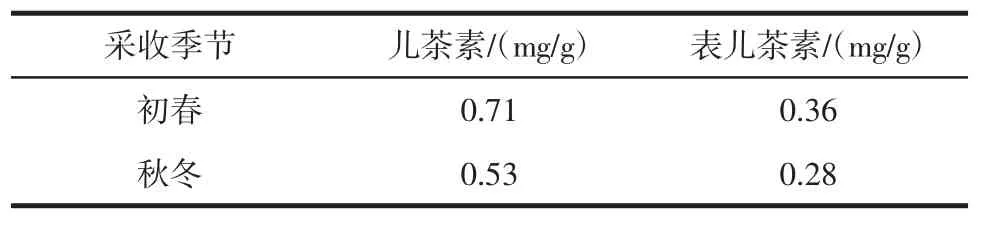
表5 不同采收季节猕猴桃根中儿茶素和表儿茶素含量Table 5 Content of catechin and L-epicatechin in Actinidia chinensis Planch during different harvesting seasons
一般根类植物的采收期是初春和秋冬,由表5可知,初春采收的猕猴桃根中黄烷类成分儿茶素和表儿茶素含量均明显高于秋冬。
3 结论与讨论
本试验建立的提取方法可使猕猴桃根中的儿茶素和表儿茶素与其他成分有很好的分离,试验建立的反相高效液相色谱分析方法经方法学验证,儿茶素和表儿茶素线性关系良好,回收率准确度较高,RSD低,是一种检测猕猴桃根中的儿茶素和表儿茶素含量的有效方法。对不同采收季节的猕猴桃根中的儿茶素和表儿茶素进行分析,发现春秋采收的猕猴桃根的有效成分明显高于秋冬。
目前猕猴桃根中儿茶素和表儿茶素同时提取的方法未见报道,文献[19]报道的表儿茶素的提取方法为50%甲醇超声,虽然能够提取出表儿茶素但不能提取出儿茶素,并且分离度也到不到要求。本文则采用水提取乙酸乙酯萃取的方法,能够除去猕猴桃根中许多极性大的成分,使黄烷类成分儿茶素和表儿茶素能够很好地分离。

