夏黑葡萄VlTFL1A基因酵母单杂交文库构建及其上游基因的筛选
郭荣荣,林 玲,周思泓,韩佳宇,张 瑛 *,白先进
(1. 广西壮族自治区农业科学院葡萄与葡萄酒研究所,广西 南宁 530007;2. 广西壮族自治区农业科学院,广西 南宁 530007)
【研究意义】葡萄是世界上栽培面积最为广泛,人们最喜爱和加工产品最为丰富的水果之一。近年来,我国鲜食葡萄和酿酒葡萄的栽培面积和产量一直处于增长状态。葡萄一年两收栽培技术是指一年生产两造葡萄的栽培模式,是充分利用葡萄芽一年多次分化的特点,利用绿枝夏芽、冬芽当年开花,或打破老熟枝条冬芽休眠,形成两季葡萄产量,可实现增产,并延长葡萄供应期[1-2]。广西地处亚热带气候区,冬季较短,夏季较长,年平均气温在16~23 ℃,≥10 ℃的有效年积温为5036.7~8017.4 ℃,全年无霜期多在300 d以上,适合研究和推广葡萄一年两收栽培技术。但是由于受到广西上半年多雨、寡日照等自然条件的限制,部分品种(如主栽品种‘夏黑’)生长旺盛,二季果花芽分化不稳定或成花很少,使二季果产量难以保证,在一定程度上阻碍了葡萄一年两收栽培技术的推广和优良品种的引进。进行葡萄花序形成关键基因TFL1A上游的调控因子筛选的研究,可以为解析葡萄花序形成的调控机理提供基础。【前人研究进展】TERMINALFLOWER1(TFL1)是磷脂酰乙醇胺结合蛋白(PEBP)基因家族的成员[3]。葡萄中的TFL1包含3个序列,分别为VvTFL1A,VvTFL1B和VvTFL1C,它们可能与营养生长及分生组织的不确定有关[4]。Boss 等(2006)发现在拟南芥和烟草中过量表达VvTFL1基因会使其开花显著延迟,且在部分转基因拟南芥株系中花序分生组织较模糊,在发育的角果中还会出现新的花序[5]。而Carmona等(2007)的研究则表明过量表达VvTFL1A不会影响开花时间,但是会影响花分生组织的确定,极大的改变花序结构[4]。Crane等(2012)通过比较同一根枝条上结实芽和非结实芽发育过程中决定花分生组织去向的主要调控因子的表达水平,将TFL1(花分生组织特征的负调节子)的表达与结实芽联系起来,将花分生组织特征的正调节子与非结实芽联系起来[6]。此外,通过分析施加外源CK对离体培养的卷须表型及卷须中VvTFLA、VAP1和VvLFY表达量的影响,以及对VvTFL1A启动子转录水平的影响,发现高水平的CK上调VvTFL1A,延迟花分生组织确定,增加分枝的形成,最终形成花序[5]。前期研究发现从一季果花前3 d到一季果花后18 d,较高水平的TFL1A的表达会促进夏黑葡萄二季果花序原基的形成和发育[7],但其调控机理尚不清楚。酵母单杂交技术可以有效地检测出与启动子上顺式作用元件专一性互作的转录调节因子[8]。郇蕾等(2017)利用该方法筛选桃PpABI5启动子的上游转录因子,获得PpDAM3和PpDAM5两个转录因子,并通过该方法进一步证实PpDAM3和PpDAM5可以与PpABI5启动子结合,表明筛选出的这两个转录因子可能参与调控PpABI5的转录[9]。郭育强等(2016)运用SMART技术构建了木薯酵母单杂交cDNA文库,筛选MeCWINV6启动子的上游转录调节因子,并筛选出锌指蛋白、组氨酸蛋白H1.2和AT-hook核定位蛋白三个转录因子以及一个线粒体受体TOM5,为进一步研究MeCWINV6基因的表达调控机制提供了候选转录调节因子[10]。【本研究切入点】目前,对葡萄中TFL1A基因功能的研究较多,但对其调控机理的研究报道很少。弄清楚作用在该基因上游的调控因子,有助于完善其调控网络,进一步解析葡萄花序发育的调控机理。【拟解决的关键问题】以VlTFL1A基因的启动子序列构建诱饵载体,并构建酵母单杂交文库,筛选与其启动子顺式作用元件相结合的调节因子,为研究VlTFL1A在葡萄花序发育中的调控机理提供基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 本研究于2017年4-5月进行,供试品种为8年生夏黑葡萄,种植于南宁市明阳工业园区,植株种植株行距为1.5 m×3.3 m,采用简易避雨双十字V型架栽培模式,群体通风条件良好,管理水平中上。2017年1月上中旬对夏黑葡萄进行修剪,2月上旬催芽,4月上旬开花。构建酵母单杂交文库及克隆VlTFL1A基因启动子序列所用材料为夏黑葡萄一季果冬芽。
1.1.2 主要试剂 SD/-Ura DO Supplement、SD/-Leu DO Supplement、Aureobasidin A(AbA)和cDNA文库构建试剂盒购自Clontech公司;Adenine Sulfate(Ade)为Amresco公司产品。各种工具酶、Marker购自TaKaRa公司。PCR引物合成和测序由华大完成。
1.2 方法
1.2.1VlTFL1A基因启动子序列分析及pAbAi-pTFL1A诱饵载体构建 提取夏黑葡萄基因组DNA,在NCBI上查找欧洲葡萄黑比诺中VlTFL1A的启动子序列,据此设计引物VlTFL1A-F (KpnI) (5′-ctggtaccCCCTACAAAGGGGAGATTTCTTTGCTTGCT-3′)和VlTFL1A-R (SalI) (5′-ctagtcgATGAGAGAGAG AGAGAGAGGAGAGACGAGG-3′),克隆VlTFL1A基因的启动子序列并测序。利用启动子顺式作用元件预测软件PlantCARE (http://bio-informatics.psb.ugent.be/webtools/plantcare/html)对该启动子序列进行在线分析。
将VlTFL1A启动子的质粒和pAbAi表达载体分别用KpnI和SalI酶进行双酶切,酶切产物分别纯化回收后进行连接,连接产物转化到E.coliTOP10感受态细胞中,活化后涂布于LB固体培养基上(内含30 ng/mL Amp),37 ℃过夜培养后挑取单菌落摇菌,提取质粒进行酶切鉴定,然后选取阳性单克隆送华大基因测序,测序正确的即为诱饵载体pAbAi-pTFL1A。
1.2.2 诱饵载体和阳性对照转化酵母菌株 将诱饵载体pAbAi-pTFL1A和阳性对照p53-AbAi质粒用Bbs 1酶进行线性化,然后转入Y1HGold菌株中,用SD/-Ura和SD/-Ura/AbA(200 ng/mL)培养基进行筛选,30 ℃培养4~5 d后,挑SD/-Ura/AbA平板上的单菌落,用Matchmaker Insert Check PCR Mix 1 (Clontech)做菌液PCR,一管不加模板为负对照,一管加入0.5 μl对照质粒作为正对照,用于确定阳性菌落。然后选取诱饵载体pAbAi-pTFL1A上的一个阳性单菌落,以及阳性对照p53-AbAi上的一个菌落,在SD/-Ura/AbA(200 ng/mL)培养基上划线,培养3 d,即构建Y1H[pAbAi-pTFL1A] 和Y1H[p53-AbAi]酵母菌株。
1.2.3 用于构建文库的cDNA合成 采用Trizol法提取葡萄冬芽总RNA,然后采用Oligotex mRNA Kit (Qiagen) 分离纯化mRNA,利用SMART逆转录技术获得cDNA第一链,再通过LD PCR合成双链的SMART ds-cDNA,最后用1 %琼脂糖凝胶电泳检测。
1.2.4 文库cDNA转化诱饵菌株 用Eppendorf电转化仪电转线性化质粒pGADT7-Rec和文库cDNA于构建好的诱饵菌株Y1H[pAbAi-pTFL1A]感受态中。涂布200 μl转化后的菌液于SD/-Leu/AbA(200 ng/mL)平板上,30 ℃培养4~5 d,以初步筛选阳性克隆。
1.2.5 阳性克隆的确认及序列分析 挑取SD/-Leu/AbA(200 ng/mL)平板上的单菌落接种于YPDA液体培养基内,30 ℃、220 r/min培养3~4 d后再划线于SD/-Leu/AbA(200 ng/mL)平板上,培养3~4 d后挑取长出的单菌落摇菌进行扩大培养。利用Matchmaker Insert Check PCR Mix 2做菌液PCR,产物经1 % 琼脂糖凝胶电泳检测后,将500~2000 bp间有条带的菌液用酵母质粒提取试剂盒提取质粒,送华大基因测序。在NCBI(http://blast.ncbi.nlm.nih.gov/Blast.cgi)上利用Blast工具对测序结果进行序列比对,初步分析筛选得到的cDNA序列。
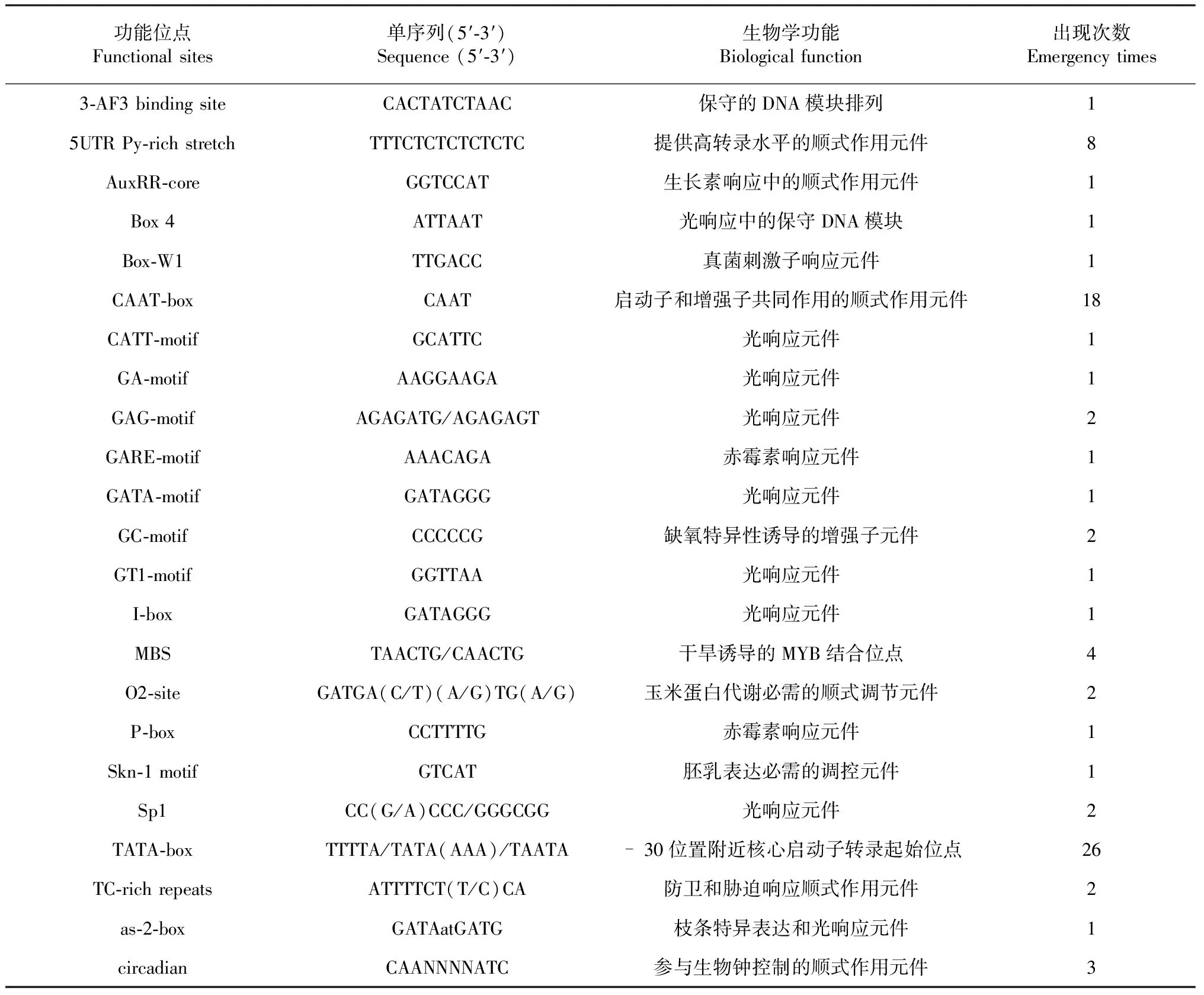
表1 夏黑葡萄中VlTFL1A启动子的顺式作用元件

图1 线性化的pAbAi-pVlTFL1A转化Y1HGold酵母感受态后涂布在SD/-Ura(a)和SD/-Ura/AbA(b)培养基上的生长状态Fig.1 The growth situation of linearized pAbAi-pVlTFL1A transformed Y1HGold yeast competent on SD/-Ura (a) and SD/-Ura/AbA (b) medium
2 结果与分析
2.1 VlTFL1A基因启动子的序列分析
启动子序列分析表明,VlTFL1A启动子序列中含有多个组成型核心启动子顺式作用元件,如CAAT-box 和TATA-box;还含有多种植物激素响应元件,如AuxRR-core、GARE-motif和P-box;光响应元件box4、CATT-motif、GA-motif、GAG-motif、GATA-motif、GT1-motif、I-box、Sp1、TCCC-motif和as-2-box;响应环境胁迫的元件,如Box-W1、MBS和TC-rich repeats;参与玉米蛋白代谢调节的O2-site;参与胚乳表达的Skn-1 motif;参与枝条特异表达的as-2-box以及参与生物钟控制的circadian等(表1)。
2.2 诱饵菌株的构建
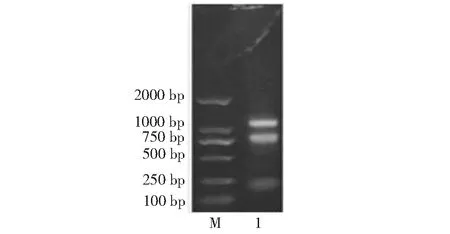
将克隆获得的VlTFL1A启动子序列连接到诱饵载体pAbAi上,将经Bbs 1酶线性化的pAbAi-pVlTFL1A转化Y1HGold酵母感受态,涂平板培养4~5 d后,发现其能在SD/-Ura培养基上出现正常生长的菌落,表明转化成功;而在SD/-Ura/AbA培养基(AbA浓度为200ng/mL)上未长出菌落,表明当AbA浓度为200 ng/mL时可以完全抑制诱饵菌株生长(图1)。
M:2Kb DNA marker,1:葡萄冬芽总RNAM:DL2000 DNA marker, 1:Total RNA extracted from latent buds of Summer Black图2 夏黑葡萄冬芽总RNA样品琼脂糖凝胶电泳检测Fig.2 Electrophoresis of total RNA extracted from latent buds of Summer Black
2.3 cDNA文库构建及转化诱饵菌株
提取的葡萄冬芽总RNA经琼脂糖凝胶电泳检测显示,28S rRNA和18S rRNA条带比较清晰,且28S rRNA亮度约为18S rRNA的2倍(图2),说明所提取的总RNA质量较好,可用于构建cDNA文库。
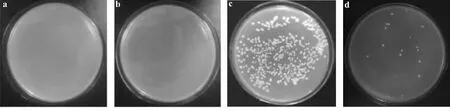
将文库cDNA与线性化的pGADT7载体共转化诱饵菌株Y1H[pAbAi-pVlTFL1A]感受态细胞,涂布200 μl转化后的菌液于SD/-Leu/AbA平板上。负对照在SD/-Leu/AbA平板上不能生长(图3a, b),正对照在SD/-Leu/AbA平板上生长(图3c),表明该筛选系统没有问题。将cDNA与线性化的pGADT7载体共转化诱饵菌株Y1H[pAbAi-pVlTFL1A]感受态细胞后,涂布在SD/-Leu/AbA平板上有菌落生长(图3d),表明是因为猎物蛋白与诱饵基因发生互作从而激活AbA抗性基因转录。
2.4 VlTFL1A启动子片段与葡萄cDNA文库的酵母单杂交筛选
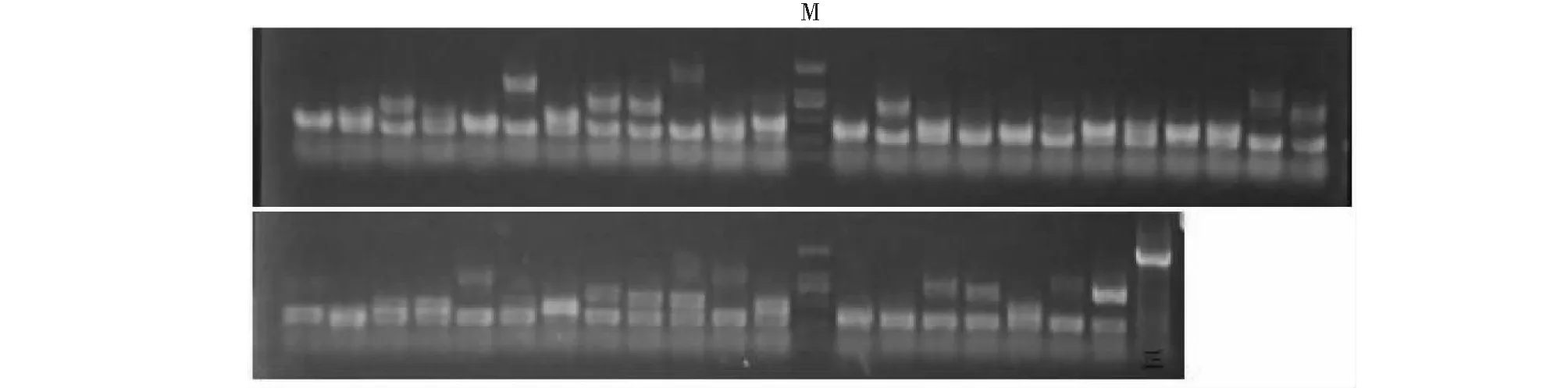
挑取2.3中在SD/-Leu/AbA培养基上长出的单菌落进行PCR扩增,获得大于500 bp的阳性克隆9个(图4)。对9个阳性克隆分别进行测序,在NCBI中对测序结果进行Blast比对分析,结果发现,这9个阳性克隆编码的蛋白分别为信号识别受体ɑ亚基(XP_002278056.1)、钙调蛋白相关蛋白(NP_001268169.1)、转酮醇酶(XM_002266458.4)、木葡聚糖糖基转移酶(XM_003635370.3)、F-box蛋白At2g32560-like(XP_019076275.1)、冠毒素不敏感基因1(COI1,JQ281907.1)、UV-B诱导蛋白At3g17800(XM_002267245.4)和重金属相关的异戊二烯蛋白39(XR_002032177.1),此外还有一个未知蛋白LOC100254834(XP_010652413.1)。
(a)[pAbAi-pVlTFL1A]+pGADT7阴性对照。(b)[pAbAi-pVlTFL1A]阴性对照。(c)[pAbAi-p53]+pGADT7-p53阳性对照。(d)[pAbAi-pVlTFL1A]+pGADT7-prey(a) Negative control [pAbAi-pVlTFL1A]+pGADT7. (b) Negative control [pAbAi-pVlTFL1A]. (c) Positive control [pAbAi-p53]+pGADT7-p53. (d) [pAbAi-pVlTFL1A]+pGADT7-prey图3 pGADT7-prey转化Y1H[pAbAi-pVlTFL1A]诱饵菌株感受态在SD/-Leu/AbA平板上生长的结果,AbA浓度为200 ng/mLFig.3 The growth results of pGADT7-prey transformed Y1H[pAbAi-pVlTFL1A] yeast competent on SD/-Leu/AbA medium, the concertration of AbA as 200 ng/mL
泳道M:DNA marker DL2000M:DNA marker DL2000图4 cDNA文库插入片段的PCR扩增Fig.4 PCR amplification of cDNA library inserts
3 讨 论
本研究通过构建酵母单杂交cDNA文库,筛选与VlTFL1A启动子结合的上游调控因子,最终获得信号识别受体ɑ亚基、钙调蛋白相关蛋白、转酮醇酶、木葡聚糖糖基转移酶、F-box蛋白At2g32560-like、冠毒素不敏感基因1(COI1)、UV-B诱导蛋白At3g17800、重金属相关的异戊二烯蛋白39等8个蛋白和一个未知功能蛋白。
前人研究表明TFL1A基因在葡萄始原基分化为花序原基或卷须原基的过程中起重要调控作用[6]。课题组前期通过生物信息学分析发现,该蛋白的互作网络中除了LFY蛋白和bZIP转录因子家族中的FD蛋白外,其余均为核糖体蛋白[7]。本研究中筛选获得的与VlTFL1A启动子结合的9个上游调控因子在葡萄花序形成中的作用尚不明确。
F-box蛋白在植物激素信号转导、光信号转导、自交不亲和以及花器官发育等许多生理过程中都具有重要功能[11]。拟南芥中的UFO基因编码一个F-box蛋白,该基因在花器官的形成和花分生组织特征的确定中发挥重要作用[12]。AtUFO基因在矮牵牛中的同源基因DOT可以调节花分生组织特征基因的表达,从而影响花形成的时间和位置[13]。但本研究中筛选出的F-box蛋白At2g32560-like与上述蛋白的同源性较低,在葡萄中的生物学功能尚不明确。
COI1也是一个F-box蛋白,在拟南芥中该蛋白与Skp1-like 1、Skp1-like 2、cullin 1以及ring-box蛋白1形成SCFCOI1 E3泛素连接酶复合体,该复合体对植物响应茉莉酸是必需的,而茉莉酸信号分子对包括植物防卫反应和生殖在内的多种生物学功能来说都是必需的[14-15]。目前尚未有COI1参与植物成花调控的报道。
信号识别受体ɑ亚基对尚不成熟的多肽穿过内质网膜来说是必不可少的,这种行为是通过信号识别颗粒所介导的机制来实现的[16]。钙调蛋白是广泛存在于各种真核生物细胞中的多功能信号系统调控蛋白,通过与响应靶蛋白结合发挥生物学效应,对生物体内多种钙离子依赖的细胞功能和酶体系都有重要的调节作用[17]。转酮醇酶是一种磷酸硫胺素依赖性酶,在异养生物中作为糖酵解和戊糖磷酸途径的纽带,为核苷酸、氨基酸和维生素的生物合成提供底物[18],在高等植物中参与卡尔文循环[19]。木葡聚糖是植物细胞壁中的一种重要多糖组分,在细胞壁框架结构的形成、细胞形态的维持、细胞生长和分化过程中形态变化的调控中发挥重要作用[20]。木葡聚糖糖基转移酶是木葡聚糖合成中的重要组分,在木葡聚糖的合成中发挥关键作用[21]。UV-B诱导蛋白在拟南芥中的同源基因At3g17800编码一个受UV-B诱导强烈上调表达的基因[22]。重金属相关的异戊二烯蛋白在维管植物的生长发育和植物应对环境的改变中发挥重要作用[23]。
目前,筛选获得的这9个蛋白在其它物种中的同源基因在植物成花方面的功能研究尚未见报道。下一步将对这9个蛋白进行功能鉴定,以期完善VlTFL1A基因的功能解析及调控机理研究。
4 结 论
本研究通过酵母单杂交技术,筛选作用在葡萄花序形成关键基因TFL1A启动子上游的调控因子,共获得信号识别受体亚基、钙调蛋白相关蛋白、转酮醇酶、木葡聚糖糖基转移酶、F-box蛋白、冠毒素不敏感基因1(COI1)、UV-B诱导蛋白、重金属相关的异戊二烯蛋白39等8个蛋白和一个未知功能的蛋白。

