干燥温度和提取方法对蛋白桑1-Deoxynojirimycin提取量的影响
韩蕴琦,柴鸿勋,马召稳,王占彬,李 旺
(河南科技大学动物科技学院,河南 洛阳 471023)
蛋白桑(Morusalba)也叫饲料桑,桑属(Morus),是由全国各地收集的28个桑树品种经过长期选择与改良,杂交优化而得的新品系,可作动物饲料和蔬菜,其蛋白质含量较高,叶片蛋白质含量可达36%[1]。历代中医药书籍中有关于桑叶治疗消渴症的记载,《本草纲目》中有“汁煎代茗,能止消渴”的记载[2]。桑树中存在多种生物活性成分,其中多种生物碱活性成分均有降血糖的作用,但是在降血糖过程中起主要作用的是一种名为1-脱氧野尻霉素的多羟基生物碱[3-5]。
1-脱氧野尻霉素的化学名称为3,4,5-三羟基-2-羟甲基四氢吡啶,英文名称为1-Deoxynojirimycin,简称1-DNJ或者DNJ,分子式为C6H13NO4[6]。DNJ能够抑制α-糖苷酶的活性,通过降低小肠对糖类物质的分解和吸收,同时能够促进胰岛素分泌,从而达到降低血糖的作用,是一种治疗糖尿病的有效药物[7-9]。而且,1-脱氧野尻霉素还具有抗病毒[10]、抑制肿瘤转移[11]、降血压[12]、降血脂[13]等功效,具有很高的食用和药用价值。
桑叶中DNJ含量的测定常采用高效液相色谱法,根据是否需要衍生化,高效液相色谱法可以分为不需要柱前衍生化和需要柱前衍生化两种方法,本研究采用柱前衍生化高效液相色谱荧光检测法进行检测,该方法具有操作简单、灵敏度好、准确度高、衍生化反应速度快、反应产物稳定等优点[14]。
DNJ的提取量除了与桑叶中DNJ含量有关之外,还与提取方法和桑叶处理方式有一定关系。本研究探讨不同提取方法以及不同的干燥温度对于DNJ提取量的影响,从而选择更好的提取方法和干燥温度,提高DNJ的提取量和蛋白桑资源的利用率。
1 材料与方法
1.1 材料与试剂
蛋白桑采自河南汝州市河南宏翔生物科技有限公司蛋白桑种植基地。
DNJ标准品来自Sigma公司,FMOC-Cl来自上海谱振生物科技有限公司,乙腈来自默克公司,其他试剂均为分析纯,试验用水为蒸馏水。
1.2 仪器与设备
高效液相色谱仪荧光检测器(美国Waters公司),台式冷冻高速离心机(美国Thermo Fisher公司),电热恒温水浴箱(上海一恒科学仪器有限公司)。
1.3 方法
1.3.1蛋白桑样品处理 采集1.3 m左右的新鲜蛋白桑,切短后分别采用自然晒干,鼓风干燥箱中分别于70、80、90和100 ℃条件下烘干至恒重后,粉碎过0.9 mm筛,所制样品分别标号1、2、3、4、5号,备用。
1.3.2DNJ的提取 样品分别采用盐酸提取法、水提取法和乙醇提取法3种方法进行提取。
盐酸提取法:准确称取蛋白桑粉0.2 g放置于5 mL离心管,加入0.05 mol·L-1盐酸溶液3 mL,涡旋提取30 s,10 000 r·min-1高速离心15 min,取上清液,残渣再加入0.05 mol·L-1盐酸溶液重复提取一次,合并两次提取液,加蒸馏水定容至50 mL,备用。
水提取法:准确称取蛋白桑粉0.5 g放置于50 mL离心管,加入适量超纯水,80 ℃水浴浸提两次,每次2 h,高速离心后取上清液,合并两次提取液,加超纯水定容至100 mL,备用。
乙醇提取法:准确称取蛋白桑粉0.5 g放置于圆底烧瓶,加入一定量的70%乙醇,加热回流提取两次,每次2 h,合并两次滤液定容至100 mL,备用。
1.3.3样品DNJ含量的测定
DNJ的衍生化[15]:取提取液10 μL置于1.5 mL离心管,加入10 μL硼酸盐缓冲液(pH=8.5)混合,再加入5 mmol·L-1的 FMOC-Cl乙腈混合液20 μL,均匀混合后于20 ℃水浴条件下反应20 min,然后加入0.1 mol·L-1甘氨酸10 μL与剩余的衍生化试剂反应,终止反应。最后,加入0.1%的醋酸水溶液950 μL稀释,混合均匀后用0.45 μm的一次性无菌针头过滤器过滤,取10 μL进行进样分析。
高效液相色谱条件:色谱柱为C18分析柱(250 mm×4.6 mm,5 μm);流动相为0.1%醋酸-乙腈(45∶55,V∶V);流速为1.0 mL·min-1;柱温为25 ℃;荧光检测器激发波长254 nm,发射波长322 nm,进样量10 μL。
绘制标准曲线:准确称取3.4 mg的DNJ标准品定容于100 mL蒸馏水中,制得标准品母液,吸取不同体积的标准品母液配制成不同浓度的DNJ标准溶液。吸取不同浓度的标准液进行衍生化和液相色谱分析,结果以标准品溶液浓度(X)为横坐标,色谱峰面积(Y)为纵坐标绘制标准曲线。
1.3.4数据统计与分析 每个样品重复测定3次,所得试验数据采用Excel 2007进行记录和收集,用SPSS 22分别对相同提取方法不同干燥条件和相同干燥条件不同提取方法进行单因素方差分析,并用Duncan法对各测定数据进行多重比较,结果均采用“平均值±标准误”表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 DNJ标准曲线的绘制
按照1.3.3的方法和色谱条件下,得到DNJ标准品色谱图和不同提取法提取的蛋白桑DNJ样品色谱图(图1)。以标准品溶液浓度(X)为横坐标,色谱峰面积(Y)为纵坐标,可以得到相关的回归方程:
Y=2 568 867X+743 351,R2=0.999 3。
方程表明,在0.34~17 μg·mL-1范围内具有良好的线性关系。
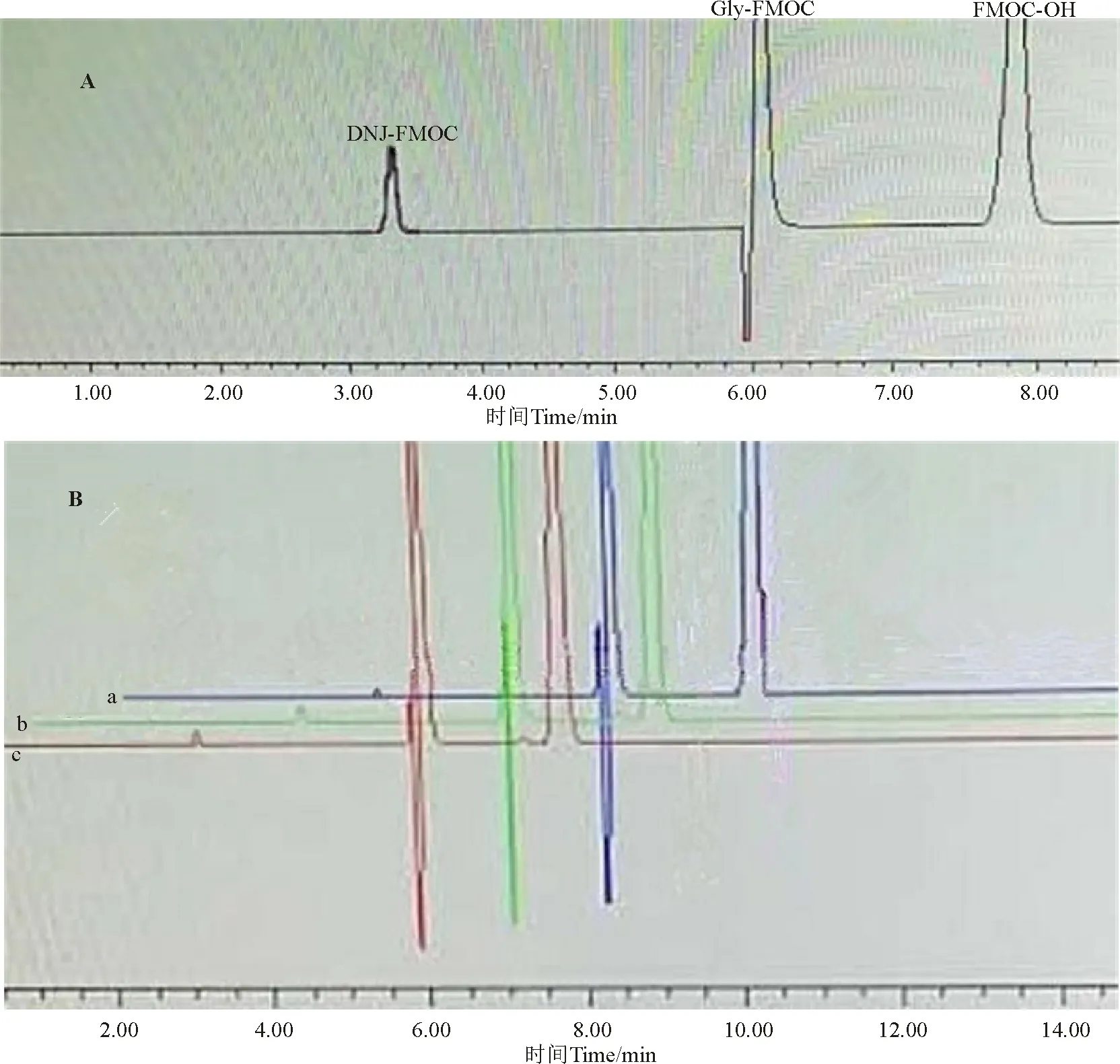
图1 不同方法提取的DNJ样品高效液相色谱图Fig. 1 High-performance liquid chromatogram of DNJ extracted from Morus alba by different methods
A.DNJ标准品色谱图 Standard chromatogram of DNJ; B,蛋白桑样品色谱图 Chromatogram of DNJ inMorusalba; a,水提取法 Water extraction method; b,乙醇提取法 Ethanol extraction method; c,盐酸提取法 Hydrochloric acid extraction method.
2.2 不同干燥温度对盐酸提取法DNJ提取量的影响
盐酸提取法在不同干燥温度下DNJ提取量由高到低为90 ℃>80 ℃>100 ℃>70 ℃>晒干(表1)。在温度低于90 ℃时,随着温度升高,DNJ的提取量增加;温度高于90 ℃后, DNJ的提取量下降。90 ℃干燥样品DNJ提取量最高,为3.38 mg·g-1,显著高于其他干燥条件下的DNJ提取量(P<0.05)。晒干条件下的DNJ提取量最低,为1.27 mg·g-1,显著低于其他干燥条件下的DNJ提取量(P<0.05)。70 ℃和80 ℃干燥条件下的DNJ提取量与100 ℃相比DNJ提取量均没有显著差异(P>0.05)。
90 ℃干燥样品比80 ℃干燥样品DNJ提取量高约7.0%,比100 ℃干燥样品DNJ提取量高约8.3%,比70 ℃干燥样品DNJ提取量高约10.8%,比晒干样品DNJ提取量高约166.1%。这表明,盐酸提取法提取DNJ时,桑叶的最佳干燥温度为90 ℃。
2.3 不同干燥温度对水提取法DNJ提取量的影响
水提取法在不同干燥温度下DNJ提取量由高到低为80 ℃>100 ℃>90 ℃>70 ℃>晒干(表1)。80 ℃干燥样品的DNJ提取量最高,为1.91 mg·g-1,显著高于其他干燥条件的DNJ提取量(P<0.05)。晒干样品的DNJ提取量最低,为0.89 mg·g-1,显著低于其他干燥条件下的DNJ提取量(P<0.05)。而且,不同干燥条件下,DNJ提取量均有显著差异(P<0.05)。
80 ℃干燥样品比100 ℃干燥样品DNJ提取量高约15.8%,比90 ℃干燥样品DNJ提取量高约24.8%,比70 ℃干燥样品DNJ提取量高约56.6%,比晒干样品DNJ提取量高约114.6%。这表明,水提取法提取DNJ时,桑叶的最佳干燥温度为80 ℃。
2.4 不同干燥温度对乙醇提取法DNJ提取量的影响
乙醇提取法在不同干燥温度下DNJ提取量由高到低为100 ℃>90 ℃>80 ℃>70 ℃>晒干(表1)。可以看出,随着温度的升高,DNJ的提取量也随之增加。100 ℃干燥样品的DNJ提取量最高,为3.77 mg·g-1,显著高于其他干燥条件的DNJ提取量(P<0.05)。晒干样品的DNJ提取量最低,为1.35 mg·g-1,显著低于其他干燥条件的DNJ提取量(P<0.05)。70和80 ℃干燥条件下的DNJ提取量没有显著差异(P>0.05)。
100 ℃干燥样品比90 ℃干燥样品DNJ提取量高约8.0%,比80 ℃干燥样品DNJ提取量高约16.7%,比70 ℃干燥样品DNJ提取量高约19.3%,比晒干样品DNJ提取量高约179.3%。这表明,乙醇提取法提取DNJ时,桑叶的最佳干燥温度为100 ℃。
2.5 不同提取方法对DNJ提取量的影响
在晒干、80 ℃和90 ℃干燥条件下,水提取法的DNJ提取量最低,分别为0.89、1.91和1.53 mg·g-1,均显著低于盐酸提取法和乙醇提取法的DNJ提取量(P<0.05),盐酸提取法和乙醇提取法的DNJ提取量无显著差异(P>0.05)。在70 ℃和100 ℃干燥条件下,水提取法的DNJ提取量分别为1.22和1.65 mg·g-1,均显著低于盐酸提取法和乙醇提取法的DNJ提取量(P<0.05);乙醇提取法的DNJ提取量分别为3.16和3.77 mg·g-1,均显著高于水提取法和盐酸提取法的DNJ提取量(P<0.05)(表1)。总体来说,乙醇提取法的DNJ提取量最高,盐酸提取法的DNJ提取量较高,水提取法的DNJ提取量最低。
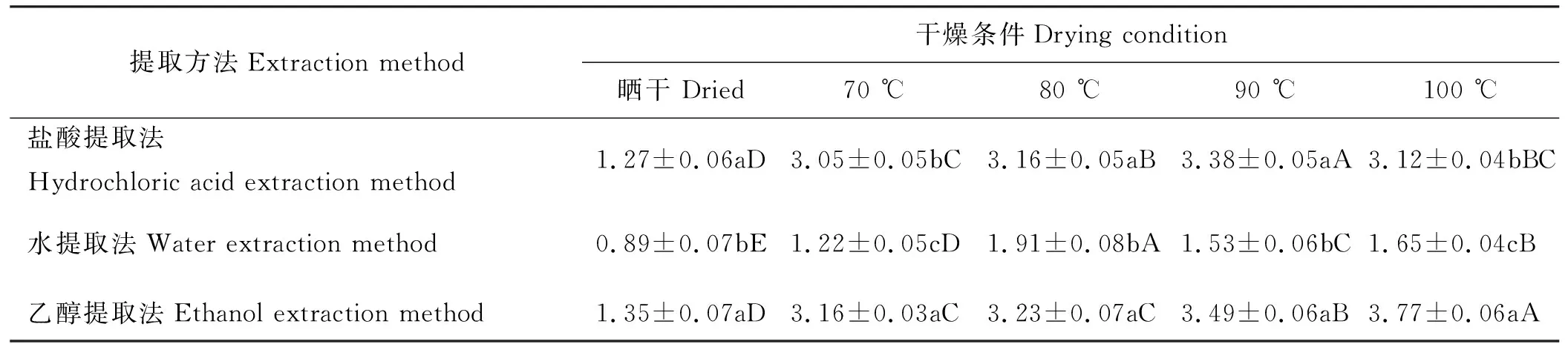
表1 干燥条件和提取方法对DNJ提取量的影响Table 1 Effect of different extraction methods on the amount of DNJ extracted under the different drying conditions mg·g-1
同行不同大写字母表示不同干燥处理间差异显著(P<0.05),同列不同小写字母表示不同提取方法之间差异显著(P<0.05)。
Different cappital letters indicate significant difference between the different drying conditions at the 0.05 level, different lowercase letters indicate significant difference between the different extration methods at the 0.05 level; similarly for the following tables.
3 讨论
3.1 DNJ的提取方法
DNJ提取的方法很多,常用的有水提取法、盐酸提取法、乙醇提取法、微波辅助提取法、超声波辅助提取法、真空气流细胞破壁技术(VAPB)辅助提取法等。同一种提取方法对不同部位和不同处理方式的桑产品DNJ提取量不尽相同。同一提取方法,提取工艺和提取过程中的辅助方法也会对提取结果产生显著影响。曾锐等[16]用水煎煮提取桑粉中的DNJ,用HPLC-ELSD法测定了桑树不同部位中的DNJ含量,结果发现不同品种桑的不同部位中DNJ含量差异较大。姜永涛等[17]用去离子水提取桑叶中的DNJ后,测定了不同品种桑叶中的DNJ含量,结果发现不同品种桑叶中DNJ含量差异较大。肖洪等[18]用超纯水对发酵的桑叶粉进行加热浸提,通过测定DNJ等活性成分的含量发现不同发酵方式DNJ提取含量差异显著。胡瑞君和车振明[19]使用水提法时,以微波处理作为辅助条件,优化了微波处理工艺,提高了提取量。郑晓静等[20]使用水提法时,以超声波处理作为辅助条件,优化了超声波提取条件,提高了DNJ的提取量。本研究采用水提取法探究了不同干燥温度对蛋白桑中DNJ提取量的影响,结果发现蛋白桑经过不同温度干燥后,DNJ提取量有较大的差异。
化学试剂作为提取剂的应用,丰富了DNJ的提取方法,提高了提取量。目前,DNJ的化学试剂提取法多为酸提法和醇提法。刘凡等[21]用0.05 mol·L-1的盐酸溶液提取桑叶粉中的DNJ,对98份不同桑树品种资源的桑叶中1-脱氧野尻霉素进行提取,获得了较高的提取量。刘伟鋆等[22]用70%的乙醇提取桑叶中的DNJ,提取液经过纯化后,得到DNJ含量为23.2%。本研究发现,酸提取法和醇提取法对相同样品的DNJ提取量显著高于水提取法,说明未来提取方法的发展方向应以化学试剂提取为主。
3.2 干燥条件对DNJ含量的影响
DNJ的提取量受众多因素影响,如干燥方式、提取方法、处理方法等,其中干燥环节的影响尤其明显,而且不同的干燥方式和干燥温度也能够影响桑叶中DNJ的提取量。秦樱瑞等[23]分别用热风干燥、微波干燥、冷冻干燥、真空干燥4种干燥方法对桑叶进行干燥处理,用超纯水提取后测定DNJ含量,结果发现微波干燥的桑叶DNJ含量最高,热风干燥的桑叶DNJ含量较高,冷冻干燥的桑叶DNJ含量较低,真空干燥的桑叶DNJ含量最低。刘红英等[24]分别用不同的方法对桑白皮进行干燥,用盐酸溶液作为溶剂超声提取后,测定DNJ含量,结果发现烘干样品中DNJ含量最高,晒干样品DNJ含量次之,阴干样品DNJ含量最低。本研究在这些研究基础上,对烘干的最佳温度进行了研究,发现不同提取方法最佳烘干温度不尽相同,丰富了蛋白桑最佳烘干温度和提取方法的配套数据。
4 结论
本研究结果表明,采用盐酸提取法时,蛋白桑最佳干燥温度为90 ℃,DNJ提取量为3.38 mg·g-1;采用水提取法时,蛋白桑最佳干燥温度为80 ℃,DNJ提取量为1.91 mg·g-1;采用乙醇提取法时,蛋白桑最佳干燥温度为100 ℃,DNJ提取量为3.77 mg·g-1;干燥条件相同时,乙醇提取法的DNJ提取量最高,盐酸提取法的DNJ提取量较高,水提取法的DNJ提取量最低。

