水杨酸甲酯对东北玉簪单宁含量和抗虫相关酶活性的影响
邓雅楠,严俊鑫,杨慧颖,2,许凌欣
(1.东北林业大学园林学院,黑龙江 哈尔滨 150040; 2.长春市南湖公园,吉林 长春 130000)
诱导抗性是植物遭受植食者侵害后出现的应激反应,直接影响害虫取食行为、消化能力、落卵量、生殖力、发育速度以及被捕食比率等,间接抑制害虫的存活率[1-3]。研究发现,水杨酸(salicylic acid,SA)可显著延长西花蓟马(Frankliniellaocidentalis)的发育时间,抑制蛹期体重,降低西花蓟马的生存适合度[4]。用水杨酸处理后的棉花(Gossypiumhirsutum)喂养棉蚜(Aphisgosspii)后,棉蚜体重以及产仔量下降,若蚜发育历程受到抑制[5]。近些年来,水杨酸类物质因为具有高效、方便、无毒无污染、无残留等优点,逐渐成为研究者关注的热点[6]。水杨酸是一种简单的酚类化合物,易于转化为水杨酸甲酯(methyl salicylate,MeSA),后者为其功能性类似物,是以SA和甲醇为原料进行酯化反应而成的酯类化合物,作为一种用途广泛的新型植物激素,在植物应对胁迫过程中发挥信号分子作用,强化植物抗逆性以及诱导防御反应发生[2,6-9]。经SA及其功能性类似物处理后菜豆(Phaseolusvulgari)[10]、野生稻(Oryzarufipogon)[11]、杨树(PopulusSimonii×PopulusPyramibalis)[12]、燕麦(Avenanuda)[13]、香蕉(Musaacuminatacoll)[14]、冬麦(Triticumaestivum)[15]、玉米(Zeamays)[16]、小麦[17]等植物相关酶活性增强,次生代谢物质含量增加。单宁又被称为植物多酚,是植物体内常见的次生代谢物质,可与害虫体内消化酶结合从而干扰害虫对营养物质的消化及吸收[18];过氧化物酶(POD)、超氧化物岐化酶(SOD)和过氧化氢酶(CAT)是植物体内重要的保护酶类,通过反馈调节使植物体内自由基保持正常水平从而提高自身抗虫性[19-20]。多酚氧化酶(PPO)可催化酚类物质氧化为醌,从而抑制害虫消化能力,提高植物抗虫性[21]。苯丙氨酸解氨酶(PAL)是植物中催化苯丙烷类代谢途径的关键酶,随着PAL活性升高植物体内众多次生代谢物质含量也随之升高,进而提高自身抗虫能力[22-23]。
东北玉簪(Hostaensata)又名剑叶玉簪,是我国北方地区园林应用以及民间药用常见的植物种类。在夏季常因蛞蝓(Agriolimaxagrestis)等食叶害虫侵袭而使东北玉簪生长受到抑制。一直以来,人们主要通过喷洒农药进行害虫防治,但农药的使用不仅降低了东北玉簪的药用价值,还会对生态系统造成破坏,而植物诱导抗性的研究为解决这一问题提供了新思路[24]。因此本研究以北方常见植物东北玉簪为材料,通过环保型外源物质MeSA进行诱导,从东北玉簪叶片单宁含量及抗虫相关酶活性变化入手,探究MeSA对东北玉簪抗性的影响,为绿色防控提供参考依据。
1 材料与方法
1.1 材料培养与MeSA处理
以三年生东北玉簪(有走茎小型玉簪)苗为试验材料,试验在东北林业大学苗圃内进行,于7月选取健康及长势一致的东北玉簪苗进行试验。
参考杨世勇等[2]、杨帆[4]、王燕芳[5]、严俊鑫等[23]的研究过程与结论,根据实际情况进行调整,确定本研究的浓度梯度以及取样时间点[2,4-5,23]。MeSA(≥99%,Sigma-Aldrich)用无水乙醇和蒸馏水稀释成浓度为0.01、0.1、1.0、1.5、2.0 mmol·L-1的溶液。以无水乙醇加蒸馏水为对照,采用喷雾法对东北玉簪植株进行均匀喷施,直至叶面有液滴落下为止。不同浓度处理的植株用塑料布遮盖异地放置,分别于喷施MeSA后的第1、3、5、7、10、15天的同一时间采集东北玉簪叶片进行生化分析,每处理3个重复。
1.2 测定方法
1.2.1单宁含量测定 采用F-D法[25],称取叶片0.5 g、加50 mL蒸馏水、于60 ℃保温箱中过夜,过滤取上清液加入40 mL 80 ℃蒸馏水、于80 ℃水域中浸提20 min,如此反复3次,最后定容至250 mL。取1 mL上清液,加入70 mL蒸馏水、5 mL F-D试剂及10 mL饱和Na2CO3溶液,定容至100 mL,充分摇匀,30 min后在680 nm波长下读取光密度。单宁含量用mg·g-1表示。
1.2.2苯丙氨酸解氨酶(PAL)活性测定[25]称取叶片0.5 g,加5 mL预冷的巯基乙醇硼酸缓冲液、0.1 g聚乙烯比咯烷酮(PVPP)及少量石英砂研磨成匀浆,于10 000 g下离心10 min,上清液即为粗酶液。取粗酶液0.1 mL,加入0.02 mol·L-1的L-苯丙氨酸1 mL和0.1 mol·L-1的硼酸缓冲液(pH=8.8)2 mL,混匀后于290 nm处测起始吸光度值,将测定后的各管于30 ℃水浴中保温30 min,再与290 nm处测定各管吸光度值。以每30 min吸光度值变化0.01所需酶量为1个酶活性单位,3次重复。
1.2.3多酚氧化酶(PPO)活性测定[25]称取叶片0.5 g,加入0.05 mol·L-1磷酸缓冲液(pH=5.5)及少量石英砂研磨成匀浆,4 000 r·min-1离心15 min,上清液即为粗酶液。取粗酶液0.1 mL,加1.5 mL 0.1 mol·L-1邻苯二酚,1.4 mL磷酸缓冲液,37 ℃反应10 min。以磷酸缓冲液代替酶液作为对照(调零),420 nm下测定吸光值。3次重复。
1.2.4过氧化物酶(POD)活性的测定 采用愈创木酚法[26-27],称取叶片0.5 g于预冷研钵中,加少量石英砂和0.05 mmol·L-1的磷酸缓冲液(pH=5.5)研磨成匀浆,4 ℃下4 000 r·min-1离心10 min,上清液即为粗酶液。取待测酶液0.1 mL,加愈创木酚和H2O2各1.0 mL,磷酸缓冲液2.9 mL,在470 nm下记录2 min内吸光值的变化。3次重复。
1.2.5超氧化物歧化酶(SOD)活性测定 采用氮蓝四唑(NBT)法[26-28],粗提液的提取同POD。酶活性测定的反应体系为:粗酶液0.05 mL,0.05 mol·L-1磷酸缓冲液(pH=7.8)1.5 mL,EDTA-NA2溶液、NBT溶液、Met溶液、核黄素溶液各0.03 mL,蒸馏水0.25 mL。将装有上述试剂的试管置于4 000 lx荧光灯下进行显色反应,反应结束后以暗中对照管作空白(调零),在560 nm处测定个管吸光度值。3次重复。
1.2.6过氧化氢酶(CAT)活性的测定 采用紫外分光光度计法[26],称取叶片0.5 g,加入0.2 mol·L-1磷酸缓冲液(pH=7.8)及少量石英砂研磨成匀浆,4 000 r·min-1离心15 min后上清液即为粗酶液。取粗酶液0.2 mL,加磷酸缓冲液1.5 mL,蒸馏水1.0 mL,25 ℃预热后,逐管加入0.3 mL H2O2,加完后立即计时,在240 nm处测定吸光值。3次重复。
1.3 数据统计分析
数据采用SPSS 19.0软件进行统计平均值和标准误差,对处理结果进行单因素差异显著性分析,并用LSD法对各测定数据进行多重比较。
2 结果与分析
2.1 MeSA处理对东北玉簪单宁含量的影响
MeSA处理后的东北玉簪叶片单宁含量有不同程度的升高(表1)。经0.01 mmol·L-1MeSA处理后的单宁含量在第1、3、7天显著高于对照(P<0.05),在第3天达最大值,为对照的1.15倍,在第5、10、15天趋于对照(P>0.05);经0.1 mmol·L-1MeSA处理后的单宁含量在第1、7、10、15天显著高于对照(P<0.05),在第10天达最大值,为对照的1.27倍,在第3、5天虽高于对照但差异不显著(P>0.05);经1.0 mmol·L-1MeSA处理后的单宁含量在第1、3、5天显著高于对照(P<0.05),在第5天达最大值,为对照的1.38倍,在第7、10、15天恢复对照水平(P>0.05);经1.5、2.0 mmol·L-1MeSA处理后的单宁含量在15天内均显著高于对照(P<0.05),且均在第5天达最大值分别为对照的2.44、2.47倍。
2.2 MeSA处理对东北玉簪PAL活性诱导效应
经0.01 mmol·L-1MeSA处理后的酶活性在第3、7天显著高于对照(P<0.05)(表2),在第3天达最大值为对照的1.18倍,在其余各时间点趋于对照水平(P>0.05);经0.1、1.0、1.5 mmol·L-1MeSA处理后的酶活性在第1、3、5、7天显著高于对照(P<0.05),在第5天达最大值且分别为对照的1.62、1.67、1.89倍,在第10、15天均恢复对照水平(P>0.05);经2.0 mmol·L-1MeSA处理后的酶活性在第15天内虽高于对照但差异不显著(P>0.05)。
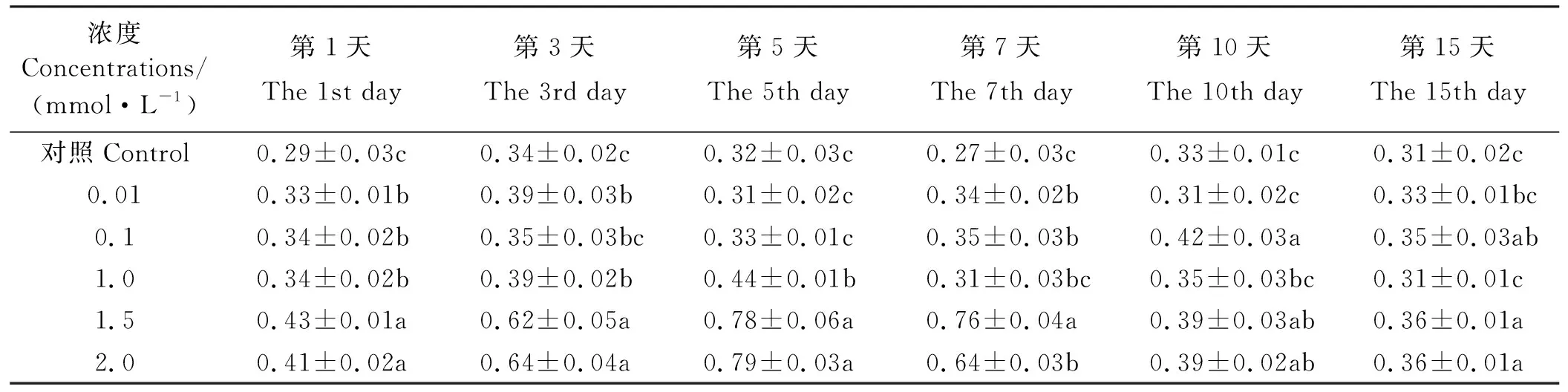
表1 MeSA对东北玉簪单宁含量的影响Table 1 Effect on tannin content of Hosta ensata induced by MeSA mg·g-1
同列不同字母表示不同浓度间差异显著(P<0.05)。下同。
Different lowercase letters in the same column indicate significant difference between different treatment concentr ations at the 0.05 level; similarly for the following tables.
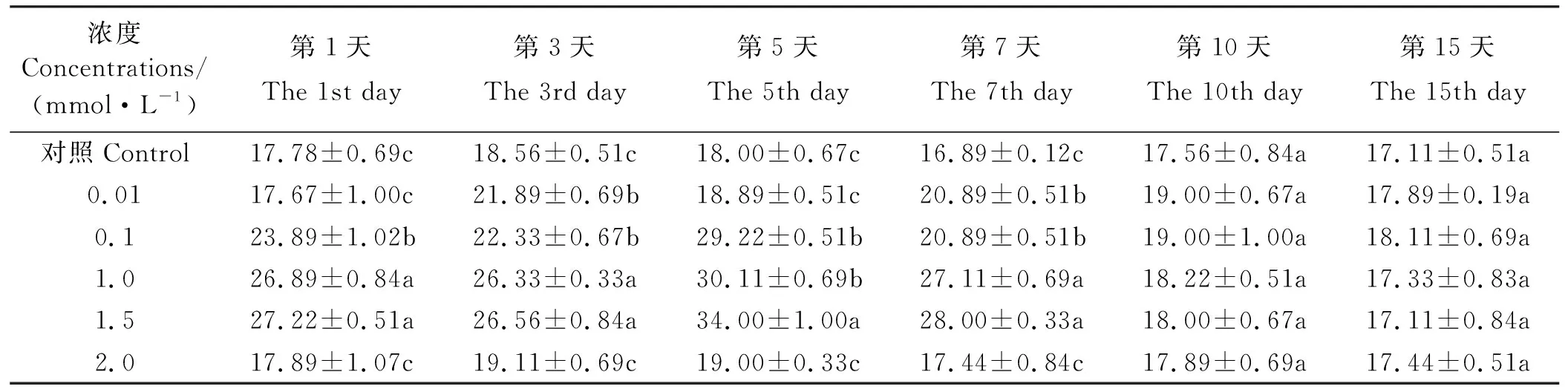
表2 MeSA对东北玉簪PAL 活性的影响Table 2 Effect on PAL activity of Hosta ensata induced by MeSA U·(g·min)-1
2.3 MeSA处理对东北玉簪PPO活性诱导效应
经0.01 mmol·L-1MeSA处理后的酶活性在第3、5、7天显著高于对照(P<0.05)(表3),在第3天达最大值,为对照的1.88倍,在第1、10、15天虽高于对照但差异不显著(P>0.05);经0.1 mmol·L-1MeSA处理后的酶活性在第3、5、7、10天显著高于对照(P<0.05),在第3天达最大值为对照的1.46倍,在第1、15天高于对照但差异不显著(P>0.05);经1.0 mmol·L-1MeSA处理后的酶活性在第3、5、10天显著高于对照(P<0.05),在第3天酶活性达最大值为对照的2.04倍,在第1、7、15天趋于对照水平(P>0.05);经1.5 mmol·L-1MeSA处理后的酶活性在第3、7天显著高于对照(P<0.05),在第3天达最大值,为对照的1.36倍,在其余各时间点趋于对照水平(P>0.05);经2.0 mmol·L-1MeSA处理后的酶活性仅在第7天显著高于对照(P<0.05),为对照的1.19倍,在其余各时间点均趋于对照水平(P>0.05)。
2.4 MeSA处理对东北玉簪POD活性诱导效应
MeSA处理后的东北玉簪叶片POD活性呈现先升高后降低趋势(表4)。经0.01 mmol·L-1MeSA处理后的酶活性仅在第3天显著高于对照(P<0.05),为对照的1.29倍,在其余各时间点趋于对照水平(P>0.05);经0.1 mmol·L-1MeSA处理后的酶活性在第3、5、7、10天显著高于对照(P<0.05),在第3天达最大值为对照的1.55倍,在第1、15天虽高于对照但差异不显著(P>0.05);经1.0 mmol·L-1MeSA处理后的酶活性在第1、3、5、7、10天显著高于对照(P<0.05),在第3天达最大值,为对照的1.59倍,在第15天略低于对照但差异不显著(P>0.05);经1.5 mmol·L-1MeSA处理后酶活性在第1、3、7天显著高于对照(P<0.05),在第3天达最大值为对照的1.32倍,在第5、10、15天趋于对照水平(P>0.05);经2.0 mmol·L-1MeSA处理后的酶活性仅第7天显著高于对照(P<0.05),为对照的1.06倍,在其余各时间点趋于对照水平(P>0.05)。
2.5 MeSA处理对东北玉簪SOD活性诱导效应
MeSA处理后的东北玉簪叶片SOD活性呈现先升高后降低趋势(表5)。经0.01 mmol·L-1MeSA处理后的酶活性在第3、5、7天显著高于对照(P<0.05),在第3天达最大值,为对照的1.37倍,在第1、10、15天虽高于对照但差异不显著(P>0.05);经0.1 mmol·L-1MeSA处理后的酶活性在第1、3、5、7天显著高于对照(P<0.05),在第3天达最大值,为对照的1.71倍,在第10、15天趋于对照水平(P>0.05);经1.0、1.5 mmol·L-1MeSA处理后的酶活性在第1、3、5、7、10天显著高于对照(P<0.05),在第3天达最大值,分别为对照的1.77、1.70倍,在第15天略低于对照但差异不显著(P>0.05);经2.0 mmol·L-1MeSA处理后的酶活性在第3、5、7、10天显著高于对照(P<0.05),在第3天达最大值,为对照的1.44倍,在第1、15天虽高于对照但差异不显著(P>0.05)。
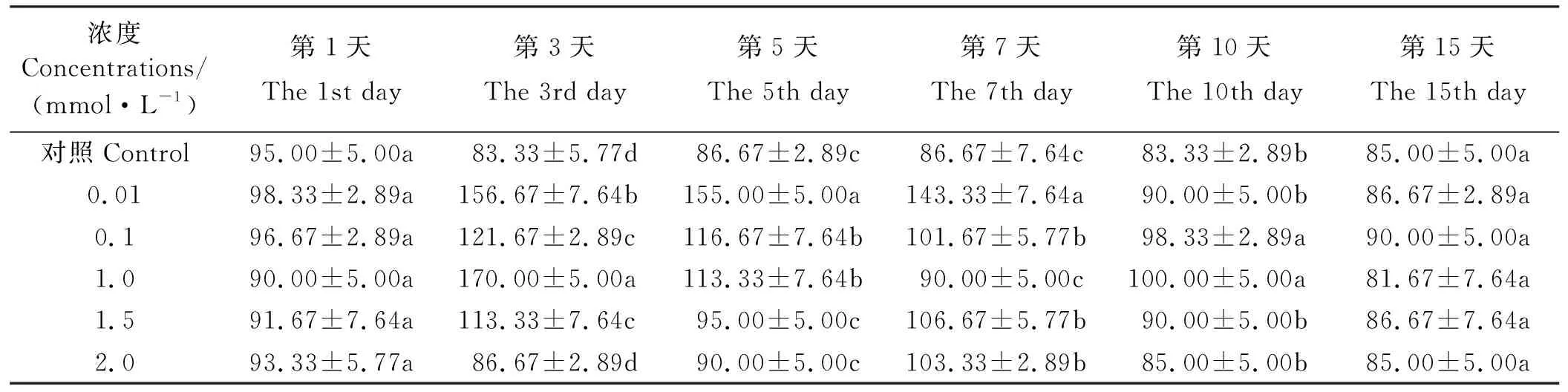
表3 MeSA对东北玉簪PPO 活性的影响Table 3 Effect on PPO activity of Hosta ensata induced by MeSA U·(g·min)-1
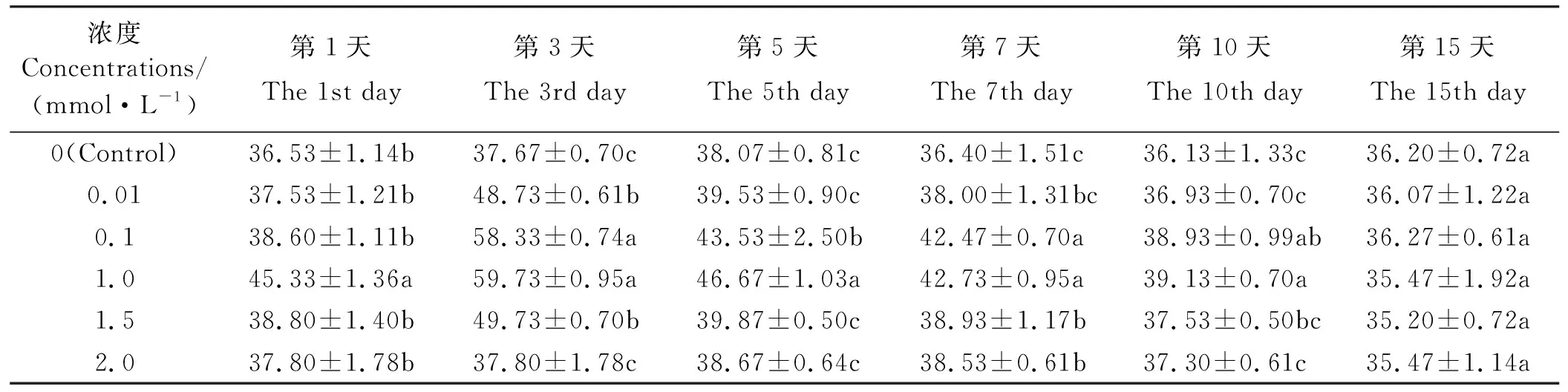
表4 MeSA对东北玉簪POD 活性的影响Table 4 Effect on POD activity of Hosta ensata induced by MeSA U·(g·min)-1
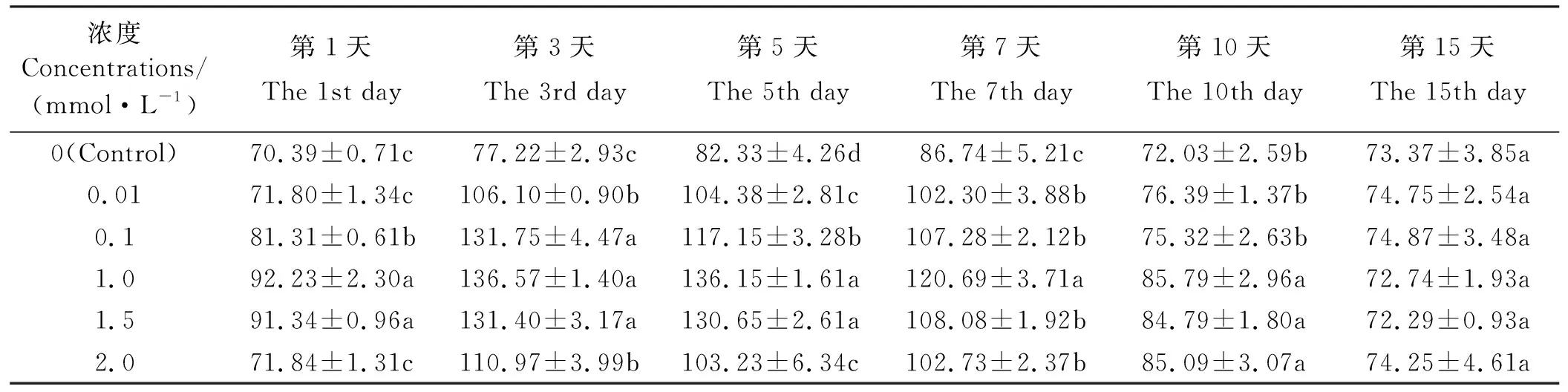
表5 MeSA对东北玉簪SOD 活性的影响Table 5 Effect on SOD activity of Hosta ensata induced by MeSA U·g-1
2.6 MeSA处理对东北玉簪CAT活性诱导效应
经0.01 mmol·L-1MeSA处理后的酶活性在第3、5、7天显著高于对照(P<0.05)(表6),在第3天达最大值,为对照的1.25倍,在第1、10、15天趋于对照水平(P>0.05);经0.1 mmol·L-1MeSA处理后的酶活性在第3、5、7天显著高于对照(P<0.05),在第5天达最大值,为对照的1.61倍,在第1、10、15天趋于对照水平(P>0.05);经1、1.5mmol·L-1MeSA处理后的酶活性在第1、3、5、7天显著高于对照(P<0.05),在第5天达最大值,分别为对照的1.64、1.90倍,第10、15天恢复对照水平(P>0.05);经2 mmol·L-1MeSA处理后的酶活性在第5、7天显著高于对照(P<0.05),在第5天达最大值,为对照的1.17倍,在其余各时间点均趋于对照水平(P>0.05)。
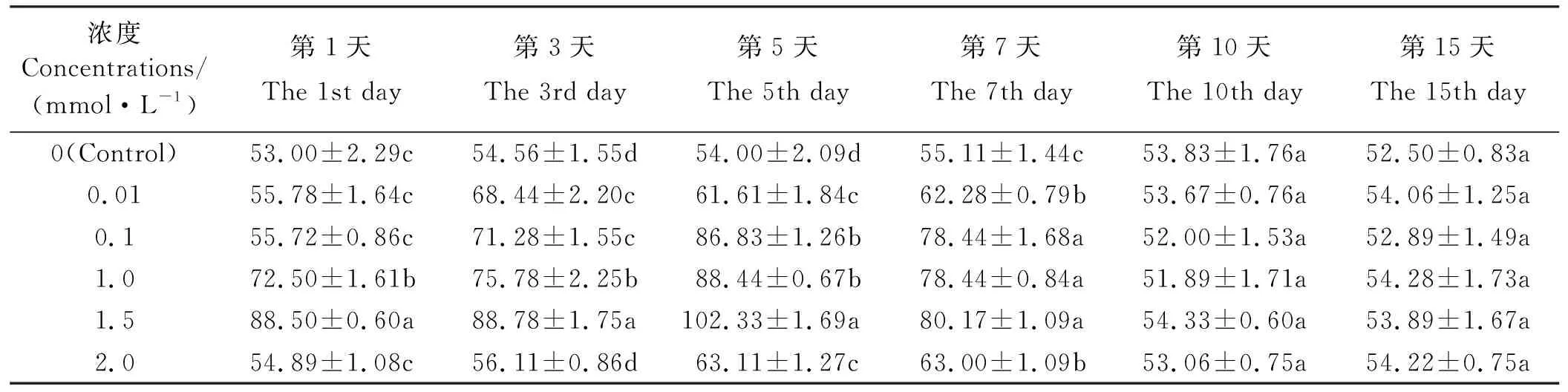
表6 MeSA对东北玉簪CAT 活性的影响Table 6 Effect on CAT activity of Hosta ensata induced by MeSA U·(g·min)-1
3 讨论
水杨酸类物质作为植物应对胁迫时的重要信号分子,能诱导多种植物产生持续抗性,激发植物体内PAL、PPO、POD等酶活性的表达[5]。研究表明,MeSA熏蒸后的合作杨(Populussimonii×P.pyramidalis‘Opera 8277’)叶片内PAL、PPO、POD活性升高,经SA处理后的棉花叶片PAL、PPO呈先升高后降低趋势[5,29]。本研究结果表明,不同浓度的MeJA能诱导东北玉簪叶片PAL、PPO、POD活性增加,基本呈先升高后降低趋势,这与前人的研究结果一致。经SA诱导后,重瓣玫瑰(Rosarugosa‘Plena’)叶片PAL、PPO、POD活性呈先升高后降低趋势,当SA浓度为1.0、1.5、1.0 mmol·L-1时,PAL、PPO、POD活性分别在第3、3、5天达到最大值,且持效期分别为第9、7、7天[30]。本研究中,当MeSA浓度为1.5、1.0、1.0 mmol·L-1时,PAL、PPO、POD活性分别在第5、3、3天达到最大值,且持效期分别为7、10、10天。这些研究结果与严俊鑫等[30]的研究结果在变化趋势上相一致,但在诱导的最适剂量、诱导后酶活性出现峰值的时间以及持效期上有所差异,这可能是由于不同植物种类对SA类物质的防御反应存在差异性。
水杨酸类物质作为植物体内信号分子可通过调控H2O2降解酶的活性而累积H2O2,H2O2作为第二信使可诱导SOD的合成来提高植物对逆境的抵抗能力[31]。在对野生稻的研究中发现,2.5×10-5mol·L-1MeSA可使SOD活性在36 h时上升到最高随后略有回落[12];2.0 mmol·L-1SA处理后的水稻(Oryzasativa)叶片内SOD活性表现为先升高后降低,在第3天达到峰值[32]。本研究表明,经MeSA处理后的东北玉簪叶片内SOD活性呈先升高后降低趋势,浓度为1.0 mmol·L-1MeSA对SOD活性诱导效果最佳,在第3天使其达到峰值,持效期约为10 d。这些结果在变化趋势和诱导后酶活性出现峰值的时间上与在野生稻和水稻上的研究结果相类似,但最适浓度以及持效期略有差异,这除了与植物种类间防御反应差异性有关外,可能还与外源物质浓度梯度和取样时间点的选取有关。CAT作为H2O2降解酶,可清除细胞内多于的H2O2,在维持细胞内过氧化物动态平衡过程中与SOD和POD共同发挥重要作用,因此多数学者认为水杨酸类物质在诱导SOD合成的过程中调控的H2O2降解酶即为CAT,也就是说水杨酸类物质通过抑制CAT活性,提高植物细胞内H2O2含量,从而达到提高SOD活性的目的[6]。本研究结果发现,MeSA处理后东北玉簪叶片内CAT活性基本呈先升高后降低趋势,浓度为1.5 mmol·L-1MeSA对CAT活性诱导效果最佳,在第5天使其达到峰值,持效期约为7 d。这一变化趋势与多数学者的观点并不一致,但却与张颖等[33]对苹果(Maluspumila)叶片CAT活性研究结果相类似。由此推测本研究中CAT活性的升高可能是由于MeSA诱导了东北玉簪叶片的氧猝发,而第7天后CAT活性降低趋于对照水平可能是随着时间的延长氧猝发逐渐减弱造成的。单宁作为植物体内关键防御物质之一,可通过与蛋白质的特异性结合从而影响昆虫的取食、消化等[23]。对黄瓜(Cucumissativus)的试验中发现,SA对黄瓜叶片内单宁含量诱导效果不明显,处理后的叶片内单宁含量略有升高,但与对照相比均差异不显著[4]。而本研究所使用的5种浓度的MeSA均引起了东北玉簪叶片内的单宁含量显著升高,浓度为2.0 mmol·L-1MeSA对单宁诱导效果最佳,在第5天使其达到峰值,持效期约为15 d。这些结果与杨帆[4]对黄瓜的研究结果不同,但与王燕芳[5]的研究结果类似,只是最适浓度、峰值出现的时间以及持效期有较大差异,可能是不同植物对MeSA应激反应不同。
4 结论
本研究使用不同浓度的MeSA对东北玉簪进行处理,得出适宜浓度的MeSA可以提高东北玉簪抗虫相关酶活性及次生代谢物质含量的结论,研究结果认为1.0 mmol·L-1MeSA对PPO、POD、SOD活性诱导效果较好,1.5 mmol·L-1MeSA对PAL、CAT活性诱导效果较好,而2.0 mmol·L-1MeSA对单宁含量诱导效果较好。MeSA对观赏植物抗逆性的调控较为复杂,若要以绿色防控完全取代传统防治措施还需要进行更为深入的探讨。
——“单宁”

