基于肝门静脉注射肿瘤细胞的新型进展期肝脏肿瘤动物模型的建立
柴燕涛,姜棋予,冯 帆,孙慧伟,李晓娟,杨锐创,王志杰,李瑞生,侯 俊
(解放军第三〇二医院临床研究管理中心,北京 100039)
肝脏肿瘤(liver cancer)主要分为原发性肝脏肿瘤和转移性肝脏肿瘤[1-2],其中原发性肝脏肿瘤主要是来源于肝细胞的肝细胞癌(hepatocellular carcinoma,HCC)[3-4];而转移性肝脏肿瘤则是其他脏器来源的肿瘤细胞经由胆道、血道或淋巴道迁移至肝脏内部行成的肿瘤组织,具体包括肝内胆管细胞癌(intrahepatic cholangiocarcinoma,IHC)[5]、结直肠癌肝转移(colorectal cancer liver metastases)[6]、肺癌肝转移(liver metastases of lung cancer)[7]以及乳腺癌肝转移(breast cancer liver metastases)[8]等。由于目前临床诊疗技术的限制,大多数肝脏肿瘤患者初诊即为进展期,其主要特征是肿瘤多发或弥散的肿瘤病灶[9 -10]。现有的肝脏肿瘤抗肿瘤药物的研究模型主要是裸鼠皮下成瘤(subcutaneous tumor),但存在不足之处,难以直观反映与模拟进展期肝脏肿瘤的特性[11-12]。因此迫切需要新的和有效的动物模型以更好地模拟与反映出进展期肝脏肿瘤的特点。本研究通过肝门静脉注射人肝细胞癌MHCC97-H、人结直肠癌SW480、人非小细胞肺癌A549以及人三阴性乳腺癌MDA-MB-231等细胞,在免疫缺陷小鼠肝脏原位形成了多发与弥散肿瘤病灶,成功获得了进展期肝细胞癌、结直肠癌肝转移、乳腺癌肝转移以及非小细胞肺癌肝转移的动物模型,为进展期肝脏肿瘤抗肿瘤药物研究奠定了坚实基础。
1 材料和方法
1.1 实验材料
1.1.1 细胞系
MHCC97-H(高侵袭性的人HCC细胞系)[13-14]、SW480(结直肠癌细胞系)[15]、A549(非小细胞肺癌细胞系)[16]以及MDA-MB-231(高侵袭性三阴性乳腺癌细胞)[17]等为本实验室保存。
1.1.2 实验动物
选取SPF级BALB/c裸小鼠25只,雌性,4~5周龄,体重18~20 g(误差不得大于10%),购于北京斯贝福生物技术有限公司[SCXK (京) 2016-0002]。其中16只用于MHCC97-H细胞接种实验:分为四个不同浓度组:A:5 × 105个细胞/只、B:1 × 105个细胞/只、C:5 × 104个细胞/只以及D:1 × 104个细胞/只,每组4只,每只动物注射细胞悬液的体积为500~600 μL;其余9只分为三组,用于MDA-MB0231、SW480和A549细胞接种实验,浓度选择5 × 105个细胞/只,每组3只,每只动物注射细胞悬液的体积为500~600 μL。饲养及无菌手术在解放军第三〇二医院临床研究管理中心实验动物中心屏障动物实验设施中进行[SYXK (军) 2017-0010]。饲养室温度22℃~23℃,环境湿度50%,自由进食和饮水,并按实验动物使用的3R原则给予人道的关怀。本实验通过医院伦理委员会审查(项目伦理审查批准号:IACUC-2017-005)。
1.2 主要试剂与仪器
细胞实验的DMEM培养基、胎牛血清以及胰蛋白酶等购买自美国Hyclone公司;异氟烷(isoflurane)购买自深圳瑞沃德公司;小动物PET/CT实验使用的核素探针18F-FDG等为北京大学肿瘤医院核医学科提供。细胞培养瓶为美国Corning公司产品;细胞培养用恒温培养箱、相差倒置显微镜等由本实验室提供;全套解剖用手术器械由本实验室保存;吸入式小动物麻醉剂机、盖革计数器和PET/CT系统由北京大学肿瘤医院科医学科提供。
1.3 实验方法
1.3.1 细胞培养实验
MHCC97-H、SW480、MDA-MB-231以及A549等细胞使用添加10% FBS的DMEM,37℃,5% CO2条件培养。待细胞状态良好,使用胰蛋白酶消化细胞后,对细胞悬液进行计数,备用。
1.3.2 门静脉注射肿瘤细胞实验
BALB/c裸小鼠使用异氟烷吸入麻醉。在超净台中进行实验,小动物手术,术式为开放性手术。小鼠胸骨下缘正中处,开一个1.5 cm的开口。将肝叶轻轻挤出,剥离得到肝门静脉,使用注射器将不同数量的不同细胞经由肝门静脉注射入小鼠肝脏中,在这一过程中,将细胞重悬于较大体积(500~600 μL)的生理盐水中,缓慢推注入肝门静脉。手术过程中,主要进行钝性分离以严格避免小鼠出血;严密观察小鼠心率等生理状况。
1.3.3 小动物PET/CT检测
BALB/c裸小鼠经由尾静脉注射约200 μCi核素探针18F-FDG,30~40 min后对BALB/c裸小鼠进行PET/CT检测,按照18F-FDG核素扫描模式,进行12 min扫描采像[18-19]。在此基础上,收集动物获得肝脏组织,利用盖革计数器确定动物肝脏于血液的核素强度,同时收集动物肝脏组织拍照。
1.4 统计学方法
2 结果
2.1 肝细胞癌在裸鼠肝脏形成多发与弥散的病灶
结果显示:将不同浓度(A:5 × 105个细胞、B:1 × 105个细胞、C:5 × 104个细胞以及D:1 × 104个细胞)人肝细胞癌细胞系MHCC97-H经由肝门静脉注射接种入裸鼠肝脏,经过4~6周生长后,使用PET/CT进行活体成像能够检测小鼠肝脏部位有明确的核素信号。核素强度、信号与细胞接种量有量效关系(见图1)。在此基础上,对动物进行解剖,剥离肝脏可见其表面已形成明确的多发、弥散肿瘤病灶,病灶形成的数量或肝脏病变的程度与肝脏接种MHCC97-H细胞的数量具有量效关系(见图2)。这表明,经由肝门静脉接种MHCC97-H细胞能够在裸鼠肝脏形成多发与弥散的肿瘤病灶;肿瘤细胞在肝脏的生长过程中,可以使用PET/CT活体成像进行追踪与判别。

注:A~D:分别为经门静脉注入肝脏不同浓度MHCC97-H细胞后检测到明确的核素信号(A:5 × 105个细胞,B:1 × 105个细胞,C:5 × 104个细胞,D:1 × 104个细胞),白色箭头所示为动物肝脏部位的核素信号与病变情况;E:盖革计数器对核素信号进行定量展示。图1 裸鼠肝脏接种MHCC97-H细胞后PET/CT检测Note. A-D: Clear nuclide signals detected after injecting different concentrations of MHCC97-H cells into the liver via the portal vein (A: 5 × 105 cells; B: 1 × 105 cells; C: 5 × 104 cells; D: 1 × 104 cells). White arrow indicates the PET intensity of mouse liver. E: Quantitative display of the nuclide signal from a Geiger counter.Figure 1 Identification of intrahepatic growth of MHCC97-H cells via PET/CT screening in nude mouse liver
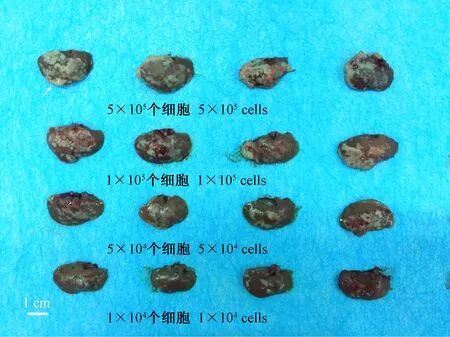
注:第一排:5 × 105个细胞;第二排:1 × 105个细胞;第三排:5 × 104个细胞;第四排:1 × 104个细胞。白色箭头指示动物肝脏部位多发与弥散的肿瘤病灶。图2 MHCC97-H细胞在裸鼠肝脏形成多发与弥散的肿瘤病灶Note. The first row: 5 × 105 cells; the second row: 1 × 105 cells; the third row: 5 × 104 cells; the fourth row: 1 × 104 cells. White arrow indicates multiple and diffuse nodules in nude mouse liver formed by the intrahepatic growth of MHCC97-H cells.Figure 2 Multiple and diffuse nodules in nude mouse liver formed by the intrahepatic growth of MHCC97-H cells
2.2 MDA-MB-231、A549以及SW480以及细胞癌在裸鼠肝脏形成多发与弥散的病灶
结果显示:在裸鼠肝脏中经由肝门静脉注射5 × 105个高侵袭性的乳腺癌MDA-MB-231细胞、非小细胞肺癌A549细胞或转移性结直肠癌SW480细胞系,经4~6周生长后进行PET/CT检测,能够发现小鼠肝脏部位有明确的核素信号(见图3)。在此基础上,对动物进行解剖,剥取肝脏可见其表面有明确的多发、弥散肿瘤病灶(见图4)。这表明,经由肝门静脉接种A549、MDA-MB-231以及SW480细胞,细胞能够在裸鼠肝脏形成多发与弥散的肿瘤病灶;肿瘤细胞在肝脏的生长过程中,可以使用PET/CT活体成像进行追踪与判别。

注:A:从左向右分别为经门静脉注入肝脏MDA-MB-231、A549、SW480细胞后检测到明确的核素信号(5 × 105个细胞),白色箭头指示动物肝脏部位的核素信号与病变情况;B:盖革计数器对核素信号进行定量展示。图3 裸鼠肝脏接种MDA-MB-231、A549以及SW480细胞后PET/CT检测Note. A: From left to right, the clear nuclide signals detected after injecting MDA-MB-231, A549, and SW480 cells into the liver through the portal vein (5 × 105 cells). White arrow indicates the PET intensity of mouse liver. B: Quantitative display of the nuclide signal from a Geiger counter.Figure 3 Identification of intrahepatic growth of MDA-MB-231, A549, or SW480 cells via PET/CT screening in nude mouse liver
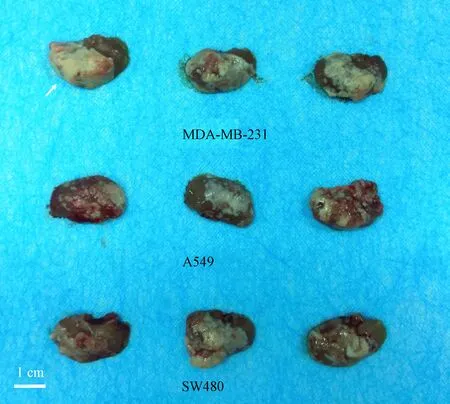
注:第一排:MDA-MB-231细胞;第二排:A549细胞;第三排:SW480细胞。白色箭头指示动物肝脏部位多发与弥散的肿瘤病灶。图4 MDA-MB-231、A549以及SW480细胞在裸鼠肝脏形成多发与弥散的肿瘤病灶Note. The first row: MDA-MB-231 cells; the second row: A549 cells; the third row: SW480 cells. White arrow indicates the multiple diffuse nodules in nude mouse liver formed by the intrahepatic growth of MDA-MB-231, A549, or SW480 cells.Figure 4 Multiple diffuse nodules in nude mouse liver formed by the intrahepatic growth of MDA-MB-231, A549, or SW480 cells
3 讨论
目前,受限于临床诊疗技术,大多数肝脏肿瘤患者初诊即为进展期,失去外科手术或肝移植等根治性治疗的机会[20]。进展期肝脏肿瘤的主要特征是肿瘤细胞形成多发或弥散的肿瘤病灶,并可能伴随有血管侵犯等[9-10]。药物治疗在进展期肝脏肿瘤综合治疗中具有重要意义,但现有的肝脏肿瘤抗肿瘤药物的研究模型不足,难以直观反映与模拟进展期肝脏肿瘤的特性。这体现在:①裸鼠皮下成瘤实验虽然是体内实验模型,但其与肝脏原位的肿瘤病灶有较大差别;②在肝脏接种组织微块或定点注射肿瘤细胞仅能够形成单一病灶,难以形成多发和弥散的肿瘤病灶;③现有常用的肿瘤转移或侵袭模型,主要是通过尾静脉注射肿瘤细胞悬液,以此在裸鼠中接种肿瘤细胞,但此时细胞迅速经由尾静脉-下腔静脉回心,进而通过肺动脉主要分布于肺部。为解决这些问题,本研究利用肝门静脉注射的方法,将肿瘤细胞经由肝门静脉接种于裸鼠肝脏,最终在肝脏形成多发与弥散的肿瘤病灶。这不仅实现了利用高侵袭性的MHCC97-H细胞形成多发与弥散的肿瘤病灶以模拟进展期肝细胞癌,也通过SW480、A549与MDA-MB-231细胞实现了结直肠癌、非小细胞肺癌与乳腺癌肝转移。
尾静脉注射肿瘤细胞后,细胞经由下腔静脉回心进而留驻于肺脏的组织间隙。与之类似的,经由肝门静脉将肿瘤细胞注射进入肝脏,肿瘤细胞也能够留驻在肝脏组织间隙。受到毛细血管分布、血流等因素的影响,加之小鼠肝脏较薄,肿瘤细胞主要是在小鼠肝脏的表面或浅表部位形成多发与弥散的肿瘤组织。此外,肝脏血流充沛,有肝门静脉与肝动脉双重供血,与肺脏相比肿瘤细胞不易形成肝脏组织局部栓塞,因此尤其适合于肿瘤细胞的生长与形成病灶。在手术中,本课题组对全套手术器械进行高压灭菌,全程在超净工作台中进行手术操作,能够有效避免感染;同时在消化细胞时(收集与获得培养的肿瘤细胞)尽可能充分消化细胞以避免细胞团块的存在带来栓塞的风险;利用较大体积的生理盐水重悬细胞后,缓慢推注进入肝门静脉,同时不断观察小鼠心率变化;在手术后,将小鼠分笼饲养以避免缝合后的创口的抓伤或撕咬。这些措施可使得动物存活率与造模成功率维持在较高水平。
小动物PET是前沿与先进的活体成像、分子影像技术,能够通过检测肿瘤组织、细胞对18F核素取代葡萄糖分子探针(18F-FDG)的摄取,对裸鼠肝脏肿瘤组织进行活体成像[21]。恶性肿瘤细胞具有旺盛的增殖能力,其对葡萄糖的摄取远强于正常组织或器官。在此基础上,肝脏是人体物质与能量代谢的中心器官,来源于肝细胞的肝细胞癌具有比其他恶性肿瘤或正常组织器官更为强烈的对葡萄糖的摄取作用,这使得采用PET扫描能够特异性与有效地识别和确证肿瘤组织。在实验中,本课题组在肝门静脉注射肿瘤细胞后能够利用小动物PET实现对裸鼠的活体成像,对细胞在肝脏中的生长进行无创与活体检测。裸鼠经过PET活体成像后收集动物肝脏发现,MHCC97-H细胞能够在裸鼠肝脏形成多发与弥散的的病灶(nodules),为利用动物模型模拟进展期肝细胞癌以及相关抗肿瘤、抗肿瘤药物研究奠定了坚实基础。
除MHCC97-H细胞外,本课题组还通过肝门静脉注射人三阴性乳腺癌MDA-MB-231、人非小细胞肺癌A549以及人结直肠癌SW480细胞,也在免疫缺陷小鼠肝脏原位形成了多发与弥散肿瘤病灶。肝脏是恶性肿瘤细胞转移与侵袭的重要器官,包括乳腺癌、结直肠癌以及肺癌等都能够肝转移[22-24]。在研究中,A549是非小细胞肺癌中腺癌亚型的细胞系,代表了肺癌最为主要的病理类型;SW480细胞是一种结直肠癌转移病灶来源的细胞系,是研究结直肠癌转移的理想模型;MDA-MB-231细胞是三阴性乳腺癌细胞系,具有强烈的转移与侵袭能力。MDA-MB-231、A549以及SW480细胞都能够在裸鼠肝脏形成多发与弥散的肿瘤病灶。在实验中对上述动物模型进行活体成像,接种MDA-MB-231、A549以及SW480细胞的裸鼠,其肝脏部位能够为18F-FDG核素探针所识别。这表明,本研究不仅建立了结直肠癌、乳腺癌与非小细胞肺癌的肝转移动物模型,也能够利用小动物PET等分子影像技术进行活体成像,动态跟踪肿瘤细胞在裸鼠肝脏的生长。

