体外消化和贮藏条件对粗壮脉纹孢菌孢子中类胡萝卜素稳定性的影响
杜 佳,余诚玮,陈 莉,邓泽元,李 静*
粗壮脉纹孢菌(Neurospora crassa)属真菌门、子囊菌门(Ascomycoya)、子囊菌纲(Ascomycetes)、粪壳目(Sordariales)、粪壳菌科(Sordariaceae)、脉纹孢菌属(Neurospora),为粗壮串珠霉的有性世代,孢子团呈黄色或淡橙色[1]。粗壮脉纹孢菌作为模式生物在国内外主要用于基础研究,如分子生物学、微循环产孢机制、生物钟机制等;也有用其进行发酵产纤维素酶、乙醇、黑色素、漆酶、谷氨酸脱羧酶等产物的研究[2-3]。研究人员通过透射电子显微镜观察粗壮脉纹孢菌的生长过程,发现粗壮脉纹孢菌的孢子中逐渐产生类胡萝卜素,因而孢子呈现红色或者橘黄色[4-6]。
类胡萝卜素具有多种生理功能,如参与机体内的光和物质传递、抗光敏化、淬灭自由基、保护机体免受不利环境因素的损伤[7]。此外类胡萝卜素还可以作为重要的营养素维生素的前体,可增强机体免疫力、延缓衰老、防癌抗癌、防治心血管疾病等,因而在医药、食品、饲料工业中都有广泛的应用。杨风玲[8]报道粗壮脉纹孢菌孢子壁对孢子内的类胡萝卜素具有较好的保护作用,但是,在消化过程中的生物利用率、抗氧化性以及贮藏条件对孢子中类胡萝卜素的含量及其抗氧化能力的影响还不明确。因此本实验拟研究粗壮脉纹孢菌孢子壁的组成成分,模拟体外消化过程研究孢子中类胡萝卜素在消化过程中形态、含量、抗氧化能力的变化,并且探讨不同贮藏条件对孢子中类胡萝卜素的含量和抗氧化能力的影响,为包埋不稳定物质的壁材提供科学数据,为其在功能食品中的应用提供理论指导。
1 材料与方法
1.1 菌株、材料与试剂
粗壮脉纹孢菌CGMCC3088由南昌大学重点实验室筛选分离;豆渣取自南昌市东北一家人饭店。
丙酮 西陇化学股份有限公司;浓盐酸 天津市大茂化工试剂厂;氢氧化钠 国药集团化学试剂有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
DFT-20粉碎机 南京仪器厂;DZG-6020型真空干燥箱 上海森信实验仪器有限公司;FA1104型电子天平上海精天电子仪器厂;pHS-2酸度计 上海雷磁仪器厂;TDL-5-A型离心机 上海分析仪器厂;KL-UP-III-10超纯水制备机 台湾艾柯实验专业纯水制备厂;HD-650桌上型超净工作台 苏州安泰空气技术有限公司;HWS-150型恒温水浴锅 巩义市英峪予华仪器厂;ZUV-2800 AH型紫外分光光度计 尤尼柯仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;F600纤维测定仪、K9860全自动凯氏定氮仪济南海能仪器公司;SXT-06索氏提取器 上海洪纪仪器设备有限公司;SPH620G红外消解仪 济南阿尔瓦仪器有限公司;S-3400N型扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 粗壮脉纹孢菌孢子壁主要成分的测定
水分质量分数的测定采用GB 5009.3—2010《食品安全国家标准 食品中水分的测定》直接干燥法;粗纤维质量分数的测定采用GB/T 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》;粗脂肪质量分数的测定采用GB/T 5009.6—2003《食品中脂肪的测定》索氏抽提法;蛋白质量分数的测定采用GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法。
几丁质质量分数的测定采用考马斯亮蓝法[9]和凯氏定氮法。将干燥孢子壁样品磨成粉末,取2 g样品用体积分数96%乙醇溶液浸提至乙醇无色为止。用质量分数3% NaOH溶液于100 ℃水浴浸提多次,再用1 mol/L HCl溶液浸提多次。用质量分数2%的KMnO4溶液浸泡12 h,再以含1 mol/L NaHSO3的HCl溶液浸泡去色,最后水洗、干燥便成为粗纯品。再在样品中加入丙酮,混匀后加入12 mol/L HCl溶液,待溶解后将其清液加人至3 倍体积冷蒸馏水中。在4 ℃冰箱中放置过夜,4 200 r/min离心10 min,除去上清液,用水洗净沉淀物至中性,干燥后即获得纯的蛋白质样品。孢子壁的总氮质量分数(ω1/%)由全自动凯氏定氮仪测定;孢子壁的蛋白氮质量分数(ω2/%)由考马斯亮蓝法测定,孢子壁中的几丁质质量分数根据式(1)计算。
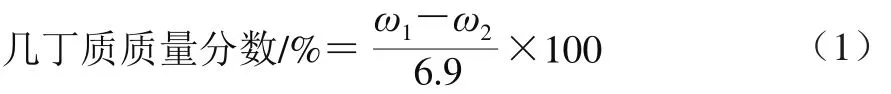
式中:6.9为几丁质中含氮质量分数的理论值。
1.3.2 粗壮脉纹孢菌孢子特性研究
1.3.2.1 差量法测孢子溶解性
准确称取0.2 g(m1)经豆渣发酵72 h所得孢子,放置于玻璃试管中,分别用5 mL(V) 37 ℃水、60 ℃水、100 ℃水、1 mol/L HCl溶液、丙酮、无水乙醇溶解,漩涡振荡2 min,抽滤,将固体不溶物质烘干至质量恒定(m2/g),根据式(2)计算孢子的溶解性。
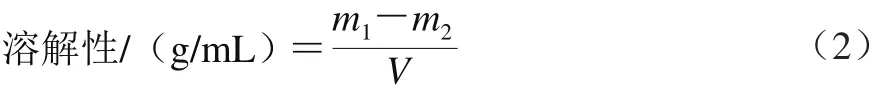
1.3.2.2 孢子中总类胡萝卜素的含量
采用酸热法提取孢子中总类胡萝卜素[10],取0.25 g孢子于玻璃离心管中,加1 mol/L HCl溶液2 mL,混匀后浸泡3 min,抽滤至中性,加丙酮浸提30 min,4 200 r/min离心10 min后取上清液,重复提取一次,合并2 次的上清液于比色管中,稀释至合适浓度,于461 nm波长处测吸光度。类胡萝卜素含量按照公式(3)计算[11-12]。
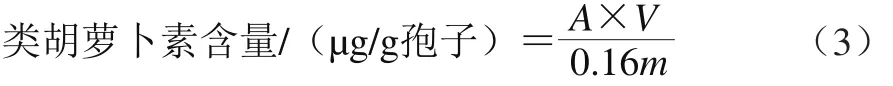
式中:A为稀释后丙酮提取液在461 nm波长处的吸光度;V为提取所用丙酮体积/mL;0.16是1 g类胡萝卜素分子消光系数;m为所用干孢子的质量/g。
1.3.2.3 扫描电子显微镜观察孢子形态及颗粒大小
将适量豆渣发酵72 h所得孢子置于培养皿中,采用扫描电子显微镜观察孢子形态及大小[13],鉴于孢子不导电,选用导电胶带将其粘在扫描电子显微镜样品台上,用E-1010型离子溅射镀膜仪在样品表面镀上一层1.5 nm厚的金属银膜。将处理好的样品放入样品盒中进行扫描观察,同时拍照。
1.3.3 粗壮脉纹孢菌产类胡萝卜素经体外消化性质变化
1.3.3.1 体外消化液的制备
模拟体外消化方法[14]如下:1)模拟口腔消化:取0.5 g粗壮脉纹孢菌孢子,加入5 mL模拟唾液消化液(simulated salivary fluid,SSF),漩涡振荡5 min,使其充分溶解,再加3.5 mL SSF、0.5 mL α-淀粉酶、25 μL 0.3 mol/L CaCl2、975 μL蒸馏水、水浴37 ℃振荡10 min。2)模拟胃消化:在10 mL上述口腔消化液中,加入7.5 mL模拟胃消化液(simulated gastric fluid,SGF)、1.6 mL 25 000 U/mL猪胃蛋白酶、5 mL 0.3 mol/L CaCl2溶液、0.2 mL 1 mol/L HCl溶液(pH 3)、0.695 mL水,37 ℃摇床120 r/min振荡2 h。3)模拟小肠消化:在上述20 mL胃消化液中,加入11 mL模拟肠道消化液(simulated intestinal fluid,SIF)、5.0 mL 800 U/mL胰蛋白酶、2.5 mL 160 mmol/L新鲜胆汁、40 μL 0.3 mol/L CaCl2溶液、0.15 mL 1 mol/L NaOH溶液、1.31 mL水,37 ℃摇床120 r/min振荡2 h。
1.3.3.2 扫描电子显微镜观察消化前后孢子形态
将消化液作用后的液体抽滤至中性,4 200 r/min离心10 min后取沉淀,并于60 ℃烘干成粉末状,扫描电子显微镜观察孢子形态,方法同1.3.2.3节。
1.3.3.3 粗壮脉纹孢菌孢子中类胡萝卜素的释放率
分别将经口、胃、小肠作用后的消化液进行抽滤,用丙酮进行冲洗,洗下孢子壁上的类胡萝卜素,取抽滤瓶中的消化液转移至圆底烧瓶,旋转蒸发挥干液体,加入20 mL丙酮溶解粘在烧瓶壁上的类胡萝卜素,重复加丙酮溶解提取一次,合并2 次的液体于比色管中定容,稀释至合适浓度于461 nm波长处测吸光度。
类胡萝卜素释放含量按照1.3.2.2节公式(3)计算,计算出消化液中类胡萝卜素含量与孢子中总类胡萝卜素的含量,两者进行比较得出消化过程中的类胡萝卜素释放率。
1.3.3.4 粗壮脉纹孢菌孢子中类胡萝卜素体外消化前后抗氧化能力的测定
天然抗氧化物质的抗氧化能力测定有体外和体内两种方式。体内实验影响因素很多,研究比较困难,因而不适于快速的判断物质的抗氧化能力[5]。体外抗氧化操作简便而快速,可以实现快速高效的筛选以及检测抗氧化物质的抗氧化特性[15]。参考文献[16-17],采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、螯合金属离子法对类胡萝卜素抗氧化能力进行评价。
采用DPPH法[18]测定抗氧化能力:取10 mg DPPH用无水乙醇溶解于100 mL容量瓶中得到储备液。取2.5 mL DPPH溶液(用无水乙醇配制,浓度为6.5×10-5mol/L),加入0.5 mL样品溶液,摇匀后暗处放置,反应10 min后于517 nm波长处测定吸光度。以丙酮代替样品溶液、无水乙醇代替DPPH溶液作为空白对照。DPPH自由基清除率根据式(4)计算。
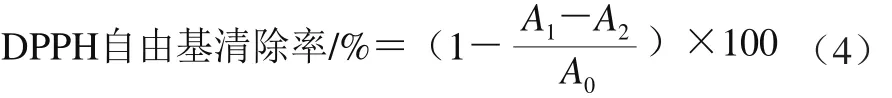
式中:A0为对照实验(样品溶剂代替样品)吸光度;A1为实验吸光度;A2为样品底色消除实验(用无水乙醇代替DPPH溶液)吸光度。
采用螯合金属离子法[19]测定抗氧化能力:取不同浓度的样液1 mL,分别加入0.1 mL 2 mmol/L FeCl2和0.2 mL 5 mmol/L菲啰嗪,混匀后室温静置,反应10 min后于562 nm波长处测定吸光度。以样品溶剂代替样品溶液作为样品空白,消除样品底色,用无水乙醇代替菲啰嗪作为空白对照。金属离子螯合率根据公式(5)计算。
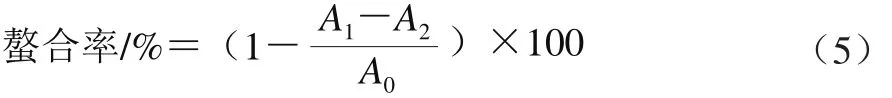
式中:A1为样品吸光度;A0为样品干扰对照(用样品溶剂代替样液)吸光度;A2为空白对照(用无水乙醇代替菲啰嗪)吸光度。
1.3.4 贮藏条件对粗壮脉纹孢菌孢子中类胡萝卜素的影响
将发酵培养得到的粗壮脉纹孢菌分为4 组,第1组置于25 ℃的恒温培养箱保存,第2组置于4 ℃的冰箱冷藏室保存,第3组贮藏温度为25 ℃锡箔纸避光保存,第4组贮藏温度为25 ℃不避光保存。测贮藏过程中类胡萝卜素含量变化及其抗氧化能力,方法分别同1.3.2.2、1.3.3.4节。
1.4 数据统计分析
用SPSS 20.0软件对数据进行分析以及图表绘制,检测结果用平均值±标准差表示;所有实验均重复3 次以上,并且用单因素方差分析比较平均值,P<0.01为极显著差异。
2 结果与分析
2.1 粗壮脉纹孢菌孢子壁的主要成分
经测定,粗壮脉纹孢菌孢子壁中水分、粗纤维、粗脂肪、蛋白质和几丁质质量分数分别为(17.70±0.63)%、(29.90±0.03)%、(0.32±0.11)%、(28.32±0.89)%和(0.66±0.13)%。在酵母菌中,细胞壁主要成分为β-葡聚糖、糖蛋白、几丁质、水分和粗灰分,质量分数分别为39%、24%、30%、6%和1%[20-21]。可见,真菌类细菌的细胞壁和孢子壁组成相接近。
2.2 孢子特性研究
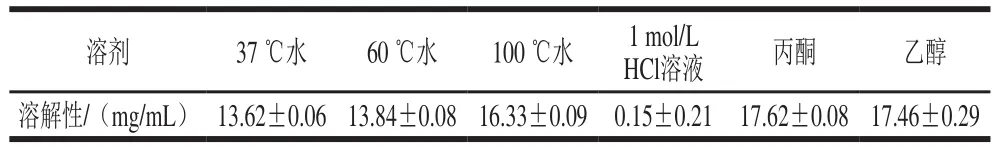
表1 粗壮脉纹孢菌孢子在不同溶剂中的溶解性Table 1 Solubility of Neurospora crassa spores in different solvents
由表2可知,孢子在水、丙酮溶液和乙醇溶液的溶解性均不理想,因此在开发粗壮脉纹孢菌孢子壁作为微胶囊壁材过程中,可能需要改良其壁材的成分和比例。
2.3 孢子中类总胡萝卜素的含量
孢子中总类胡萝卜素含量为(776.42±2.05)μg/g孢子。1954年,Zalokar[22]已经用实验证明了粗壮脉纹胞菌类胡萝卜素形成和其产量是由蓝光来调节的。吴丹等[23]从江西传统发酵食品中分离得到1株粗壮脉纹胞菌,后来,李红艳等[24]发现其在有氧的条件下可以产生类胡萝卜素,并发现在未优化的条件下粗壮脉纹胞菌类胡萝卜素产量可达158.5 μg/g孢子。此后,刘志刚等[10]对此菌发酵稻谷加工副产物(砻糠和脱脂米糠)生产类胡萝卜素的培养基进行了优化,优化后其类胡萝卜产量可达366 μg/g培养物。类胡萝卜素不是菌体自身生长发育所必需,它的产生是与粗壮脉纹孢菌适应外界环境紧密联系的。与黑暗中生长的粗壮脉纹孢菌菌株相比,光照下粗壮脉纹孢菌菌株的al-3基因mRNA转录量提高了15 倍,光照下粗壮脉纹孢菌孢子中类胡萝卜素含量比黑暗中生长的高[25-31]。Yoshida等[32]发现暴露在含氧空气中可以引发粗壮脉纹孢菌中类胡萝卜素的光诱导合成。本实验选用自然光72 h培养,确保通风氧气充足,从而提高了类胡萝卜素含量((776.42±2.05)μg/g孢子)。
2.4 孢子形态

图1 粗壮脉纹孢菌孢子形态及颗粒大小Fig. 1 Scanning electron micrographs of Neurospora crassa spores
图1 为扫描电子显微镜观察粗壮脉纹孢菌孢子的形态及颗粒大小,可以看出,粗壮脉纹孢菌的分生孢子大多为卵圆形或球形,且成聚集状态,粗壮脉纹孢菌孢子的颗粒直径在4~20 μm间。
2.5 粗壮脉纹孢菌产类胡萝卜素经体外消化性质变化
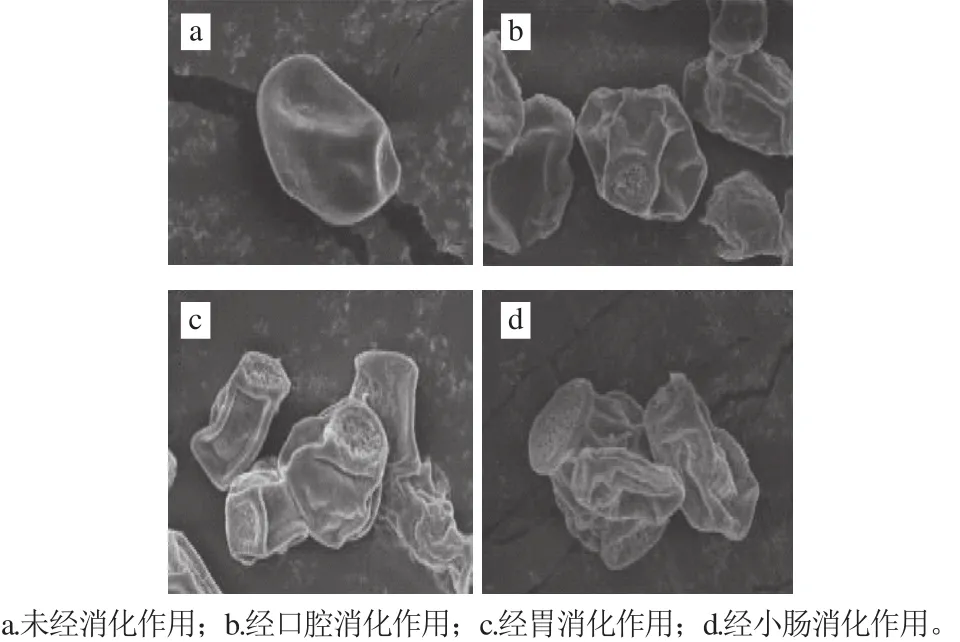
图2 粗壮脉纹孢菌孢子经体外消化后的形态(×5 000)Fig. 2 Scanning electron micrographs of Neurospora crassa spores in simulated gastric fluid (× 5 000)
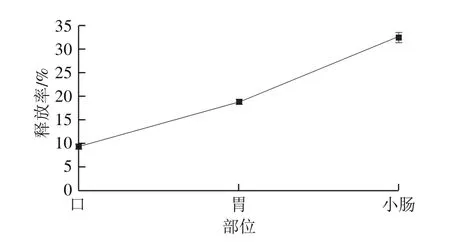
图3 体外消化过程类胡萝卜素释放率Fig. 3 Release rates of carotenoids during in vitro digestion
由图3可知,在体外消化过程中粗壮脉纹孢菌孢子中类胡萝卜素的释放率逐渐升高,口腔(9.35%)<胃(18.78%)<小肠(32.58%),经过体外消化后,共有32.58%的类胡萝卜素从孢子壁中释放出来。粗壮脉纹孢菌孢子经口腔消化液作用后有少量的类胡萝卜素释放,因为口腔条件作用较为温和且作用时间较短,类胡萝卜素不易被释放。在胃消化液酸性条件下使孢子壁进一步破壁,更多的类胡萝卜素被释放,根据类胡萝卜素的性质,类胡萝卜素在酸性条件下不稳定、易分解[33-35],有部分释放出的类胡萝卜素被胃酸作用分解,但总体上其含量仍然增加。孢子中类胡萝卜素在小肠中释放率达到最大值,其原因可能是孢子壁在小肠消化液中遇到胰酶后孢子壁上孔径进一步增加,促进孢子汇总类胡萝卜素的释放。
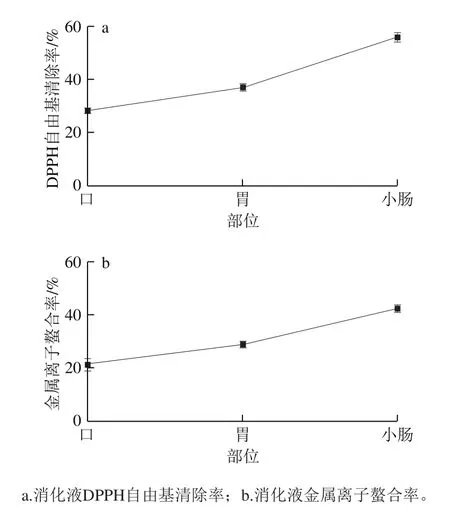
图4 类胡萝卜素抗氧化活性Fig. 4 Antioxidant activity of carotenoids in digested spores
由图4可知,粗壮脉纹孢菌经体外消化释放在消化液中类胡萝卜素的抗氧化活性呈持续上升趋势,且和图3体外消化过程类胡萝卜素释放率成正比。DPPH法测得消化液中类胡萝卜素抗氧化活性,口腔(28.27%)<胃(37.09%)<小肠(56.08%);螯合金属离子法测得消化液中类胡萝卜素抗氧化活性,口腔(21.40%)<胃(28.74%)<小肠(42.23%)。可见,消化液中类胡萝卜素抗氧化活性显著升高:口腔<胃<小肠,与孢子中类胡萝卜素释放率呈正相关,且胃和小肠消化液中类胡萝卜素抗氧化活性与口腔消化液类胡萝卜素抗氧化活性存在极显著性差异(P<0.01)。
2.6 贮藏条件对粗壮脉纹孢菌类胡萝卜素的影响
图5为贮藏过程中类胡萝卜素含量变化,可以看出随着贮藏时间的变化,粗壮脉纹孢菌中的类胡萝卜素含量逐渐减少,呈下降趋势,主要原因是在贮藏过程中类胡萝卜素会逐渐分解。对比几个贮藏条件下的粗壮脉纹孢菌中类胡萝卜素的变化趋势,可以发现在相同贮藏时间时类胡萝卜素的含量:4 ℃黑暗组>25 ℃黑暗组>25 ℃光照组,贮藏9 d后类胡萝卜素的减少率为:4 ℃黑暗组减少2.24%、25 ℃黑暗组减少3.19%、25 ℃光照组减少5.79%,比较可知,4 ℃黑暗条件下贮藏最利于保护粗壮脉纹孢菌中的类胡萝卜素,类胡萝卜素含量损失最少。光照加速类胡萝卜素链的氧化和降解,导致类胡萝卜素损失[36-37]。所以低温黑暗条件有利于类胡萝卜素的保存。
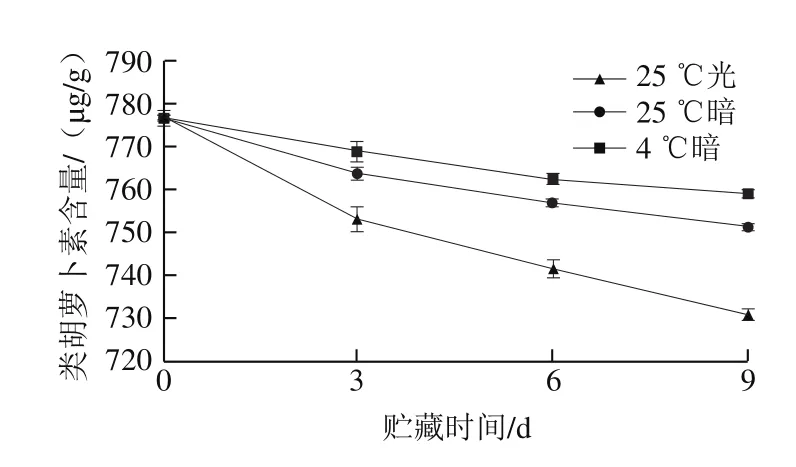
图5 贮藏过程中类胡萝卜素含量变化Fig. 5 Changes in carotenoid content during storage
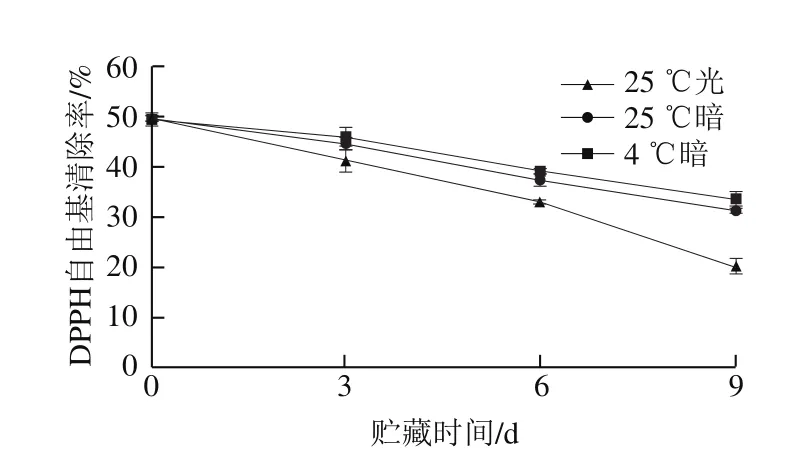
图6 贮藏过程中类胡萝卜素抗氧化活性变化Fig. 6 Changes in antioxidant activity of carotenoids during storage
图6 为贮藏过程中类胡萝卜素抗氧化变化,可以看出,在贮藏过程中,粗壮脉纹孢菌中类胡萝卜素的抗氧化活性均呈现下降的趋势。由图5可以看出随着贮藏时间的变化,粗壮脉纹孢菌的类胡萝卜素含量逐渐下降,故对比图5、6可知,类胡萝卜素含量与抗氧化活性呈正相关,贮藏过程中类胡萝卜素含量的下降是造成其抗氧化活性下降的主要原因。对比3 个贮藏条件,黑暗组和4 ℃组之间的差异很小,光照组相比于这3 组抗氧化活性较低,贮藏9 d类胡萝卜素的抗氧化活性下降率为:4 ℃黑暗组下降32.52%、25 ℃黑暗组36.95%、25 ℃光照组下降59.38%,故比较可得,4 ℃低温贮藏和黑暗条件贮藏粗壮脉纹孢菌对其中类胡萝卜素的抗氧化活性保护最好,光照条件贮藏粗壮脉纹孢菌不利于保护其中类胡萝卜素的抗氧化活性,抗氧化活性下降最多。孙明奇等[38]的研究结果也表明,类胡萝卜素对日光不稳定,光照对类胡萝卜素有降解作用,主要是促使类胡萝卜素分子中C=C的氧化断裂,使类胡萝卜素发生异构化。所以进行类胡萝卜素的相关研究以及后期的保藏过程中都要尽量避光保存。
3 结 论
本实验测得粗壮脉纹孢菌孢子壁主要成分为水分、粗纤维、粗脂肪、蛋白质及几丁质。经体外消化后,类胡萝卜素的释放率大小排序为小肠>胃>口腔,消化液中类胡萝卜素抗氧化活性大小排序为小肠>胃>口腔。4 ℃低温避光条件下贮藏最利于保护粗壮脉纹孢菌中的类胡萝卜素,类胡萝卜素含量损失最少,抗氧化活性下降最少。粗壮脉纹孢菌孢子壁在胃消化液酸性条件作用下可以很好地保护孢子中类胡萝卜素的稳定性,在体外消化过程中释放类胡萝卜素32.58%,因此粗壮脉纹孢菌孢子壁是一个潜在的包埋不稳定营养素的壁材。

