氨基甲酸乙酯诱导HepG2细胞凋亡的分子机制
刘会昌,石建新*
氨基甲酸乙酯(ethyl carbamate,EC)又名脲烷,是工业生产的重要原料,广泛用于生产农药、熏蒸剂和化妆品,也曾作为安眠和抗肿瘤药物及止疼药助溶剂供人们使用。值得注意的是,EC是食品加工过程中的一种副产物,广泛存在于发酵食品中,如白兰地、黄酒、葡萄酒、面包、酱油和酸奶等,也存在于香烟和空气污染物中[1]。动物实验结果表明,EC具有遗传毒性、致癌性和免疫毒性,可诱导小鼠、大鼠等啮齿类动物和猴子等灵长类动物的肿瘤发生[2-4]。因此,EC很可能对人类也有一定的致癌风险。国际癌症研究机构已于2007年将其列为很可能致癌物(2A类)[5]。
之前的EC毒性机制研究大都是在动物中开展的,其结果并不能真实反映EC对人体的毒性作用。出于动物福利的考虑,人体组织细胞体外培养技术越来越多用于EC对人类细胞的毒性研究。目前认为,EC对人体细胞的毒性主要表现有降低细胞活性、抑制细胞增殖、引起细胞内氧化应激反应、扰乱细胞周期、诱导线粒体代谢紊乱和细胞凋亡[6-9]。细胞毒性实验结果表明,EC促进细胞内活性氧自由基(reactive oxygen species,ROS)积累,对细胞内生物大分子(蛋白质、脂类和核酸等)造成损伤,影响细胞代谢活动[10]。EC能激活细胞P53代谢通路,激活P21蛋白,抑制细胞周期蛋白E和Cdk2蛋白的表达,从而阻碍细胞从G1期向S期转换,G0期细胞数目增多,细胞由分裂状态转向静息状态,从而影响细胞周期[7]。前期工作发现,HepG2细胞可以吸收EC并在体内积累,从而导致细胞凋亡,但EC的毒性机制并未阐明[6]。本研究在前期研究的基础上,采用实时荧光定量聚合酶链式反应(realtime fluorescence quantitative polymerase chain reaction,qPCR)和蛋白免疫印迹技术检测EC(100 mmol/L)处理对HepG2细胞凋亡通路基因的影响,进一步揭示EC对人体细胞的毒性作用机制。
1 材料与方法
1.1 材料与试剂
HepG2细胞(人体肝癌细胞株),购买自中国科学院上海生命科学研究院细胞资源中心。

表1 细胞凋亡相关基因及其RT-PCR引物序列Table 1 RT-PCR primer sequences for tested apoptosis-related genes
氨基甲酸乙酯 美国Sigma公司;胎牛血清 法国Biowest公司;胰酶 上海安普科技有限公司;青霉素-链霉素溶液 北京索莱宝生物科技公司;TRIzol Reagent 美国Invitrogen公司;反转录试剂盒 宝生物工程(大连)有限公司;Supereal PreMix Plus(SYBR Green)天根生化科技有限公司;NP-40和BCA蛋白质量浓度测定试剂盒 中国碧云天生物技术公司;Noxa抗体、IP3R抗体、TNFRSF10D(DcR2)抗体 英国Abcam公司;IRE1α抗体、Caspase-9抗体、APAF1抗体、Bim抗体、β-Actin抗体 美国Cell Signaling Technology公司;乙醇、氯仿、异丙醇(均为分析级) 上海国药集团有限公司;引物由美国Life Technology公司合成(表1)。
1.2 仪器与设备
超净工作台 苏州施威克环保科技有限公司;酶标仪、高速离心机 基因有限公司;CO2恒温培养箱 上海三腾仪器有限公司;LightCycler®480 qPCR仪 瑞士罗氏公司;电泳仪及转膜仪 美国伯乐公司。
1.3 方法
1.3.1 细胞培养与EC处理
采用完全DMEM培养基(含10%胎牛血清和1% 100×青霉素-链霉素溶液)培养HepG2细胞,恒温培养箱条件设置为37 ℃、5% CO2。细胞每周传代2~3 次。细胞培养至对数生长期进行药物处理。将EC溶解在完全培养基(含FBS和双抗的DMEM培养基)中,EC终浓度为100 mmol/L。对照组是不加EC的完全培养基。根据之前研究结果,药物处理时间分别设置为4 h和12 h。对照组和实验组均包含3 个生物学重复,每个生物学重复含3 个培养孔。
1.3.2 qPCR检测细胞凋亡相关基因mRNA变化
细胞处理4 h和12 h后,参照刘莹等[11]的方法收集细胞。按照试剂盒说明书用TRIzol法提取细胞总RNA。采用PrimeScriptTMRT试剂盒反转录总RNA,反转录条件为:37 ℃,15 min;85 ℃,5 s。反转录后的cDNA用于检测细胞凋亡相关基因的变化,检测的凋亡基因名称及其引物序列见表1。qPCR体系如下(20 μL):SYBR(2×)10 μL,正、反向引物各0.8 μL,cDNA模板2 μL,ddH2O补足至20 μL。qPCR条件设置如下:95 ℃10 s,60 ℃ 20 s,72 ℃ 20 s,40 个循环。采用相对定量法2−△△Ct对基因进行相对定量分析。
1.3.3 蛋白免疫印迹(Western blotting)分析
细胞处理4 h和12 h后,收集细胞,用NP-40充分裂解并提取细胞总蛋白,并用BCA蛋白质量浓度测定试剂盒测定各个样本的蛋白质量浓度。将蛋白样品调至等质量浓度后,每组等量上样,用含质量分数10%十二烷基硫酸钠的聚丙烯酰胺凝胶进行电泳(80 V 40 min;120 V 40 min)分离。采用湿转法将蛋白转至PVDF膜上(转膜条件:300 mA,冰浴0.5~1.5 h,目的蛋白分子质量越大时间越长)。用含质量分数5%脱脂奶粉的TBS-T封闭膜,摇床上室温1 h。孵育一抗(兔抗1∶1 000)室温2 h或4 ℃过夜。洗膜后,孵育二抗(1∶15 000,含荧光的羊抗兔)室温45 min,TBS-T洗膜后用Odyssey CLx成像系统进行拍照。
1.4 统计学处理
Western blotting图片采用Image J软件进行分析。qPCR和Western blotting结果采用 ±s表示,并通过SPSS 22.0软件进行独立样本t检验。P<0.05时认为变化达到显著性水平,P<0.01时变化达到极显著性水平。
2 结果与分析
2.1 氨基甲酸乙酯对细胞凋亡外源通路的影响
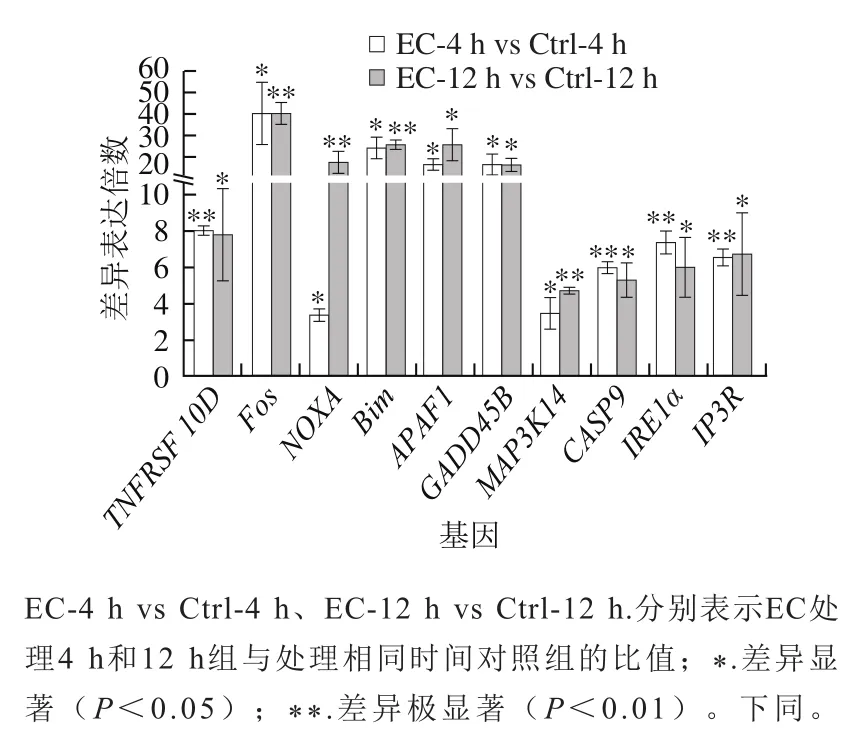
图1 氨基甲酸乙酯对细胞凋亡基因mRNA表达的影响Fig. 1 Effect of EC treatment on mRNA levels of apoptosis-related genes
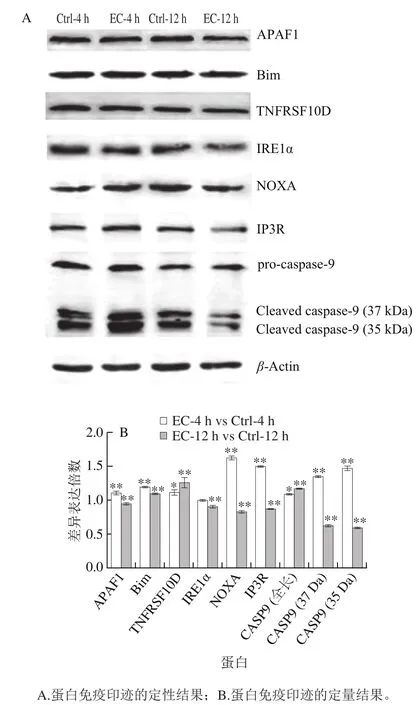
图2 氨基甲酸乙酯对细胞凋亡蛋白的影响Fig. 2 Effect of EC treatment on protein levels of apoptosis-related genes
死亡受体介导的细胞凋亡通路指通过细胞表面特定的受体接受胞外信号诱发细胞凋亡的通路。死亡受体以跨膜形式位于细胞膜表面,胞质内含有死亡结构域(death domain,DD)。在接受到胞外信号后聚合成三聚体而活化,与特定的接头分子结合,形成死亡诱导信号复合体(death-inducing signaling complex,DISC),从而激活下游信号通路,导致细胞凋亡[12]。TNFRSF10D(DcR2)属于诱骗受体家族,它同样能够识别胞外的死亡信号,但由于缺乏细胞质DD不能将信号传至胞内,因而能够通过竞争配体的方式,抑制死亡受体介导的细胞凋亡信号通路[13-14]。4 h和12 h的EC处理,都能显著提高HepG2细胞中TNFRSF10D基因的mRNA和蛋白水平(图1、2)。因此,推测EC处理抑制了死亡受体介导的细胞凋亡信号通路。
2.2 氨基甲酸乙酯对细胞凋亡内源通路的影响
细胞凋亡的内源通路是由线粒体介导的,其中,Bcl-2家族作为细胞凋亡调节因子发挥了重要作用[15]。在受到外界刺激后,Bcl-2家族成员之间相互作用,诱导线粒体膜去极化,增大线粒体膜通透性,释放细胞色素c到细胞质。随后细胞色素c与细胞质中的凋亡细胞蛋白酶激活因子APAF1结合,形成凋亡复合体,激活Caspase-9(CASP9),启动Caspase级联反应,最终诱导细胞凋亡[16]。Bim和Noxa属于Bcl-2家族促凋亡亚家族。有研究报道它们能够引发不同细胞的凋亡[17]。4 h EC处理后,与对照组相比,HepG2细胞中Bim、Noxa、APAF1和CASP9基因mRNA水平和蛋白水平都得到显著提高(图1、2),同时Western blotting结果显示活化的Caspase-9片段显著增加(图2)。这些结果表明,4 h EC处理已经激活线粒体介导的细胞凋亡内源通路,尽管此时细胞的存活率还没有显著的改变[6]。12 h EC处理后,Bim的mRNA和蛋白水平都得到显著提高(图1、2);Noxa、APAF1和CASP9的mRNA水平得到显著提高(图1),但它们的蛋白水平却得到显著下调(图2)。因此,12 h EC处理后,尽管细胞凋亡内源通路在转录水平仍处于活化状态,但细胞内细胞凋亡内源通路的蛋白已经开始发生降解。综上所述,EC处理对细胞凋亡内源通路存在深刻的影响,这可能是EC细胞毒性的一个方面。
2.3 氨基甲酸乙酯对细胞凋亡内质网通路的影响
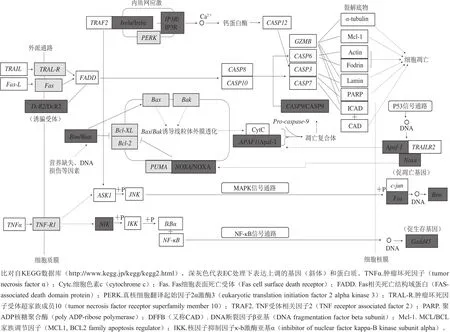
图3 氨基甲酸乙酯诱导HepG2细胞凋亡的可能分子机制Fig. 3 Potential molecular mechanisms of EC-induced HepG2 cells apoptosis
内质网引发细胞凋亡主要通过两个途径:一是内质网应激反应,二是通过钙离子介导。IRE1α是内质网膜上的跨膜蛋白,它是UPR近端感受器,能将未折叠蛋白质信号传入内质网膜,激活内质网应激反应;同时还能活化细胞凋亡信号激酶1(apoptotic-signaling kinase-1,ASK1)促进细胞凋亡[18-19]。肌醇-1,4,5-三磷酸受体(inositol-1,4,5-trisphospate receptor,IP3R)是内质网中细胞内钙离子通道家族成员,当收到第二信使肌醇-1,4,5-三磷酸的信号后,调控内质网中钙离子的释放。胞质中的钙离子能够活化钙依赖性蛋白酶,可直接剪切并激活Caspase-12,引发细胞凋亡[19]。4 h EC处理后,HepG2细胞中IRE1α的mRNA水平显著提高(图1),蛋白水平无显著变化(图2)。此外,IP3R的mRNA和蛋白水平均显著提高(图1、2)。12 h EC处理后,HepG2细胞中IRE1α和IP3R的mRNA水平显著提高,但其蛋白水平显著下降。这些结果表明,EC处理可能同时影响内质网应激反应和钙信号转导。因此,EC对细胞凋亡的内质网通路同样存在明显的影响(图3),这可能是EC细胞毒性的另一个方面。
2.4 氨基甲酸乙酯对细胞凋亡其他调控基因的影响
除了上述这些细胞凋亡通路外,其他一些调控基因也影响细胞的凋亡[20-21]。本实验结果也发现,4 h和12 h EC处理后,HepG2细胞中促存活基因GADD45B、原癌基因Fos和促分裂原活化的蛋白激酶激酶激酶MAP3K14(又称NIK)的mRNA水平均得到显著提高(图1)。因为这些基因能够调控细胞凋亡信号通路,所以EC处理同样也可能通过影响这些基因的表达来影响细胞凋亡(图3)。
3 讨 论
EC对人体细胞的毒性及毒性作用机制至今鲜有报道。前期研究结果表明EC的细胞毒性具有剂量-时间效应[6]。4 h 100 mmol/L EC处理对HepG2细胞形态和细胞活性均没有显著影响;12 h 100 mmol/L EC处理的HepG2细胞形态则出现明显变化,同时细胞活性和死亡率发生显著改变[6]。因此,本实验选取的EC浓度为100 mmol/L,处理时间为4 h和12 h,意图通过检测EC处理后细胞凋亡相关基因的mRNA和蛋白质水平的变化,认识人体细胞对EC的早期和晚期生物学反应,并初步探索EC对HepG2细胞的毒性机制。
细胞凋亡是细胞在受到内外刺激后,为维护机体内环境的稳定自主发生的一种程序性死亡。该过程受到一系列基因的精确调控。在不同环境刺激下,通过激活不同基因的表达,诱发不同的信号通路导致细胞凋亡[6-7]。目前,外源药物诱导细胞凋亡主要是通过3条通路来实施的:线粒体介导的内源通路、死亡受体介导的外源通路和内质网信号通路[16]。本实验中聚焦上述3个通路相关基因的转录和翻译水平的变化。
4 h和12 h的EC处理能够显著提高诱骗受体TNFRSF10D的mRNA水平和蛋白水平。TNFRSF10D受体通过与死亡受体竞争结合胞外死亡配体,从而拮抗死亡受体介导的外源通路,减缓并抑制细胞凋亡。因此,TNFRSF10D的变化可能是HepG2细胞对EC处理的一个应激反应。4 h的EC处理显著提高了线粒体介导的细胞凋亡内源通路中Bim、Noxa、APAF1和CASP9基因的mRNA水平和蛋白水平,同时显著提高了细胞凋亡内质网通路中IRE1α和IP3R的mRNA水平及IP3R蛋白水平,表明4 h EC处理已经激活细胞凋亡的内源途径和内质网通路,引发了细胞凋亡,尽管还没有明显的形态学变化。12 h的EC处理同样显著提高了这些基因的mRNA水平,并没有同样显著提高它们的蛋白水平(Bim除外)。可见,12 h EC处理仍旧通过激活线粒体通路和内质网通路诱导细胞凋亡。因此,这些细胞凋亡线粒体通路和内质网应激通路基因可以视作EC处理反应的分子标志物。细胞凋亡线粒体通路和细胞凋亡内质网应激通路不是孤立的,它们相互影响,相互作用。一方面,Bim作为促细胞凋亡因子,通过结合Bcl-2家族抗凋亡因子,激活线粒体介导的内源通路,促进细胞凋亡;另一方面,内质网应激压力还能够通过蛋白磷酸酶2A介导的去磷酸化和CHOP-C/EBPα介导的转录诱导,激活Bim蛋白引发细胞凋亡[22]。此外,内质网应激反应造成胞质钙离子浓度增高,诱导线粒体膜透性增强,胞质内细胞色素c增多,激活线粒体通路促进细胞凋亡[23];而线粒体内Ca2+稳态的失衡又会引发线粒体ROS水平上升[24],反过来又加重细胞内质网应激反应。EC对HepG2细胞的毒性检测结果也证实线粒体通路和内质网通路是相互作用的。
细胞内压力信号往往具有双重作用:一方面,细胞受到刺激后会立即激活细胞内生存代谢通路,从而缓冲压力或修复损伤;另一方面,当细胞受到的压力或损伤无法修复后,细胞会启动一系列的死亡程序,如细胞凋亡,从而减少细胞对机体的伤害[22]。有研究显示,高表达Fos能够促进细胞凋亡[19];而GADD45B高表达能够通过抑制MKK4-JNK信号通路,抑制细胞凋亡[21]。EC处理一方面通过促进GADD45和诱骗受体DcR2的表达抑制凋亡的发生,另一方面又激活细胞凋亡的内源通路和外源通路诱导细胞凋亡。
值得注意的是,12 h EC处理后HepG2细胞内凋亡相关基因的蛋白水平除Bim和TNFRSF10D外,其他的都显著下降(图2)。据报道,细胞凋亡过程中Caspase能够切割翻译起始因子,从而抑制细胞蛋白合成[25-26]。在凋亡晚期,细胞内形成凋亡小体,并逐渐降解。因此,细胞凋亡过程中蛋白水平不断下降。有研究表明,Bcl-2家族蛋白是调节细胞凋亡和自噬的中心调节因子,仅含BH3域的蛋白(PUMA、Noxa、Nix和Bim等)能够引发细胞自噬或凋亡,导致细胞内复合物(核酸、蛋白质等)破坏[27-28]。12 h EC处理后,部分细胞形态发生变化,细胞存活率低于80%[6],表明12 h处理的样品中,20%以上的细胞已处于凋亡后期,这可能是蛋白水平下降的一个原因。12 h EC 处理样品中Bim和TNFRSF10D表达量没有像其他凋亡蛋白一样显著下降的真正原因并不清楚。推测可能有两个方面的原因。一方面可能源于它们特殊的作用:Bim和TNFRSF10D都是凋亡调控蛋白,不同于其他凋亡蛋白;另一方面可能源于它们EC诱导合成速率和降解速率的差异。内质网是蛋白质合成的场所,EC引起的内质网逆境可能导致细胞内细胞蛋白合成受阻。
总之,100 mmol/L EC处理,即使是4 h的短期处理,也能显著改变HepG2细胞内细胞凋亡通路部分基因的mRNA和蛋白水平。细胞暴露于EC后,一方面会应激,激活细胞促存活基因和诱骗受体基因,抑制细胞凋亡,修补损伤;另一方面,当EC处理时间延长,损伤无法修复时,会激活细胞凋亡的内外源通路,促进细胞凋亡。人群EC暴露主要来源于发酵食品、烟草制品和污染的空气[1],但目前尚无比较全面的人群暴露数据。本研究中所用的EC浓度为100 mmol/L[6-7],远远高于实际生活中人群可能遇到的来自于发酵食品的暴露量[29-30],所以,进一步的EC毒性分子机制研究应注意采用结合更低的EC剂量和更长的处理时间。
——疾病防治的新靶标

