基于万古霉素建立荧光酶联免疫吸附法检测金黄色葡萄球菌
李双,陈超超,陈雪岚
基于万古霉素建立荧光酶联免疫吸附法检测金黄色葡萄球菌
李双,陈超超,陈雪岚
江西师范大学 生命科学学院,江西 南昌 330096

李双, 陈超超, 陈雪岚. 基于万古霉素建立荧光酶联免疫吸附法检测金黄色葡萄球菌. 生物工程学报, 2018, 34(9): 1510–1517.Li S, Chen CC, Chen XL. Vancomycin-based fluorescent enzyme-linked immunoabsorbent assay for detection of Staphylococcus aureus. Chin J Biotech, 2018, 34(9): 1510–1517.
以猪IgG作为捕获抗体固定金黄色葡萄球菌,修饰有万古霉素的量子点荧光微球作为“检测抗体”,建立荧光酶联免疫吸附法检测金黄色葡萄球菌。文中制备了平均粒径为100 nm的量子点荧光微球并与万古霉素偶联;摸索了反应最佳盐离子浓度为0.01 mol/L,反应最佳pH为6.0。在该实验条件下,金黄色葡萄球菌的检测灵敏度为104CFU/mL,与其他致病菌无交叉反应。以上结果表明,该方法可用于快速检测金黄色葡萄球菌,为金黄色葡萄球菌的临床监控和食品检测提供参考。
金黄色葡萄球菌,万古霉素,量子点荧光微球,荧光酶联免疫吸附法,猪IgG
金黄色葡萄球菌是最常见的病原微生物之一,在水、空气、灰尘及人和动物的排泄物中均可找到,因而很容易造成食物的污染。.引起食物中毒是一个世界性卫生问题,根据美国疾病控制中心报告,由.引起的食物中毒占第二位,仅次于大肠埃希氏菌[1-5]。在美国,每年约有24万例食物中毒事件是由.污染导致,直接引起医疗损失达15亿美元[6];2000年,在日本有1.3万人因食用被.污染的雪印乳品中毒[7];在我国,由.引起的细菌性食物中毒病例也达20%–25%[8-9]。因此防止.污染食品进入人类食物链是预防中毒的主要手段。
目前检测.的“金标准”仍是传统的培养法,此方法包括增菌、选择性培养和后期鉴定3个环节[10]。该法虽然成本低,对设备要求不高,能给出定性和定量的结果,但是整个检测周期耗时长 (5–7 d),不能即时反馈检测结果,无法满足食品工业和疾控部门现场快速检测食源性致病菌的要求。随着科学理论和技术的不断发展,越来越多的生物学技术被运用到.的检测中。如采用PCR技术对.特有的DNA进行扩增来检测[11-12];采用免疫学原理建立ELISA等方法进行检测[13-15];但以上方法均存在检测费时、成本较高的缺陷。量子点 (Quantum dots, QDs) 是近年来发展较快的一种新型荧光纳米材料。相较于传统的有机染料,量子点具有激发光谱宽且分布连续、发射光谱窄、耐光漂白以及荧光寿命长等优点,且荧光强度较普通荧光染料高10–100。量子点荧光微球 (Quantum dot beads, QBs) 通过将量子点大量包裹于聚合物微球内,使得其荧光强度进一步提高。由于微球包有聚合物的外层,QBs在溶液中稳定性亦得到了有效提高。本实验利用万古霉素能与革兰氏阳性菌细胞壁表面的D-丙氨酰-D-丙氨酸末端部分片段相互作用产生五氢键从而特异性地识别.及猪IgG的Fc片段可与.的表面蛋白A结合的特点[16-18],选用量子点荧光微球作为新型标记物,构建“类夹心”荧光免疫吸附法检测.,其原理见图1。
1 材料与方法
1.1 材料
1.1.1 菌株
实验用菌株.、单核细胞增多性李斯特氏菌、绵羊李斯特菌及大肠杆菌O157∶H7均为实验室保存菌株。
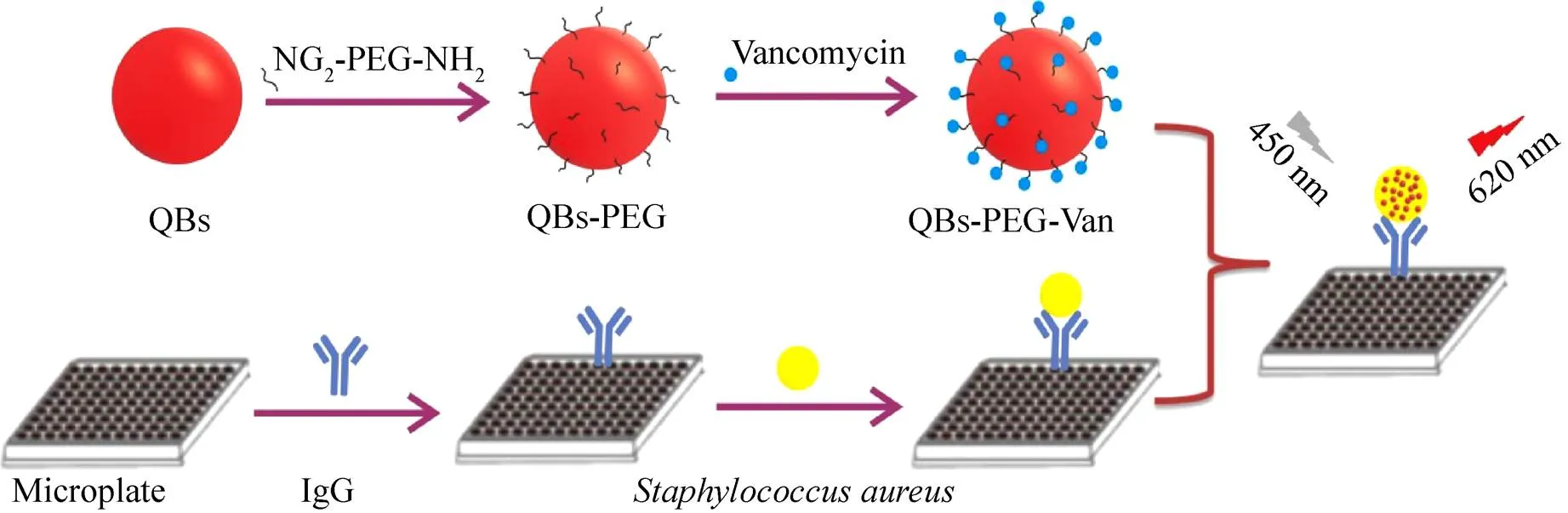
图1 荧光酶联免疫吸附法检测金黄色葡萄球菌原理图
1.1.2 主要材料
油胺修饰的CdSe/ZnS量子点以及NH2-PEG2000- NH2由美国Ocean Nano Technology公司惠赠;1-十八烯马来酸酐的聚合物 (Poly (maleicanhydride- alt-1-octadecene),PMAO)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐 (EDC) 购自Sigma公司;猪IgG购自上海羽朵生物科技有限公司;万古霉素购自中国阿拉丁公司;牛血清白蛋白 (BSA) 购自中国Biosharp公司;其他试剂均为国产分析纯。
1.2 主要仪器
ZWY-2012C恒温培养振荡器购自上海智诚公司;Bio-Tech荧光酶标仪购自美国Bio公司;F-4500荧光分光光度计购自日本日立公司。
1.3 方法
1.3.1 量子点荧光微球的制备及与万古霉素的偶联
量子点荧光微球的制备:5 mg油胺修饰的CdSe/ZnS量子点以及10 mg PMAO溶解于100 μL三氯甲烷。将其进一步与500 μL十二烷基磺酸钠溶液(3 mg/mL) 混合。细胞破碎仪将以上油水混合液超声细乳化(超声功率72 W,超声5 s,间隔10 s,如此程序连续超声2 min)。细乳液置于60 ℃保温4 h,除去溶液中的三氯甲烷, 15 000×离心15 min获得量子点荧光微球。将量子点荧光微球溶解于pH 10.0的氢氧化钠溶液,静置处理24 h水解PMAO表面酸酐,获得羧基修饰的量子点荧光微球。15 000×离心回收量子点荧光微球,超纯水洗涤微球3次,将量子点荧光微球超纯水溶解备用。透射以及扫描电镜表征量子点荧光微球的光学粒径以及形貌;动态光散射仪测定量子点荧光微球的水化粒径;荧光分光光度计分析量子点荧光微球的发光强度(激发波长为450 nm,扫描波长为550–650 nm,发射狭缝与激发狭缝为5 nm,扫描速度为240 nm/min)。
1) 量子点荧光微球与万古霉素的偶联:量子点荧光微球的接臂。250 μg量子点荧光微球重悬于2 mL PB缓冲液 (0.01 mol/L,pH 6.0),加入200 μg EDC和1% BSA制备偶联BSA的量子点荧光微球,室温反应过夜后15 000×离心15 min获得偶联BSA的量子点荧光微球;0.01 mol/L PB (pH 7.4)重悬微球,进一步加入100 μg EDC和 4.8 mg NH2-PEG2000-NH2(终浓度为1%),每隔 30 min后补加100 μg EDC,室温反应90 min后15 000×离心15 min,获得氨基PEG修饰的量子点荧光微球。2) 万古霉素的活化。以万古霉素∶EDC∶ NHSS=1∶4∶4的摩尔比,在pH 6.0的0.01 mol/L PB缓冲液中活化2 h。3) 接臂的荧光微球与万古霉素的偶联。向上述接臂的量子点荧光微球溶液中加入1.85 mg活化好的万古霉素,调节pH至8.0左右;室温反应3 h后15 000×离心15 min,沉淀重悬于pH 6.0的0.01 mol/L PB缓冲液中;加入1% D-葡萄糖酸溶液(终浓度0.02%),与100 μg EDC混合后,室温封闭1 h; 13 500 r/min离心15 min,沉淀用0.01 mol/L PB缓冲液(pH 7.4) 重悬。偶联产物通过紫外扫描及Zeta电位进行表征。
1.3.2 荧光酶联免疫吸附法反应条件的优化
反应pH的优化:首先用pH 8.6 的PBS缓冲液稀释猪IgG至10 μg/mL,每孔100 μL,4 ℃包被过夜;再用0.05% PBST洗涤3次,1×PBS洗涤1次,每孔加入300 μL 1% BSA溶液,37 ℃封闭 2 h;0.05% PBST洗涤3次,1×PBS洗涤1次;分别配制pH值为5.0、6.0、7.0、8.0、9.0的PBS缓冲液稀释.至浓度为106CFU/mL,37 ℃反应1.5 h;0.05% PBST洗涤3次,1×PBS洗涤 1次;然后加入对应不同pH的PBS缓冲液稀释至浓度为25 μg/mL量子点荧光微球和万古霉素偶联物,37 ℃反应1.5 h;0.05% PBST洗涤3次,1×PBS洗涤1次;最后,用荧光酶标仪读取荧光以确定最佳反应pH。
反应盐离子浓度的优化:在最佳pH的条件下,摸索不同盐离子浓度对反应的影响。操作步骤同前文。只是分别用盐离子浓度为0.01、0.05、0.1、0.2、0.4、0.8、1.6 mol/L的PBS缓冲液稀释.至浓度为106CFU/mL。
1.3.3 荧光酶联免疫吸附法检测金黄色葡萄球菌标准曲线的建立
选取最佳反应pH和盐离子浓度,建立标准曲线,步骤同前文。参与反应的.浓度依次为101、102、103、104、105、106、107、108及109CFU/mL。
1.3.4 荧光酶联免疫吸附法的特异性评价
以上述同样的步骤评估该方法的特异性。参与评估的菌株分别是..、.及O157:H7,其浓度均为 106CFU/mL。
1.3.5 牛奶样品中检测金黄色葡萄球菌
将不同浓度的.(1.45×104–1.45×106CFU/mL) 分别添加到10倍稀释的全脂牛奶样品中,混匀;以上述同样的步骤评估该方法的回收率。不同浓度样品重复3次。
2 结果与分析
2.1 量子点荧光微球与万古霉素的偶联与表征
2.1.1 量子点荧光微球的制备和表征
采用微乳液法制备量子点荧光微球。获得的量子点荧光微球溶液在自然光下呈现淡淡的棕红色,而在紫外灯激发下溶液发射出强烈的红色荧光(图2A中实物插图a,b);同时进一步比较了量子点荧光微球与量子点的发光强度差异,结果如图2A所示,量子点荧光微球最大荧光发射波长为615 nm,与油溶性量子点基本相似,表明本文中荧光微球制备方法不会改变量子点荧光特性。同时从图中可知,在基本相同的荧光强度下,量子点荧光微球浓度仅是量子点的1/330,表明在相同摩尔量下,量子点荧光微球的荧光强度是量子点的330倍。透射电镜(图2C) 结果显示合成获得的量子点荧光微球内部紧密聚集了大量的油溶性量子点,微球平均光学粒径在100 nm左右;扫描电镜图(图2D) 显示量子点荧光微球呈球状,大小相对均一,分散性较好;动态光散射仪测定其平均水化粒径为122 nm (图2B)。
2.1.2 量子点荧光微球与万古霉素偶联物的表征
量子点荧光微球、量子点荧光微球PEG偶联物和量子点荧光微球万古霉素偶联物的紫外扫描图见图3A (其中QBs、QB-PEG及QB-PEG-Van同浓度),Zeta电位见图3B。图3A显示,万古霉素在220 nm以及280 nm具有明显的特征吸收峰;QBs由于包埋了大量的量子点,在紫外及可见光区域具有量子点的宽吸收特点;量子点荧光微球偶联BSA以及NH2-PEG2000-NH2后,在220 nm的吸光值显著增加 (蛋白质肽键吸收峰);当QB-PEG偶联万古霉素后,QB-PEG-Van在220 nm处的吸光值进一步增加,表明万古霉素与QB-PEG成功偶联。图3B结果显示,量子点荧光微球表面带负电,Zeta电位值为–38.75;偶联PEG后,荧光微球表面修饰有大量的氨基功能团,Zeta电位值变为+38.3;由于万古霉素分子含有两个氨基功能团,QB-PEG偶联万古霉素后,QB-PEG-Van的Zeta电位值上升为+47,进一步表明量子点微球成功与万古霉素发生了偶联。
2.2 荧光酶联免疫吸附法反应条件的优化
2.2.1 反应pH的优化
pH会影响万古霉素与细胞壁表面氢键的形成。本实验研究了不同pH对荧光强度的影响,确定最佳反应pH。图4显示,当pH为5.0–6.0时,荧光强度上升;当pH为6.0–9.0时,荧光强度呈下降趋势。因此,本实验选用pH 6.0作为最佳反应条件,该条件与Kell等[16]报道一致。

图2 量子点荧光微球的表征(A为量子点 (200 nmol/L) 及量子点荧光微球 (0.61 nmol/L) 的荧光光谱图,插图a:量子点荧光微球白光下实物图,b:量子点荧光微球紫外灯光下实物图;B为水化粒径分布图;C为透射电镜图,插图为单个量子点荧光微球放大电镜图;D为扫描电镜图)

图3 量子点荧光微球及其修饰PEG和万古霉素的紫外扫描图(A) 及Zeta电位图(B)
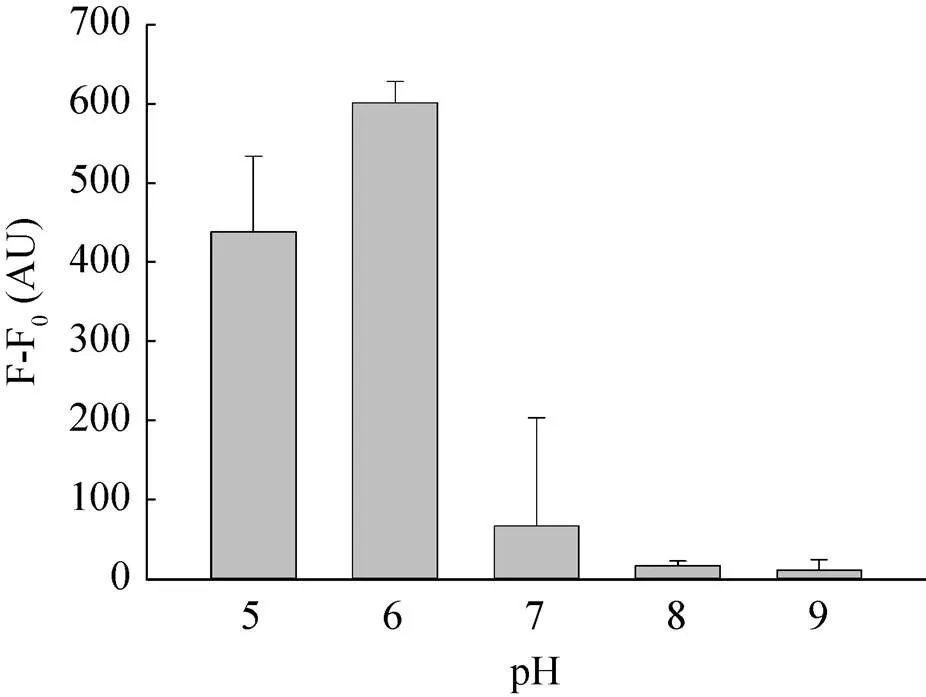
图4 不同pH对荧光强度的影响
2.2.2 盐离子浓度的优化
盐离子在一定浓度下会破坏氢键的形成。本实验研究了不同盐离子浓度对荧光强度的影响,确定最佳反应盐离子浓度。如图5所示,当盐离子浓度为0.01 mol/L的时候,荧光强度最高,随着盐离子浓度的升高,荧光强度逐渐降低。因此,本实验选用0.01 mol/L作为最佳盐离子浓度。
2.3 荧光酶联免疫吸附法检测金黄色葡萄球菌的标准曲线
将.稀释至101–109CFU/mL,每个浓度测定3个平行样,测荧光强度后取其平均值。设定目标菌为0的荧光强度为F0,其他加了目标菌的荧光强度为F,以F-F0为纵坐标、.浓度为横坐标作图,绘制标准曲线,结果见图6。图6显示,随着.浓度的升高,荧光强度逐渐升高;当菌浓度为104–107CFU/mL时,具有良好的线性关系,标准曲线为=177.9–673.7,2=0.986 5;当菌浓度高于107CFU/mL时,出现“HOOK”效应[14]。
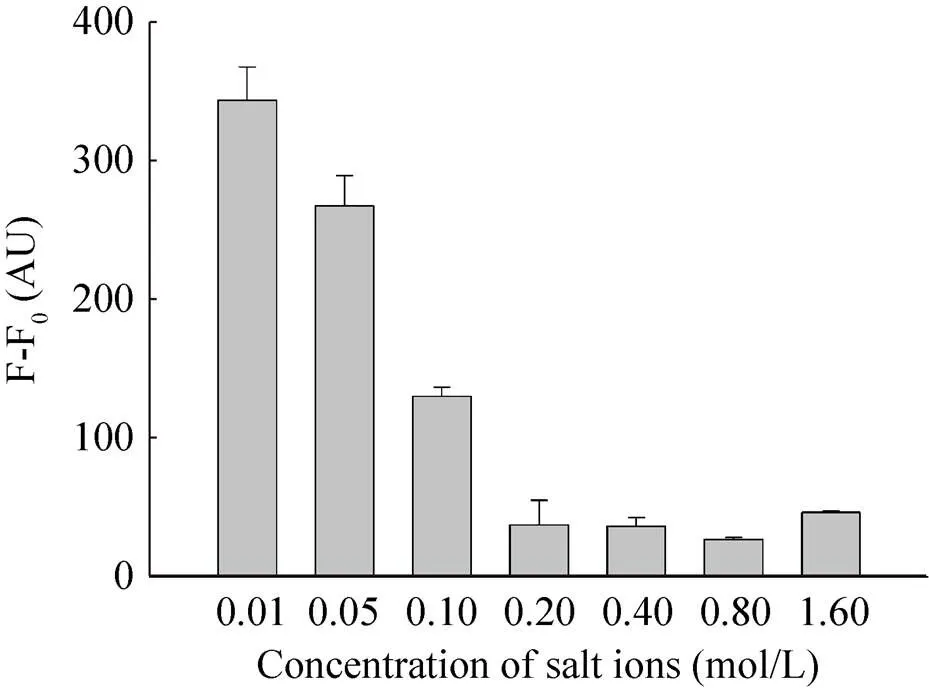
图5 不同盐离子浓度对荧光强度的影响示意图
2.4 荧光酶联免疫吸附法的特异性评价
以1%接种量分别接种.、单增李斯特菌、绵羊李斯特菌、大肠杆菌O157∶H7于LB培养基中培养,灭活后稀释至106CFU/mL,进行特异性评价。结果如图7所示,该荧光酶联免疫吸附法与其他菌均无交叉反应。表明此法特异性强,可用于检测.。此结果与只有.表面有蛋白A、猪IgG只能识别.的特点是相符的。
2.5 荧光酶联免疫吸附法检测牛奶中的金黄色葡萄球菌
采用本实验中获得的最佳条件检测牛奶样本中的.,结果如表1所示,当加标浓度从1.45×104–1.45×106CFU/mL时,平均回收率在87.2%–109.7%之间。上述结果表明该方法可以检测实际样本中的.。

图6 荧光酶联免疫吸附法检测金黄色葡萄球菌的标准曲线
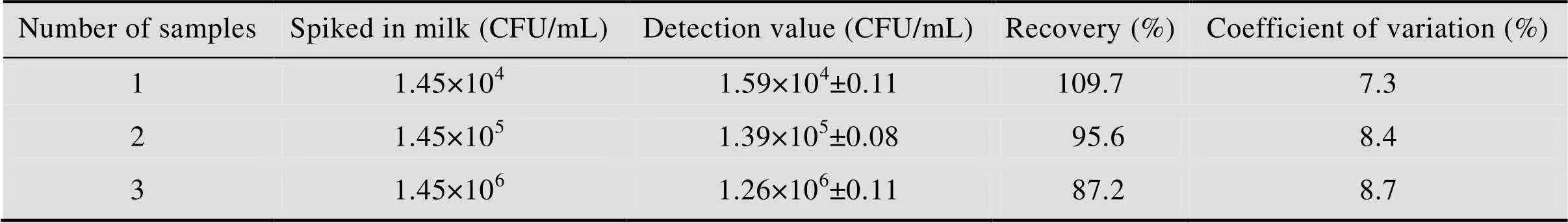
表1 全脂牛奶中金黄色葡萄球菌检测回收率


图7 荧光酶联免疫吸附法的特异性评价
3 小结
本文基于猪IgG的Fc片段只能与.的表面蛋白A结合,且万古霉素能特异性识别革兰氏阳性菌的特点,建立了以猪IgG作为捕获抗体,修饰有万古霉素的量子点荧光微球作为“检测抗体”的类夹心荧光酶联免疫吸附法检测.。该方法在pH 6.0、盐离子浓度为0.01 mol/L条件下,对.的检测范围为104–107CFU/mL,最低检测限为104CFU/mL,且与其他革兰氏阳性菌或阴性菌无交叉反应,检测样品回收率在87.2%–109.7%之间。该方法为.的快速检测提供了有效方法,为.的临床监控提供了基础。
[1] Denayer S, Delbrassinne L, Nia Y, et al. Food-borne outbreak investigation and molecular typing: high diversity of Staphylococcus aureus strains and importance of toxin detection. Toxins, 2017, 9(12): E407.
[2] Tajbakhsh M, Karimi A, Tohidpour A, et al. The antimicrobial potential of a new derivative of cathelicidin fromagainst methicillin-resistant. J Microbiol, 2018, 56(2): 128–137.
[3] Nakao JH, Talkington D, Bopp CA, et al. Unusually high illness severity and short incubation periods in two foodborne outbreaks ofHeidelberg infections with potential coincidentintoxication. Epidemiol Infect, 2018, 146(1): 19–27.
[4] Suzuki Y, Kubota H, Ono HK, et al. Food poisoning outbreak in Tokyo, Japan caused by. Int J Food Microbiol, 2017, 262: 31–37.
[5] Ayele Y, Gutema FD, Edao BM, et al. Assessment ofalong milk value chain and its public health importance in Sebeta, central Oromia, Ethiopia. BMC Microbiol, 2017, 17: 141.
[6] Scallan E, Hoekstra RM, Angulo FJ, et al. Foodborne illness acquired in the United States—major pathogens. Emerg Infect Dis, 2011, 17(1): 7–15.
[7] Ikeda T, Tamate N, Yamaguchi K, et al. Mass outbreak of food poisoning disease caused by small amounts of staphylococcal enterotoxins A and H. Appl Environ Microbiol, 2005, 71(5): 2793–2795.
[8] Peng GH, Hu ZH, Xue L, et al. Detection ofand enterotoxin in food poisoning samples. Mod Prevent Med, 2008, 35(20): 3943–3945 (in Chinese). 彭国华, 胡主花, 薛琳, 等. 食物中毒样品中金黄色葡萄球菌及肠毒素检测. 现代预防医学, 2008, 35(20): 3943−3945.
[9] Du HL, Zhang SS, Ou X, et al. Advancement in researches of detection technology in. Food Ferment Technol, 2009, 45(5): 12−14 (in Chinese). 杜洪利, 张双双, 欧旭, 等. 金黄色葡萄球菌检测技术研究进展. 食品与发酵科技, 2009, 45(5): 12−14.
[10] Ministry of Health, PRC. GB 4789.10–2010 Food microbiological examination:. Beijing: China Standards Press, 2010 (in Chinese). 中华人民共和国卫生部. GB 4789.10–2010食品安全国家标准: 金黄色葡萄球菌检验. 北京: 中国标准出版社, 2010.
[11] Wei CJ, Zhong JL, Hu T, et al. Simultaneous detection ofO157: H7,andby multiplex PCR in milk. 3 Biotech, 2018, 8: 76.
[12] Wang P, Wang P, Gao L. Rapid determination of three food-borne bacterial pathogens using PCR method. J Food Safety Quality, 2013, 4(3): 917−920 (in Chinese). 王攀, 王萍, 高林. PCR 法快速检测三种食源性致病菌的研究. 食品安全质量检测学报, 2013, 4(3): 917−920.
[13] Nagaraj S, Ramlal S, Kingston J, et al. Development of IgY based sandwich ELISA for the detection of staphylococcal enterotoxin G (SEG), antoxin. Int J Food Microbiol, 2016, 237: 136–141.
[14] Erickson JA, Grenache DG. A chromogranin A ELISA absent of an apparent high-dose hook effect observed in other chromogranin A ELISAs. Clin Chim Acta, 2016, 452: 120–123.
[15] Nouri A, Ahari H, Shahbazzadeh D, et al. Designing a direct ELISA kit for the detection ofenterotoxin A in raw milk samples. Int J Biol Macromol, 2018, 107: 1732–1737.
[16] Kell AJ, Stewart G, Ryan S, et al. Vancomycin-modified nanoparticles for efficient targeting and preconcentration of Gram-positive and Gram-negative bacteria. ACS Nano, 2008, 2(9): 1777–1788.
[17] Gao HF. Chemiluminescent immunoassay for disease biomarker and pathogenic bacterium detection[D]. Chongqing: Southwest University, 2014 (in Chinese). 高鸿飞. 基于化学发光免疫分析的疾病标志物和病原菌检测新方法研究[D]. 重庆: 西南大学, 2014.
[18] Gao HF, Yang SJ, Han J, et al. Double-site recognition of pathogenic bacterial whole cells based on an antibiotic-affinity strategy. Chem Commun, 2015, 51(62): 12497–12500.
(本文责编 郝丽芳)
Vancomycin-based fluorescent enzyme-linked immunoabsorbent assay for detection of
Shuang Li, Chaochao Chen, and Xuelan Chen
School of Life Sciences, Jiangxi Normal University, Nanchang 330096, Jiangxi, China
In the study, fluorescent enzyme-linked immnoabsorbent assay for detection ofwas established with IgG from pig as capture antibody and quantum dot nanobeads (QBs) labeled vancomycin (QB-Vans) as testing antibody. Quantum dot of about 100 nm partical size nanobeads were prepared and linked with vancomycin. The optimum concentrations of salt ions were 0.01 mol/L, and the optimum pH was 6.0. Under the optimum conditions, the detection sensitivity for.was 104CFU/mL, and there was no cross-reaction with other pathogenic bacteria. Thus, the method could be used for rapid screening of., for the clinical monitoring and foodborne pathogens detection.
, vancomycin, quantum dot nanobeads, fluorescent enmyze-linked immunosorbent assay, pig IgG
December 8, 2017;
May 2, 2018
"5511" Advantageous Science and Technology Innovation Team Project of Jiangxi Province (No. 20165BCB19004), National Natural Science Foundation of China (No. 31660019), Natural Science Foundation of Jiangxi Province (No. 2016BAB204173).
Xuelan Chen. Tel: +86-791-88120391; Fax: +86-791-88120390; E-mail: xuelanchen162@163.com
江西省“5511”优势科技创新团队项目 (No. 20165BCB19004),国家自然科学基金 (No. 31660019),江西省自然科学基金(No. 2016BAB204173) 资助。
2018-05-17
10.13345/j.cjb.170488
http://kns.cnki.net/kcms/detail/11.1998.Q.20180509.1543.001.html

