嗜酸性粒细胞性胃肠炎的生物治疗
Joshua B. Wechsler, MD;Ikuo Hirano, MD
翻译:柏小寅 审校:钱家鸣 中国医学科学院 北京协和医学院 北京协和医院消化内科
目前,嗜酸性粒细胞性食管炎(eosinophilic esophagitis, EoE)的治疗包括药物疗法、饮食疗法和食管扩张术,药物疗法主要是服用糖皮质激素。关于口服糖皮质激素治疗的一些随机对照临床试验结果肯定了糖皮质激素的疗效,但不同的研究却显示出不同的组织学反应率,波动于40%~90%之间[1-6]。然而,美国食品药品监督管理局至今仍未批准其为局部糖皮质激素用于EoE的适应证。因此,许多临床医师主要将哮喘治疗的糖皮质激素剂型用于EoE的治疗;少部分研究对于长效糖皮质激素的疗效表示担忧,特别是在糖皮质激素药物减量[7-9]和肾上腺皮质功能减退等长期不良反应方面[10]。在胃、小肠和结肠受累的嗜酸性粒细胞性胃肠炎(eosinophilic gastrointestinal diseases,EGIDs)中,全身糖皮质激素疗法已广泛应用,其不良反应也是众所周知[11]。生物治疗则采用新的治疗策略,将治疗药物或手段用于免疫通路中的特定靶点(图1,表1),可能解决目前EoE和EGIDs治疗中一些尚未解决的问题。本综述总结生物治疗的历史、现状和未来,分析其治疗潜力、科学合理性以及已有的临床试验数据。
1 EoE临床试验中的治疗终点
对于EGIDs新治疗方案临床试验的解读主要基于合理的且经过验证的研究终点。如果对治疗成功的定义缺乏公认的临床预后指标,势必会影响研究的发展。目前,主要终点包括症状评估相关的患者报告结局(Patient-Reported Outcome, PRO)量表,以及组织学评估相关的最大黏膜嗜酸性粒细胞密度[嗜酸性粒细胞((eosinophils, eos)/高倍视野(high power field,hpf)]。然而,这些用以评估症状和组织学的工具相差悬殊,且未被广泛验证。在过往几年里,多种PRO量表被用以评估儿童和成人EoE患者的症状和生活质量。在成人患者中,经过验证的量表包括日常症状问卷和EoE活动度指数[12]。对于儿童患者,儿童EoE症状评分已得以验证,但尚未用于评估患者治疗反应性的指标[13]。然而,很多临床试验设计时还未出现这些经过验证的评估工具。
在EoE临床试验中,症状评估是一个理所应当的研究终点,但是,需要强调的是这种预后评估方式存在着局限性。长时间咀嚼、吃饭时间延长以及避免质地硬的食物(例如肉和面包)的摄入均能减轻吞咽困难的程度,从而导致疾病活动度评估出现偏差。另一个主要问题还在于症状和食管重构之间的关系。慢性炎症所致的食管重构主要表现为食管狭窄,其是吞咽困难和食物嵌塞的一个主要决定因素[14]。在EoE中,抗炎或是免疫治疗尚未显示出能够逆转纤维性狭窄的作用,因此要求这类治疗能够改善吞咽困难,将会忽视其在预防其他疾病后果上的获益。临床观察发现在接受食管扩张的患者中,超过九成的患者认为吞咽困难症状得以有效缓解,但并未改变其根本的炎症反应,这一研究结果肯定了上文的观点[15]。
临床随机对照试验显示,采用食管黏膜嗜酸性粒细胞密度评估EoE活动度是一个客观且可量化的指标,具有高度的观察者间一致性以及极少的安慰剂效应。预后常定义为黏膜嗜酸性粒细胞的减少,但计算嗜酸性粒细胞密度的方法却相差甚远。部分研究采用了包括<15、<10、<6和<5 eos/hpf等不同的目标阈值作为研究终点,而另一些研究则采用了计算嗜酸性粒细胞密度减少的百分数作为研究终点。EoE组织严重性评分是一种新近提出的并经过验证的评估方法,其在嗜酸性粒细胞密度基础上融入了基底细胞增生、细胞间隙扩张和上皮下纤维化等组织学指标,这样使临床试验能够更详实地评估EoE黏膜炎症程度[16]。虽然其旨在考虑使用组织学作为疗效评估的主要决定因素,但是也很好地反映出症状与病理学之间的不一致性,这种不一致性或许可用饮食习惯的调整、上皮下结构重构以及安慰剂效应来解释,而上皮下结构重构又很难通过常规的活检方法来评估[17]。

图 1 目前及未来EoE生物治疗的靶点

表1 治疗靶点和发病机制中的作用以及相关药物
在胃食管反流病和炎症性肠病中,内镜下效果是评估疗效的主要决定因素,越来越多的数据显示该评估方法可作为EoE临床试验的一个客观性研究终点。EoE内镜参考评分(EoE Endoscopic REFerence Scoring,EREFS)是一种经过研究验证的分类和分级体系,在儿童和成人EoE诊断中显示出很高的准确性。近期有关局部糖皮质激素最佳剂量和生物治疗2期临床试验均显示出EREFS在评估黏膜愈合中的价值[18-21]。
其他研究则评估了EoE疾病活动度相关的生物标志物。mRNA表达是EoE食管活检中重要的上调和抑制基因在分子层面的指纹,其在胃食管反流病组与对照组比较均有明显差异性[22]。嗜酸性粒细胞诊断芯片涵盖了一组基因,包括Th2炎症反应、肥大细胞活化和纤维化通路。在儿童局部采用氟替卡松治疗和成人的抗白细胞介素(interleukin,IL) -13治疗的临床随机对照试验中均发现,EoE模式发生了逆转。嗜酸性粒细胞诊断芯片为从分子层面深入了解EoE的发病机制提供了可能,同时还能提供个体化治疗方案,并提高诊断的准确性。为了从全器官角度评估EoE的食管重构,在内镜检查时可采用功能性腔内影像探针来测量食管生物力学特性[23]。早期研究发现,食管壁扩张性降低与食物嵌塞风险增高密切相关[24-25]。功能性腔内影像探针的预试验研究发现,采用局部糖皮质激素和抗IL-4受体抗体治疗后食管扩张可有明显改善[21,26]。
2 未公开临床试验验证的靶点
2.1 唾液酸结合性免疫球蛋白样凝集素8
虽然尚无唾液酸结合性免疫球蛋白样凝集素8(sialic acid-binding Ig-like lectin 8,Siglec-8)相关临床试验已经公开发表,但是它具有在嗜酸性粒细胞和肥大细胞中特异性表达的特点,这使其成为EGIDs一个热门的治疗靶点。在鼠类嗜酸性粒细胞性疾病实验模型中,阻滞鼠源性同源物Siglec-F将会导致食道内嗜酸性粒细胞计数减少,这与血管生成减少、纤维黏连蛋白沉积以及基底区增生也有相关性,而这些又是EoE发病机制中的核心部分[27]。更重要的是,Siglec-8还可诱导嗜酸性粒细胞死亡,并能减少肥大细胞介质的释放[28]。2018年AAAAI会议摘要显示,在小鼠嗜酸性粒细胞性胃炎模型中,作用于Siglec-2靶点的新抗体(AK002)可选择性地清除组织和血液中嗜酸性粒细胞,并能减少肥大细胞数量[29-30]。今后仍需要开展临床试验评估Siglec-8在EGIDs中的直接作用。
2.2 胸腺基质淋巴细胞生成素
两个基因组学研究首先确认了胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)单核苷酸多态性在EoE患者中的意义[31-32]。最近的研究进一步证实,EoE患者上皮细胞分化的基底上层中的TSLP表达明显高于对照组。Noti等[33]在鼠类EoE实验中检测了TSLP功能与食物嵌塞的关系,提示TSLP会募集嗜碱性粒细胞,影响下游IL-4的作用,最终作用于嗜酸性粒细胞。TSLP增强了嗜酸性粒细胞的迁移,很可能与IL-33结合,后者可促进IL-5和IL-13的产生[34]。在鼠类模型中,阻滞TSLP可减轻嗜酸性粒细胞性炎症以及食物嵌塞症状。Gauvreau等[35]报道了tezepelumab(AMG 157),一种人源抗TSLP单克隆IgG2抗体,治疗变应性哮喘的双盲、安慰剂对照研究的结果,发现AMG 157可改善早期和晚期哮喘反应,但是由于数据有限,其在EGIDs上的疗效尚不明确。
2.3 整合素
虽然整合素的作用在EGIDs中尚未得到充分研究,但是其在炎症性疾病中已是一个治疗靶点,包括炎症性肠病和类风湿关节炎。Brandt等[36]在1994年首先报道了淋巴细胞中的α4β7整合素,整合素在肠道嗜酸性粒细胞招募和肠道肥大细胞增生方面具有重要作用[36-39]。Forbes等[40]报导了β2整合素因子在结肠嗜酸性粒细胞募集中的作用,该研究提示整合素在低位消化道EGIDs发病机制中可能亦有意义。近期发现Cadherin 26在病理性变态反应性炎症中表达升高,这些疾病包括EoE。资料显示,Cadherin 26可增强细胞黏附于α4β7整合素,并与αE和α4直接连接[41],这种在EGIDs中非常重要的CD4 T细胞激活方式为整合素提供了潜在的靶点。一项回顾性研究报道了5例EGID患者采用维多珠单抗的治疗结果,发现病理学表现得到了改善,但是采用糖皮质激素也许会影响这些效果[42]。因此进一步的相关研究的结果令人期待。
2.4 嗜酸性粒细胞趋化因子
嗜酸粒细胞趋化因子主要由上皮细胞所产生,其在嗜酸性粒细胞趋化过程中起到重要作用。激活的嗜酸性粒细胞、肥大细胞和成纤维细胞也可产生嗜酸性粒细胞趋化因子[43],虽然各种细胞产生的分布比例尚未明确。嗜酸性粒细胞趋化因子受肥大细胞蛋白酶的调节[44],其产量还依赖于信号传导与转录激活子(signal transducer and activator of transcription 6,STAT6)对于IL-4和IL-13的反应[45]。在嗜酸性粒细胞趋化因子家族中(1-3),CCL26/趋化因子3在EoE转录组中呈高表达[46],而糖皮质激素可以下调这一表达[47-48]。研究者发现嗜酸性粒细胞趋化因子受体缺陷的小鼠可不受EoE影响[46]。有趣的是,奥美拉唑可阻滞上皮细胞STAT6与嗜酸性粒细胞趋化因子-3启动子的结合[49-50]。
2.5 TGF-β1
研究证实转化生长因子-β1(transforming growth factor-β1,TGF-β1)在EoE发病机制中具有促纤维化作用。Muir等[51]检测了经TGF-β1处理过的成纤维细胞,发现纤维化明显增加。值得注意的是,基质硬度会影响TGF-β1的反应,提示疾病慢性化相关的硬度增加可能会导致纤维化过程进展[52]。Aceves等[53]确认了平滑肌层存在TGF-β1+的肥大细胞,尤其是TGF-β1很可能通过受磷蛋白增强平滑肌的收缩,这就解释了相应症状。研究发现,阻滞人食管成纤维细胞和平滑肌细胞TGF-β1信号传递可减少纤黏蛋白和胶原[54]。TGF-β1在食管上皮细胞中的作用也非常活跃,Nguyen等[55]最近的研究认为,TGF-β1可通过密封蛋白-7改变上皮屏障功能,Rawson等[56]发现TGF-β1在纤溶酶原激活抑制因子(plasminogen activator inhibitor-1,PAI-1)信号传递中发挥作用,资料提示TGF-β可能是纤维化疾病患者的有效治疗靶点。目前一项多中心的概念验证研究正在观察氯沙坦的疗效,而氯沙坦是一种降压药物,在实验模型中具有抑制TGF-β的效果[57]。
3 已有公开临床试验验证的靶点
3.1 IgE
包括变应性哮喘在内的经典的Th2相关病变与抗原特异性IgE的产生密切相关,后者与肥大细胞、嗜碱性粒细胞相结合,使得抗原交联处脱颗粒[58]。IgE在速发型超敏反应中具有明确的作用,可导致急性或亚急性呼吸道、皮肤和肠道反应,甚至危及生命,但是其在EoE和EGIDs中的作用尚不清楚。多个研究已经检测了食物特异性IgE,但其在EoE中并非普遍存在,与食物触发的变应性疾病也常毫无关联[59]。对于大多数患者而言,IgE升高意味着致敏,后者与速发型超敏反应相关[60-61]。Pelz等[60]研究发现,与无EoE人群相比,具有速发型超敏反应病史的EoE患者的食物特异性IgE水平明显升高。值得注意的是,与速发型超敏反应的触点相比,EoE食物触发值较低,提示全身性IgE反应并不是嗜酸粒细胞的驱动因素。多个研究组发现,B细胞或IgE重链缺陷的EoE鼠在表型上无特别差异[33,62]。Vicario等[63]发现食管浆细胞可产生IgE,局部IgE作用可能与EoE发病机制相关。EoE患者也经常对气源性致敏原过敏,可能直接诱发食管炎症,并通过交叉变态反应发生食物过敏[64-65]。
目前,支持采用抗IgE制剂治疗EGIDs的证据有限。在一项纳入30例成人EoE患者的单中心随机双盲安慰剂对照临床试验(randomized double-blind placebo-controlled trial,RDBPCT)中发现,采用抗IgE抗体对患者治疗(奥马珠单抗)后16周未能改善症状和食管嗜酸性粒细胞计数[66]。作者收集并分析了既往的数据资料,发现采用IgE为基础的检测手段来预测食物诱发的EoE的敏感性和特异性都不尽人意,并推论EoE并非是IgE诱导的变态反应性疾病。一个纳入9例EGID患者的小样本概念验证性研究评估了奥马珠单抗的作用[67],发现虽然胃和十二指肠的嗜酸性粒细胞计数均下降(分别是69%和59%),但是并无统计学意义,患者症状、嗜碱性粒细胞数量和游离血清IgE水平均有明显改善,然而这些药物只是对EGID更有效,而非适用于EoE。
3.2 Th2细胞趋化因子受体同源分子
Th2细胞趋化因子受体同源分子(chemoattractant receptor-homologous molecule on Th2 cells,CRTH2)是一种前列腺素D2受体,后者由肥大细胞生成。研究发现,与对照组相比,EoE患者血浆前列腺素D2水平明显升高[68],包括嗜酸性粒细胞、嗜碱性粒细胞、2型固有淋巴细胞和Th2细胞在内的多种炎症细胞均可表达CRTH2[69]。CRTH2在细胞趋化和活化中的作用已被详细阐述,在动物变态反应性模型中,CRTH2能够加重炎症[70-71]。
OC000459是一种口服选择性CRTH2抑制剂,一项RDBPCT对其在26例成人EoE患者中的疗效进行研究,在完成8周治疗后达到了食管嗜酸性粒细胞计数减少的研究终点[72]。OC000459治疗显著减少了平均嗜酸粒细胞密度(从114.83降至73.26 eos/hpf;P=0.0256),安慰剂则未见到类似结果,但是与其他EoE临床试验相比,患者的组织学改善相对有限。另外,药物组与安慰剂组症状改善程度类似,而内镜下表现无改善。
3.3 IL-5
在EGIDs中,细胞因子IL-5在慢性Th2炎症中具有重要作用。Desreumaux等[73]在1996年首先报道了在低位消化道EGIDs中可出现类似Th2反应,随后Straumann等[74]描述了其在EoE中的意义,此后的研究进一步确证了上述观点[75-79]。与速发型超敏反应相比,EGIDs患者胃肠道的IL-5水平显著升高[80]。已有研究发现,糖皮质激素等治疗后EoE组织中细胞因子明显下降[47-48]。研究者采用转基因技术使实验小鼠IL-5过表达或表达缺陷,证实IL-5能促进嗜酸性粒细胞祖细胞成熟,还可刺激嗜酸性粒细胞趋化因子CCL 11、CCL 24和CCL 26并追踪至组织中[81-84],因为在CD2-IL5小鼠的固有层和基质乳头胶原积聚明显增加,因而推测在IL-5长期过度表达时,其对组织重构亦有一定影响[82]。IL-5的来源包括Th2细胞、固有淋巴细胞、肥大细胞和嗜酸性粒细胞。研究认为2型固有淋巴细胞可能与肥大细胞作用相关[85],对于EoE食物触发因素(如牛奶),T细胞会表达IL-5和其相关激活标志CD154[75]。综上所述,IL-5可增加组织中嗜酸性粒细胞密度,是EGIDs治疗的重要潜在靶点。
IL-5生物制剂在高嗜酸性粒细胞综合征和嗜酸性粒细胞性哮喘的治疗中效果良好。美泊利单抗是一种人源抗IL-5单克隆免疫球G1抗体,首个非盲法1~2期临床研究共纳入4例患者[86],结果显示美泊利单抗可显著减少外周血和食管嗜酸性粒细胞,并改善临床预后。一项美泊利单抗RDBPCT研究纳入11例EoE成人患者,患者接受8~16周治疗[87],其平均食管嗜酸性粒细胞计数下降54%,但患者均未达到主要终点(最大嗜酸性粒细胞下降至<5 eos/hpf)。此外,患者的病理学评估均未达到<15 eos/hpf,也未改善患者的相关症状。
一项国际的多中心双盲随机对照临床试验研究了美泊利单抗在儿童EoE治疗中的疗效[88],患者随机接受3种不同剂量的美泊利单抗,每4周一个疗程,共3个疗程。研究未使用安慰剂,而是选用最小剂量组作为对照组,选择第12周最大嗜酸性粒细胞计数<5 eos/hpf患者比例作为主要终点,症状终点基于一种未验证的日常PRO量表进行评估。虽然最大嗜酸性粒细胞计数可从122.5下降至40.2 eos/hpf,但仅有8.8%的患者达到主要终点。此外,各组间症状改善情况并无差异。
Reslizumab是一种抗IL-5人源单抗,一项大样本随机安慰剂对照临床试验研究了其在226例儿童EoE患者中的疗效[89],治疗中每4周给药1次,共有3个不同剂量组与安慰剂组进行疗效比较,共同主要终点是在15周时的嗜酸性粒细胞计数减少量及医师全面评估。结果发现与安慰剂组(24%)相比,治疗组最大嗜酸性粒细胞计数明显下降(59%至67%)。但是,少于25%的患者达到了组织学<15 eos/hpf的阈值,医师全面评估也未见各组间疗效有统计学差异。
虽然研究显示IL-5靶向药物的治疗效果与对照组比较有统计学意义,但是在食管嗜酸性粒细胞炎症改善方面程度有限。在所有使用4程短期诱导治疗研究中,药物耐受性均良好。该类药物未能显示出良好的症状改善作用,可能与下列因素相关,包括儿童EoE患者症状的高度异质性、未使用经验证的PRO量表、安慰剂改善率比预计值高、纤维化重构的可逆性有限、以及还有其他类型的细胞也参与了疾病过程等。美泊利单抗和reslizumab在大多数患者中均无法达到组织学<15 eos/hpf的主要终点指标,可能与其不能充分清除组织中嗜酸性粒细胞有关,另外,也需要进行更长疗程的治疗效果观察。Benralizumab可与嗜酸性粒细胞上IL-5受体α相结合,其是经过无岩藻糖基化处理的单抗,可通过增强抗体依赖性细胞介导细胞毒作用更好地清除嗜酸性粒细胞[90]。最近,benralizumab被批准用于严重性嗜酸性粒细胞性哮喘的维持治疗。在一项小样本量的治疗预试验中发现,benralizumab单抗对EGID和高嗜酸性粒细胞综合征治疗时临床和组织学疗效良好[91]。期待未来benralizumab单抗用于EGIDs治疗的研究结果。
3.4 IL-13
作为食管Th2炎症反应的激活物,IL-13具有多种功能,其是由Th2细胞和活化的嗜酸性粒细胞共同产生的[74,76,92]。EoE转录组中的IL-13信号通路与IL-13处理过的上皮细胞相同,糖皮质激素治疗后可出现逆转[93]。IL-13介导的上皮细胞的激活可通过STAT6来诱导嗜酸性粒细胞趋化因子1、2和3的表达,从而参与嗜酸性粒细胞的招募[94]。在IL-13缺陷小鼠的EoE实验模型中,研究者证实了IL-13通过嗜酸性粒细胞趋化因子在嗜酸性粒细胞招募的核心作用。另外,气管内的IL-13可诱导小鼠食管嗜酸性粒细胞[95],成纤维细胞激活后可通过骨膜蛋白促进嗜酸性粒细胞的招募,加强与纤连蛋白的黏附[96]。除了细胞招募作用外,IL-13还有屏障功能,可通过下调桥粒钙黏蛋白桥粒芯蛋白1来减少上皮细胞的分化,还可增加细胞内钙依蛋白酶-14、富亮氨酸重复蛋白 31和细胞骨架突触足蛋白[97-100]。研究发现IL-13有增强胶原沉积[101]、活性氧自由基依赖的上皮细胞自噬作用[102],并能诱导IgE表达[103]。综上所述,IL-13在嗜酸性粒细胞招募、屏障功能异常和食管重构等方面均有多效作用,可能成为生物治疗的靶点。
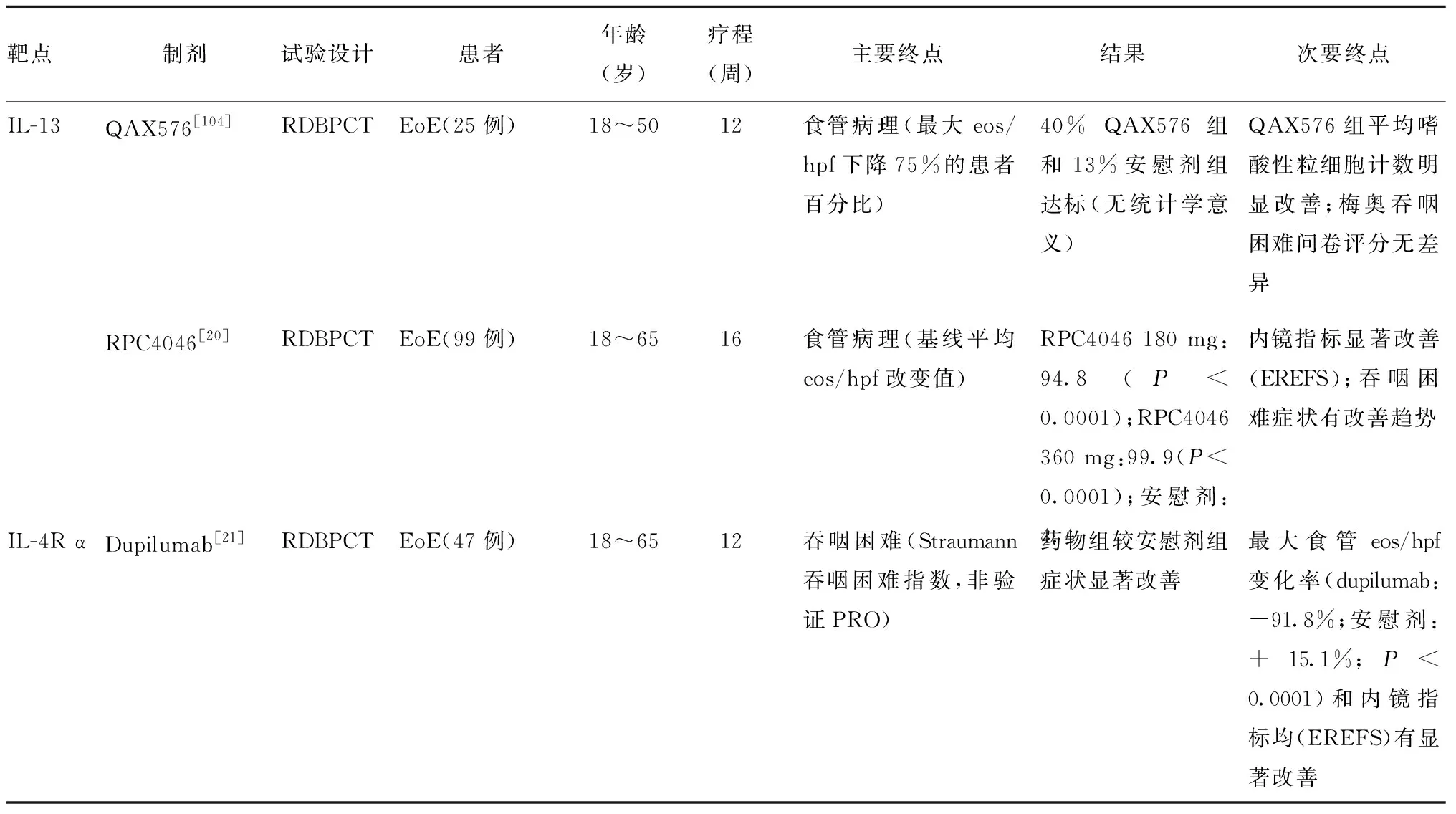
已有3项临床试验评估了抗IL-13抗体治疗的效果,其中两个是靶向作用于IL-13的单抗,另一个则是同时作用于IL-13和IL-4信号通路的抗体。QAX576是一种抗IL-13单克隆IgG1抗体,一项纳入23例成人EoE患者的随机双盲安慰剂对照的临床试验对其疗效进行评估[104],该研究用最大食管嗜酸性粒细胞计数减少>75%的患者比例作为主要终点,结果发现在12周时QAX576治疗组与安慰剂组在主要终点上并无差异。值得注意的是,因为该研究是EoE生物治疗最早的临床试验之一,其并未使用经过验证的研究终点。该研究发现在减少平均嗜酸性粒细胞计数方面,QAX576治疗组减少了60%而安慰剂组减少了23%,差异有统计学意义,且一系列与食管基因转录相关的表达均有改善,上述结果均支持IL-13的重要作用。
RPC4046是一种人源单克隆IgG1κ抗IL-13抗体,最近一项随机双盲安慰剂对照临床试验研究了其在99例成人EoE患者中进行16周治疗的疗效[105],其主要终点是平均食管嗜酸性粒细胞减少程度。结果显示RPC4046治疗组平均食管嗜酸性粒细胞减少幅度超过90 eos/hpf,而安慰剂组仅为4 eos/hpf(P≤0.0001)。该研究还发现,EoE患者内镜下食管病变有明显改善,同时吞咽困难症状有改善趋势,而且使用了经验证的评估量表(EREFS)对EoE活动度指数进行评估。值得重视的是,在糖皮质激素抵抗的患者中,RPC4046治疗后症状改善更为明显。
3.5 IL-4受体
IL-4是一种研究全面的Th2细胞因子,在EoE患者中其表达明显升高[106]。IL-4是一个变态反应性疾病基因的危险位点[107],但是其在EGIDs中的意义尚未明确。在变态反应性疾病中,IL-4诱导初始T细胞成为Th2细胞,同时促进B细胞向IgE转变, Th2细胞、活化的肥大细胞和嗜酸性粒细胞等多种细胞都可生成IL-4。上皮细胞中的IL-4被激活后可通过STAT6产生嗜酸性粒细胞趋化因子-3,继而诱导嗜酸性粒细胞的募集过程。与抑制IL-13的作用机制类似,奥美拉唑也可抑制IL-4[94],这也许能解释质子泵抑制剂在部分患者中的抗炎作用。因为IL-4与IL-13共享同一个异二聚体受体,因此通过IL4Rα作用于IL-4治疗药物会同时影响IL-4和IL-13两条信号通路,疗效可能会很好。
Dupilumab是一种完全的人源性抗IL-4受体α单抗,可抑制IL-4和IL-13信号传递,最近被批准用于成人中重度变应性皮炎的治疗。一项用于成人EoE患者的2期多中心RDBPCT试验结果最近刚刚发表[21],该研究选取吞咽困难作为主要终点,次要终点包括食管嗜酸性粒细胞计数、内镜情况(EREFS)和全面组织学评分(EoE组织学严重性评分),以上终点均有统计学意义。此外,结果还显示,在第12周时,Dupilumab治疗组82.6%的患者可达到<15 eos/hpf,而安慰剂组没有患者能达到此阈值。
总体而言,近期直接作用于IL-13和IL-4生物制剂的临床试验在减少食管嗜酸性粒细胞和吞咽困难症状的改善方面均有显著疗效。虽然因为方法学的不同,直接比较不同类型生物制剂的疗效存在困难,但是与既往的抗IL-5生物制剂相比,该类药物在组织学方面的改善似乎更为明显。采用公认的症状、内镜学和组织学终点作为研究终点使得IL-4和IL-13生物制剂的疗效更具说服力。预试验结果提示糖皮质激素抵抗患者的疗效客观,这一点非常有意义,因为这类患者可能就是生物制剂发挥作用的最理想人群。
4 结论
生物单抗制剂可特异性地作用于免疫通路上的靶点,在EoE和EGIDs的基础研究和临床应用方面引起了学界的高度关注。有一部分EoE患者对于局部糖皮质激素和排除饮食治疗反应欠佳,因此需要新的治疗方案,此外,局部糖皮质激素和饮食治疗的长期疗效和安全性尚不肯定。对于EGIDs而言,使用全身性糖皮质激素将带来无法耐受的长期风险。EoE和EGIDs的饮食治疗导致患者无法食用多种常见食物,影响患者的生活质量。本文讨论的几种生物制剂均作用于变态反应相关疾病多种临床表现的共同通路上,由于EoE和EGIDs患者常有“食管外”和“肠道外”变态反应相关表现,因此全身采用生物制剂作为一种整体性治疗方案可为临床提供潜在的获益,同时能减少临床应用局部药物的种类和数量并避免变应原治疗方案。经过使用已经验证的预后指标进行评估,作用于IL-4和IL-13的生物制剂具有强大的治疗价值(参见表E1)。目前正在进行的关于嗜酸性粒细胞性胃肠疾病治疗的临床试验有望发现新型的、有效的和安全的生物制剂。

表 E1 生物制剂治疗EoE和胃肠炎的临床试验
续表E1
参考文献请见原文:
J Allergy Clin Immunol, 2018, 142:24-31

