青天葵甲醇提取物的体外抗氧化活性
周燕园,刘清华,严火连,常慧敏,陈思蓉,宋家乐,3,4
(1.桂林医学院药学院,广西桂林 541100)(2.桂林医学院公共卫生学院,广西桂林 541100)(3.广西高校预防医学重点实验室,广西桂林 541100)(4.CHA医科大学食品生命工学系及生物技术研究所,韩国抱川 11160)
青天葵,又名独叶莲、独脚莲、青莲是兰科植物毛唇芋兰(Nervilia fordii(Hance) Schltr)的全草,主要分布于我国广西、广东、四川和云南等地[1]。青天葵也是一种具有较高药用及食用价值的广西特产药材,具有抗病毒、抗肿瘤、镇痛和抑菌等功效,也常用于支气管炎和肺炎等的临床治疗[2,3]。药理研究表明,青天葵中主要药效物质为黄酮、多酚及三萜和甾体类等化合物,具有抗肿瘤、抗菌、抗病毒、抗氧化、抗炎和清除自由基等作用[4~8],在医药、食品领域有广阔的应用前景。目前,青天葵对肠道上皮细胞氧化应激损伤的保护作用研究还未见报道。因此,本实验以笔者前期研究的最佳工艺条件对青天葵进行提取,在H2O2处理诱发Caco-2人结肠癌上皮细胞氧化损伤模型上,研究青天葵甲醇提取物对细胞氧化损伤的保护并探讨可能的机制。
肠道不仅是人体中重要的消化器官,其同时也在维持人体正常的生命活动和抵御疾病过程中发挥着重要的作用[9]。肠道屏障是人体常见的物理性防御结构之一,其可以防止肠腔内的有害细菌及细菌毒素通过侵入肠道黏膜组织进入血液系统,阻止其对其他脏器的侵犯[10]。作为肠道屏障基本构成单位的小肠上皮细胞在遭受于外部氧化应激源刺激后会发生细胞内的氧化应激损伤,最终导致细胞死亡。此外,氧化应激损伤也是引起肠道屏障功能丧失以及相关肠道疾病的重要致病原因之一[11]。作为一株在结构和功能方面类似于人正常小肠上皮细胞的细胞株,Caco-2人结肠癌上皮细胞具有与正常小肠细胞类似的紧密连接和微绒毛等结构以及其他相关酶系[12]。因此,Caco-2细胞被公认为是用于研究肠上皮损伤修复机制的经典细胞模型。
1 材料与方法
1.1 材料与试剂
青天葵购买于广西壮族自治区玉林市药材市场,经广西中医药大学药学院廖月葵高级实验师鉴定为广西产青天葵Nervilia fordii(Hance) Schltr.全草,阴干备用;过氧化氢(H2O2)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、2’,7’-二氢二氯荧光黄双乙酸钠(dichloro-dihydro-fluorescein diacetate,DCFH-DA)、青霉素-链霉素双抗液、三氯乙酸(trichloroacetic acid,TCA)和硫代巴比妥酸(thiobarbituric acid,TBA)购自美国Sigma公司;DMEM细胞培养液、胎牛血清(FBS)购自美国Invitrogen公司;抗氧化物酶(SOD、CAT和GSH-Px),乳酸脱氢酶(LDH)测定试剂盒购自南京建成生物工程研究所;细胞总蛋白定量试剂盒购自美国Bio-Rad公司;芦丁(Rutin,批号:BZP0103)、没食子酸(Gallic acid,批号:BZP0110)均购于中国药品生物制品检定所。其余试剂均为国产分析纯。
1.2 仪器与设备
765S型紫外分光光度计:上海精科实业有限公司;SHZ-亚型循环水真空泵:上海亚荣生化仪器厂;EYELA N-1001S旋转蒸发仪:日本东京理化器械株式会社;TDL-80-2B低速台式离心:上海安宁科学仪器厂;三洋 MCO-15AC二氧化碳细胞培养箱:日本三洋公司;Centrifuge 5418R冷冻离心机:德国Eppendorf公司;ELx808酶标仪:美国Bio-Tek公司;FLUOstar OPTIMA荧光酶标仪:德国BMG公司;KQ5200DE型台式数控超声波清洗器:东莞市科桥超声波设备有限公司。
1.3 青天葵甲醇提取物的制备
选阴干的青天葵样品,除杂粉碎后过 60目筛备用。室温下,取10 g青天葵粉加入75%甲醇(200 mL)超声提取60 min[9]。滤液经3000 r/min离心15 min后弃渣收集上清,50 ℃真空减压旋转蒸发后,制备成青天葵甲醇提取物(收率为12.24%),-20 ℃储存待用。
1.4 青天葵甲醇提取物中总多酚、总黄酮含量的测定青天葵甲醇提取物中总多酚含量按
Folin-Ciocalteus法测定。0.1 mL样品中加入10%的碳酸钠溶液(2 mL)反应5 min后,再加入福林酚试剂(0.1 mL)置避光处反应30 min。测定反应液在765 nm处的吸光度值。总酚含量以 GAE为标准,通过标准曲线计算并以mg GAE/g为单位。总黄酮含量测定采用三氯化铝比色法。取0.5 mL样品与2 mL蒸馏水混合,加入10%氯化铝溶液(0.15 mL)后测定420 nm处吸光度值。总黄酮含量以 Rutin为标准计算并表示为 mg
Rutin/g。
1.5 青天葵甲醇提取物 DPPH 和羟基(OH)自由基清除能力测定
DPPH自由基清除率测定:将不同浓度的青天葵甲醇提取物样品液(0.24 mg/mL~0.72 mg/mL)与DPPH标准液(150 μmol/L)各100 μL混匀后,室温下避光反应30 min后。在517 nm波长处用酶标仪测定吸光度。按照公式:[1-(OD样品-OD样品空白)/OD空白]×100%计算清除率(%)。
羟基自由基清除率测定:取200 μL不同浓度的青天葵甲醇提取物样品液(浓度同 DPPH清除实验中所述)放入玻璃试管中,随后加入6 mmol/L脱氧核糖,3 mmol/L过氧化氢,20 mmol/L的磷酸盐缓冲液(phosphate buffered saline,PBS) (pH 7.4),400 μmol/L的氯化铁溶液,400 μmol/L的EDTA-2Na溶液和400 μmol/L的抗坏血酸溶液各200 μL。在37 ℃条件下恒温水浴1 h后,加入1 mL混合反应液(含1%TBA溶液和2.8%TCA溶液)并在90 ℃条件下反应30 min。使用765S紫外分光光度计测定532 nm处吸光度值。按照公式:[1-(OD样品-OD样品空白)/OD空白]×100%计算清除率(%)。
1.6 青天葵甲醇提取物对氧化损伤细胞的保护效果研究
1.6.1 细胞培养及分组
人结肠癌细胞株 Caco-2系由桂林医学院生物技术学院邹先琼研究员馈赠。细胞用含10% FBS与1%青-链霉素双抗液的DMEM细胞培养液置于37 ℃、5%CO2环境下湿化培养,2~3d换液一次。细胞分别接种于 96 孔(1×104个/孔)和 6 孔(2×105个/孔)细胞培养板后,以DMEM培养液(含250 μmol/L H2O2)继续培养4 h制备氧化损伤细胞模型。氧化损伤模型细胞以不同质量浓度的青天葵甲醇提取物(10、50、100、200 μg/mL)继续培养24 h并进行后续实验。正常组为未经过任何处理的正常Caco-2细胞。
1.6.2 MTT法测定细胞存活率
Caco-2细胞先按前述分组处理并进行24 h连续培养后,弃去孔内培养基并加入终质量浓度为 0.5 mg/mL的MTT溶液(100 μL)继续培养4 h。培养结束后弃上清液,每孔加入 DMSO(100 μL)避光振荡 30 min,测定OD490nm后按公式:细胞生存率(%)=OD样品组/OD正常组×100来计算细胞生存率。
1.6.3 细胞内MDA生成量的测定
所有细胞依前述分组处理后用冷PBS冲洗3次,细胞刮刀收集细胞后,加入预冷的细胞裂解液进行细胞裂解。细胞裂解液(500 μL)与400 μL的TBARS反应液(含15%的TCA与0.67%TBA混合液)充分混匀后在95 ℃水浴中保温20 min。冷却后,加入3 mL的异丙醇提取色素并测定OD532nm,蛋白质试剂盒定量细胞总蛋白量。按照公式 MDA 生成量/(μmol/mg protein)=[MDA含量(μmol/mL)×1.5 mL]/总蛋白质含量(mg)计算MDA生成量。
1.6.4 细胞内ROS水平的测定
细胞依前述分组处理后,弃去培养液并加入含DCFH-DA(20 μmol/L)的DMEM培养液于37 ℃条件下孵育20 min,PBS冲洗细胞2次后收集细胞。在激发波长为 485 nm,发射波长为 530 nm的条件下用FLUOstar OPTIMA荧光酶标仪测定荧光强度,按照公式:相对 ROS 水平/%=荧光强度样品处理组/荧光强度正常组×100进行计算。
1.6.5 细胞内抗氧化物酶(SOD、CAT和GSH-Px)活力的测定
取适量经过处理的细胞裂解液按照SOD、CAT和GSH-Px测定试剂盒说明书步骤操作。Bradford蛋白浓度测定试剂盒测定细胞总蛋白。细胞内抗氧化物酶活力用细胞内总蛋白量校正并以酶比活力单位(U/mg pro)表示。
1.6.6 细胞中IL-1β与IL-8炎性细胞因子分泌水平的测定
细胞接种到培养板并依前述方法处理后,4 ℃下收集细胞培养上清液。取适量培养上清液按照 IL-1β与 IL-8测定试剂盒说明书步骤操作并用细胞总蛋白质含量作校正。
1.7 数据处理与统计分析
本研究中,所有实验均重复 3次,结果以均值(means)±标准偏差(SD)表示。所得实验数据运用SPSS 20.0统计软件进行单因素方差分析与统计处理,p<0.05为具有统计差异。
2 结果与分析
2.1 青天葵甲醇提取物的总多酚和总黄酮含量
如表1所示,青天葵甲醇提取物含有一定量的总黄酮(4.72±0.13 mg/g)和总多酚(4.25±0.46 mg/g)。其总黄酮和总多酚含量均高于许海棠等的研究结果[11]。

表1 青天葵甲醇提取物中总多酚和总黄酮含量Table 1 Total polyphones and total flavonoids in Nervilia fordii methanol extracts
2.2 青天葵甲醇提取物对体外自由基清除能力

图1 青天葵甲醇提取物对DPPH和·OH自由基的半清除剂量IC50Fig.1 Semi-clearing doses of DPPH and ·OH radicals from the methanol extract of Nervilia fordii
如图1示,青天葵甲醇提取物具有一定的体外清除自由基能力。其中,青天葵甲醇提取物对DPPH自由基的 IC50(0.117±0.05 mg/mL)弱于标准抗氧化剂BHA(0.084±0.03 mg/mL)。 而 对 ·OH 自 由 基 的IC50(0.513±0.06 mg/mL)也较 BHA(0.260±0.05 mg/mL)弱。
2.3 青天葵甲醇提取物的对H2O2所致Caco-2细胞生存率和细胞LDH释放水平的影响
不同浓度的青天葵甲醇提取物(10 μg/mL~200 μg/mL)与Caco-2细胞共同培养24 h后,处理组细胞的生存率均≥95%(结果未显示)。
结果提示,青天葵甲醇提取物对正常培养状态下的 Caco-2细胞不造成明显的生长抑制或细胞毒性作用。因此,10 μg/mL~200 μg/mL浓度范围内的青天葵甲醇提取物可以用于后续实验。Caco-2细胞经H2O2(250 μmol/L)直接处理4 h后,其细胞生存率显著下降(p<0.05)。而受损细胞经 10 μg/mL~200 μg/mL 浓度的青天葵甲醇提取物处理24 h后,细胞生存率较未经青天葵提取物处理过的模型组细胞显著提高(表2),并呈现出显著的剂量效应关系(p<0.05)。同时,H2O2处理也显著造成Caco-2细胞内的LDH大量释放到细胞培养液中。模型组细胞培养液中的 LDH水平与正常组细胞相比显著升高,且存在统计学差异(p<0.05)。而青天葵甲醇提取物处理能抑制受损 Caco-2细胞的LDH溢出,且溢出抑制效果存在显著的剂量效应关系(p<0.05)。

表2 青天葵甲醇提取物对H2O2所致Caco-2细胞生存率和细胞LDH释放水平的影响Table 2 Effects of methanol extracts of Nervilia fordii on the survival rate and release of LDH from cells induced by H2O2
2.4 青天葵甲醇提取物对H2O2所致Caco-2细胞内ROS水平和MDA含量的影响
如表3示,经H2O2(250 μmol/L)处理4 h后能显著造成正常Caco-2细胞内ROS水平的升高(p<0.05)。经不同浓度青天葵甲醇提取物(10、50、100和200 μg/mL)处理后,细胞内ROS水平明显下降。经最高浓度200 μg/mL的青天葵提取物处理后,受损 Caco-2细胞内ROS水平为最低。
250 μmol/L的H2O2的处理同时也能造成Caco-2细胞内MDA含量显著升高(p<0.05)。青天葵甲醇提取物(10、50、100和200 μg/mL)处理能明显抑制受损细胞内氧化损伤标记物MDA的生成(p<0.05)。上述结果提示,青天葵甲醇提取物可以有效抑制氧化损伤细胞内脂质过氧化产物的生成。SOD活力/(U/mg pro) GSH-Px活力/(U/mg pro)25.64±1.68 12.35±0.23 7.45±0.61* 3.29±0.49*9.97±0.38*#5.67±0.76*#13.48±0.64*#6.44±0.87*#16.87±0.43*#8.06±0.45*#18.49±0.33*#9.23±0.93*#
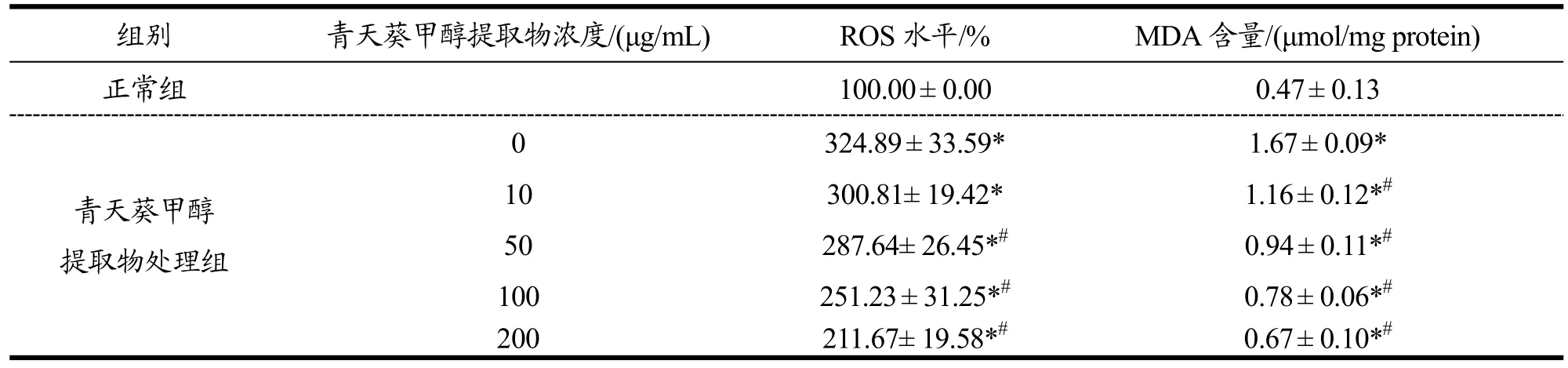
表3 青天葵甲醇提取物对H2O2所致Caco-2细胞内ROS水平和MDA含量的影响Table 3 Effects of methanol extracts of Nervilia fordii on ROS and MDA contents in Caco-2 cells induced by H2O2
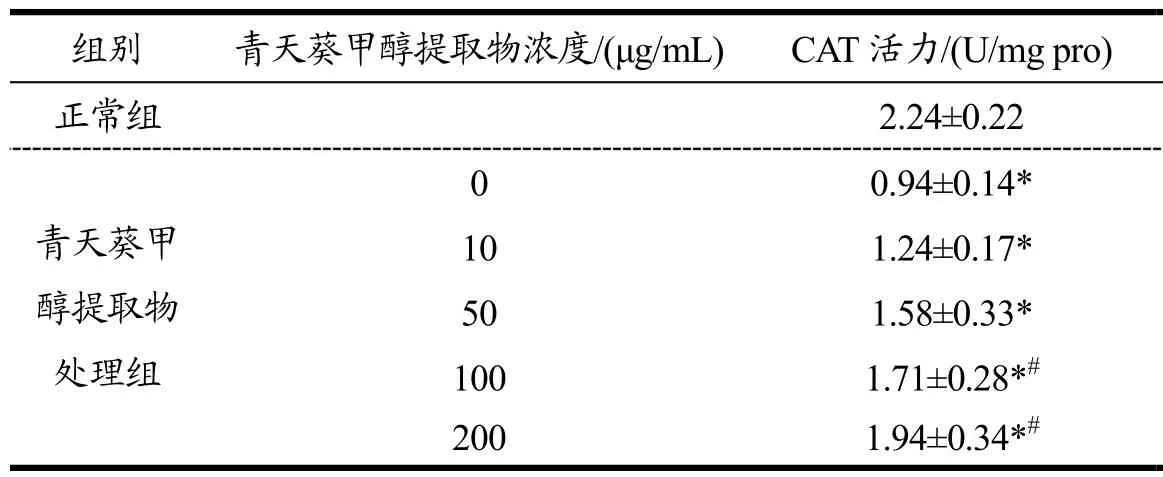
表4 青天葵甲醇提取物对H2O2所致Caco-2氧化损伤细胞内CAT、SOD和GSH-px酶活力的影响Table 4 Effects of methanol extracts of Nervilia fordii on CAT, SOD, and GSH-px activities in Caco-2 induced by H2O2
2.5 青天葵甲醇提取物对H2O2所致Caco-2氧化损伤细胞内CAT、SOD和GSH-Px酶活力的影响
H2O2处理后引发的氧化损伤细胞中 SOD,CAT和GSH-Px等内源性抗氧化物的酶活性较正常组显著降低(表4)。而经不同浓度青天葵甲醇提取物(10、50、100和200 μg/mL)处理24 h后,受损Caco-2细胞总SOD,CAT和GSH-Px等酶活性逐渐增高,且与未经青天葵甲醇提取物处理过的损伤模型组相比具有显著性差异(p<0.05)。
2.6 青天葵甲醇提取物对H2O2所致Caco-2氧化损伤细胞内IL-8和IL-10分泌水平的影响
依图2示,经浓度为250 μmol/L的H2O2处理4 h后能明显造成Caco-2细胞中炎性细胞因子IL-8分泌量的增加(p<0.05)。经ELSIA法检测不同浓度青天葵甲醇提取物(10、50、100和200 μg/mL)处理后的Caco-2细胞发现,受损细胞中炎症因子IL-8而分泌被显著抑制(p<0.05)。检测受损细胞中抗炎细胞因子IL-10的分泌量时发现,青天葵甲醇提取物处理能够提高受损Caco-2细胞中IL-10的分泌量。以上结果提示,青天葵甲醇提取物具有一定的抗炎效果。
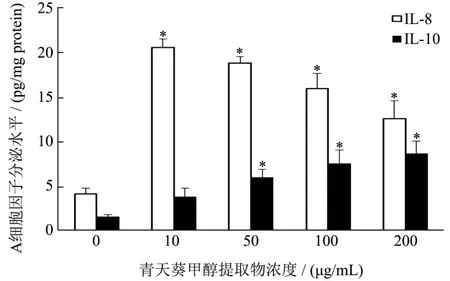
图2 青天葵甲醇提取物对H2O2处理的Caco-2细胞内IL-8和IL-10分泌水平的影响Fig.2 Effect of methanol extracts of Nervilia fordii on secretion of IL-8 and IL-10 inCaco-2 cells treated with H2O2
3 结论
3.1 外源性刺激及感染等所造成的肠道细胞或组织中发生氧化应激反应是导致结肠溃疡、结肠癌等慢性肠道疾病产生的重要病理机制之一[12]。过度的氧化应激会造成肠道上皮细胞结构改变,导致细胞内所含脂质、代谢酶类、功能蛋白等物质的变性失活从而引发细胞的氧化应激损伤[13]。在正常生理状态下,有机生命体由于进行有氧呼吸和相关物质代谢会产生一定量的活性氧与自由基。而细胞内源性的抗氧化物系统,如SOD、CAT和GSH-Px等抗氧化物酶及非酶性的谷胱甘肽均参与对活性氧和自由基的清除过程以保持体内的氧化-还原平衡稳态。但在某些病理状态条件下,多余不能被清除的活性氧和自由基会成为引发氧化应激损伤的始动者。
3.2 当细胞遭受强应激后发生细胞损伤时,LDH会因细胞膜破裂而被释放到细胞外部。因此,LDH被认为是一种衡量细胞发生应激损伤的指标物[14]。在本研究中,受损的Caco-2细胞在经青天葵甲醇提取物处理后,其细胞生存率明显得到提升。同时,细胞内部的LDH酶漏出水平也得到抑制。该结果提示,青天葵甲醇提取物能很好地抑制氧化应激对细胞所造成的伤害。另一方面,细胞内的ROS水平以及脂质过氧化产物MDA同样也是衡量细胞氧化应激损伤程度的重要指标。细胞内部过度蓄积的ROS会直接导致DNA断裂,并造成对正常的细胞周期不同程度的影响。同时,细胞内 ROS水平超过正常范围时也能直接诱导细胞凋亡,甚至直接造成细胞死亡[15]。经不同浓度的青天葵甲醇提取物处理之后,受损Caco-2细胞中ROS水平及反映细胞发生脂质过氧化程度的指标物MDA水平均呈现显著下降趋势。这些结果同时提示,青天葵甲醇提取物可对H2O2诱发Caco-2细胞氧化应激损伤有一定的抑制作用。
3.3 青天葵甲醇提取物还能显著提高受损 Caco-2细胞中SOD、CAT和GSH-Px的活性。这些属于内源性抗氧化物酶的SOD、CAT和GSH-Px在机体对抗氧化应激损伤的过程中发挥着相当重要的作用[16]。SOD通过直接清除细胞内的活性氧自由基,阻断其攻击细胞膜上多价不饱和脂肪酸后所造成的脂质过氧化反应,并有助于抑制具有细胞毒作用的MDA和4-羟基壬烯酸(4-hydroxynonenal,HNE)的生成[17]。而 GSH-Px 则通过催化谷胱甘肽(GSH)转变为氧化型谷胱甘肽,将有毒的过氧化物还原成羟基化合物,并近一步与CAT作用将 H2O2分解为水[18]。这些结果提示青天葵甲醇提取物具有增强机体内源抗氧化系统活性,有助于维持细胞膜结构完整,减轻体内氧化应激反应来保证细胞正常生理功能免受氧化应激的干扰。
3.4 此外,青天葵甲醇提取物对氧化损伤 Caco-2细胞中的炎性和抗炎性细胞因子的分泌具有一定的调控作用。能抑制受损 Caco-2细胞中炎性细胞因子 IL-8的过度分泌,并提高抗炎性因子IL-10的分泌量。抑制IL-8的分泌,对于与炎症反应相关联的肠道疾病有一定的缓解和控制作用[19]。属于 Th2型细胞因子的IL-10与其配体IL-10R相结合参与调节T细胞,B细胞和天然杀伤细胞等免疫细胞的分化与增值,从而调控免疫反应以及抗感染等生理活动[21]。IL-10可以抑制所有的促炎性因子的合成和释放,因此其在缓解肠道免疫疾病方面具有极其重要的作用[20~22]。
3.5 本研究以 H2O2作为体外氧化应激损伤诱导剂建立人小肠上皮 Caco-2细胞氧化损伤模型来研究青天葵甲醇提取物对细胞氧化应激损伤的保护作用。研究结果提示,青天葵甲醇提取物能够通过提升受损细胞内源性抗氧化物(SOD、CAT和GSH-Px)等酶的活力来抑制氧化应激损伤所引发的细胞ROS水平的升高,同时抑制细胞膜脂质过氧化物产物MDA的生成。此外,青天葵甲醇提取物还能调控炎性细胞因子 IL-8与抗炎性因子IL-10的分泌平衡来缓解氧化应激所引进的肠道上皮细胞的炎症反应。而青天葵提取物的体外抗氧化能力及对氧化受损细胞的保护作用可能源于其所含有的多酚和黄酮类物质。因此,后续研究应集中从分子层面来探究青天葵提取物中的黄酮、多酚组分对氧化损伤应激过程中特定信号通路的调控机制。

