水果中有机酸及小分子糖类成分液相色谱测定研究进展
陈山乔,陈惠云,孙志栋,史婷婷,杨萌,张洪芹
(宁波市农业科学研究院,浙江宁波 315040)
水果在我国农业产业中占有重要地位,预计在2017年的水果总产量能够达到279.4万吨[1]。而与之相悖的是,我国在农产品,特别是容易变质的水果产品,在贮藏流通环节中易造成产品的严重损耗。水果在采收后的相当长一段时间内,依然保有活力并且进行着生理活动,但是由于其营养和水分的供应基本上被切断,所以水果有着独特的采后贮藏生理变化特性。有机酸和糖类物质与水果在采后贮藏过程中的品质下降有着密切的关系,这不仅是因为这些化合物是水果中主要的呈味物质[2],还在于水果的采后生理活动都有这两类物质的参与[3]。特别是随着化学计量学和系统生物学的发展,结合通路数据库,化合物定量分析能够对水果在贮藏中的生理变化特征有更深入的阐述。所以有机酸和糖类的测定对于研究水果贮藏保鲜至关重要。
定性和定量分析是对水果中有机酸和糖类研究的最初也是最重要的步骤之一。研究者们从很早开始就对食品基质中有机酸和糖类的分析表现出了兴趣,其中分析化学家协会(AOAC)早在 1932年[4]和 1936年[5]分别刊发了食品中有机酸和单糖的官方测试方法。由于常规的化学分析方法干扰严重,并且无法同时测定多个化合物等缺陷[6],所以基于色谱法的有机酸和小分子糖类分析方法受到了越来越多的关注。薄层色谱[7]和气相色谱[8]等方法相继被运用其中,但是由于定量能力不足,以及衍生化过程中分析物产生的变构、分解导致误差加剧[9]等缺陷,使得高效液相色谱法(high performance liquid chromatography,HPLC)的应用更显优势。而随着质谱离子源技术的发展,液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)的普遍应用,更是补足了HPLC的不足以及进一步发挥了其长处。基于此,本文对广义HPLC[10]测定有机酸、小分子糖类在水果保鲜研究中的应用进行了综述和展望。
1 水果中测定有机酸的HPLC和LC-MS方法
1.1 有机酸测定中的前处理
由于大多数水果的含水量高,除了少数种类外,普遍油脂含量较低,如表1所示,水果中使用HPLC法测定有机酸的流程中,前处理的方法相对简便。但是考虑色谱的分离效果,以及仪器的维护和耗材寿命,前处理相当重要。水或者水和有机溶剂混合溶液萃取是最常用的提取方法。例如《GB 5009.157-2016 食品安全国家标准 食品中有机酸的测定》[11]和《AOAC Official Method 986.13 Quinic, Malic, and Citric Acids in Cranberry Juice Cocktail and Apple Juice》[12]选用了水提作为通用的有机酸提取方法,而D'Urso等[13]使用了4倍体积甲醇对野草莓(Fragaria vesca)进行了24 h的提取。Souza等[14]运用10倍体积甲醇对番樱桃进行了24 h的提取。为了增加萃取效率,通常会使用超声波对水果如覆盆子[15]和橄榄[16]进行辅助提取。由于直接水提取的方法会将有机酸以外的其他亲水性分子如蛋白质和多糖,带入提取溶液中,所以为了提高分析方法的专属性以及色谱柱维护考虑,水提方法通常会配合固相萃取(solid phase extraction,SPE)来去除杂质分子[12,17],如España等[17]对桃汁进行了SPE净化后,能够直接进样分析。由于有机酸是含有羧基的酸性化合物,所以在有机溶剂萃取的过程中会将萃取溶剂酸化,使有机酸以小极性形态进入有机相以提高萃取效率[13,18,19],如Urso等[13]使用了甲酸对提取溶剂进行了酸化,而Parets等[19]选择了盐酸对由水和丙酮组成的提取溶剂进行酸化,对蔓越橘中的有机酸进行了提取。综上所述,由表1中归纳所得,面向于最大范围的水果或食品基质的权威检测标准,更倾向于纯水提取以达到最大的普适性。相反的,针对于某一特定水果的研究性论文所报道的提取方法,通常会根据具体的研究对象,使用不同的溶剂体系,以及超声,酸化等辅助手段。
1.2 有机酸的HPLC分离
目前已经有多种适用于甚至专门针对于水果中有机酸分离的HPLC柱产品,按照其填料类型和分离原理,可以分为反相(reverse phase,RP),亲水作用力(hydrophilic interaction chromatography,Hilic)(其中包括氨基键合填料)以及离子色谱(ion chromatography,IC)填料。
有机酸在一定酸度环境下能够在离子形态和分子形态间相互转换,所以在色谱分配上有着较宽的极性适用度,因此RP-HPLC特别是以C18为键合基团的色谱柱填料有着很广泛的应用。值得一提的是最新的国家标准《GB 5009.157-2016食品安全国家标准 食品中有机酸的测定》[11]和 AOAC发布的官方检测方法《AOAC Official Method 986.13 Quinic, Malic, and Citric Acids in Cranberry Juice Cocktail and Apple Juice》[12]都选择了使用C18键合的RP-HPLC进行了有机酸的分离。除此以外,也有为有机酸分离所特别优化的反相色谱柱被应用于水果的研究[13],如刘晓雪等[20]使用了T3色谱柱对橘子和树莓中的有机酸进行了分离。这类经过了末端封闭或者担体加固的色谱柱,能够耐受高酸度和纯水流动相,为有机酸在固定相和流动相间提供了足够大的分配系数差异从而进一步提高分离效果。其中有研究[20]对多种不同填料的色谱柱在有机酸分析中的效果进行了评价和比较,发现特别优化的反相柱拥有最好的分离效果。而传统的 C8填料,在苹果和柠檬的有机酸分析中,也有见诸报道[21]。
除了RP-HPLC外,属于广义HPLC[10]的IC也在水果中有机酸的分离中有着一定的应用。其中现行有效的两部农业部标准《NY/T 2277-2012水果蔬菜中有机酸和阴离子的测定 离子色谱法》[22]和《NY/T 2796-2015水果中有机酸的测定 离子色谱法》[23]分别采用了高效离子交换色谱(high performance anion/cation exchange chromatography,HPAEC/CEC)法和高效离子排斥色谱法(high performance ion exclusion chromatography,HPIEC)作为有机酸的分离方法。而离子色谱在研究性论文中的运用则相对较少,例如Schouten等[3]使用HPIEC法对番茄汁中苹果酸和柠檬酸进行了分离。除了离子色谱在耗材成本和普适性上均劣于反相色谱外,水果中除了有机酸外,还富含如氨基酸,糖醛酸,矿物质盐等其他离子容易对检测产生干扰也是其在水果有机酸分析中受到限制的可能原因。然而得益于离子色谱在分离离子化合物时良好的分辨率,在分析标准中,离子色谱依然不失为一种实用的方法。
由于有机酸作为亲水性化合物,所以Hilic色谱也被成功应用于分离中[20,21,24]。但鉴于Hilic色谱的分离效率以及柱流失的问题[25],这在水果有机酸的分析中运用并不广泛。
如表1所示,RP-HPLC法和IC法是最主流的有机酸分离方法,两者皆有被正式公布的官方检测标准所选用,其中引用RP分离模式的文献占据了最大的数量,虽然RP色谱在有机酸的分离中存在着专属性不高等缺点,但是通过下述的质谱检测器的补足,此类方法在研究领域中拥有最广泛的应用。在使用非质谱检测器的分析方法中,HPIEC法通常有着更高的灵敏度和分辨率[26]。Hilic色谱由于上述的柱流失原因造成的重现性下降[25],使用并不广泛,但如果借助LC-MS的定性能力,在一定程度上能够克服这个缺陷。
1.3 有机酸的HPLC分析法中的检测器
由于大多数有机酸有紫外吸收,所以广义的紫外检测器包括紫外-可见检测器(UV-VIS),和光电二极管阵列检测器(diode array detector,DAD)在反相色谱分离时应用广泛,其中包括上述的国家和国际标准[11,12]。为了能够尽量多的覆盖到各种有机酸的紫外吸收,检测波长通常被设置为末端吸收的210 nm附近[15,18,27],而对于一些在特定波长有强吸收的有机酸,也有研究会针对性地设置检测波长,如Shwartz等[24]设置254 nm对石榴中的抗坏血酸进行了检测。此外在 IC和 Hilic分离之后紫外检测器也常常被使用到[28]。经过表1中检测方法的汇总比较,可见虽然紫外检测器的应用广泛,然而其精密度和检测限(LOD)以及(LOQ)相比于其他检测器,特别是质谱检测器,存在很大劣势。
在基于IC的检测中,除了UV外,电化学检测器(electrochemical detect,ECD)[3]及其子集电导检测器(conductivity detector,CD)[22]也有运用。而且得益于CD的高灵敏度以及和IC的高契合度,农业部的推荐标准,《NY/T 2277-2012水果蔬菜中有机酸和阴离子的测定 离子色谱法》[22]和《NY/T 2796-2015水果中有机酸的测定 离子色谱法》[23],选用了CD作为检测方法。如表1所示,ECD检测器在灵敏度上达到了质谱的水平,然而考虑适用范围的原因,ECD类检测器的使用更加侧重在有机酸检测标准中。
随着离子源技术的发展,各种类型的质谱检测器(mass spectrometry detector,MSD)逐渐进入研究者的视野中。LC-MS将质谱(mass spectrometry,MS)直接作为HPLC的检测器,结合了HPLC的高分离能力和MS的高灵敏度、高分辨率以及高定性能力,具有远胜于常规HPLC的分析能力。由于前述的紫外检测器通常设置的波长靠近末端吸收,对检测带来了巨大的干扰,所以RP-HPLC分析水果有机酸时,MSD成为极其优秀的检测器。关于RP-HPLC-MS的研究,有着大量的报道。
作为最常规的有机质谱离子源,水果有机酸的分析中,电喷雾离子源(electrospray ionization,ESI)占据了主流地位,但是其他类型的离子源,例如大气压光化学离子源(atmospheric pressure photoionization source,APPI)[19]也有文献报道。由于有机酸拥有解离出H+成为酸根负离子的能力,本综述所引用的所有文献报道中,对有机酸的检测,均选择负离子模式。和离子源的选择不同,质量分析器在选择上呈现了更大的多样化,如三重四级杆(triple quadrupole detector,TQD)[13,20,21],离子阱(ion trap,IT)[19,29]以及高精度的轨道阱质谱(orbitrap)[13]。得益于MSD能够有效检测色谱端的共流出被分析物,所以 LC-MS法检测中,常规的 C18也能有很好的分析效果[13,14,17,19,20,29]。Hilic柱在搭配MSD检测时,由于MSD的定性能力,对柱流失造成的保留时间偏移有着更高的纠正能力[21]。虽然 LC-MS有着诸多优点,但是其普及还面临着很多问题,首当其冲的便是其高昂的设备价格和运维成本,以及对操作人员有着更高的培训要求,这可能就是有机酸检测标准中没有选用LC-MS方法的原因。
综上所述,UV-VIS和DAD这两种基于化合物的紫外吸收特性的检测器有最低的成本以及无损检测的优点,除了有单独的广泛应用外,还常常和MSD联用以对LC-MS的检测形成补充。MSD由于离子抑制的原因,通常搭配RP-HPLC或者Hilic-HPLC使用。特别是Hilic,如前述,MSD的定性能力能够对保留时间偏移进行纠正。同时,MSD的检出限和精密度都比常规的检测器更高。然而运维成本一直是其固有缺陷。而CD和ECD通常与IC结合使用,其中原因除了IC的流动相对此类检测器干扰最小外,成熟的商业解决方案的存在也是原因之一。

表1 水果中有机酸高效液相色谱法检测文献汇总Table 1 Summary of collected references reporting organic acid evaluation by HPLC
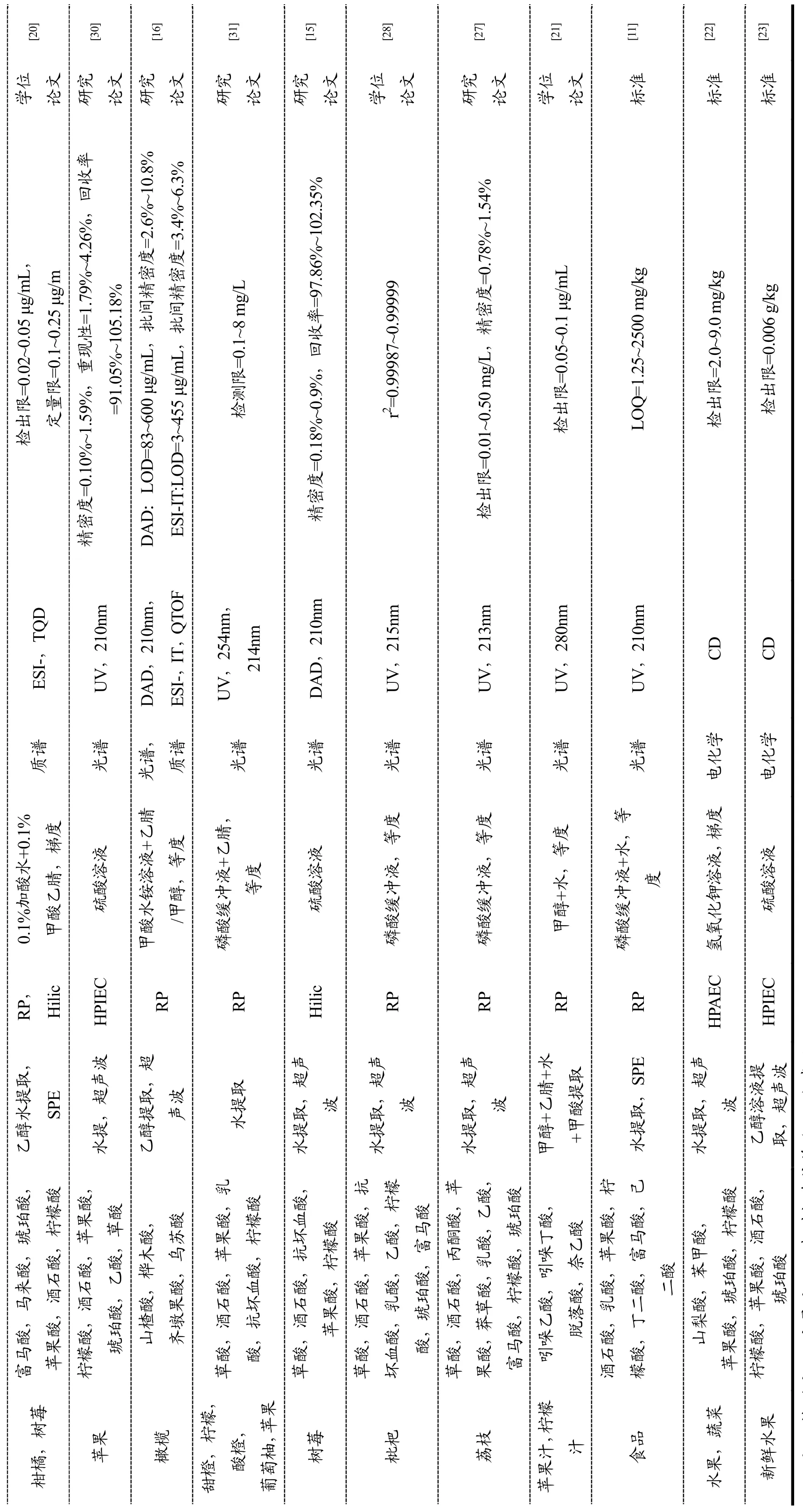
注:*检测限;**定量限;#以相对标准偏差(RSD)表示。

表2 水果中小分子糖高效液相色谱法检测文献汇总Table 2 Summary of collected references reporting small-molecular saccharides eval
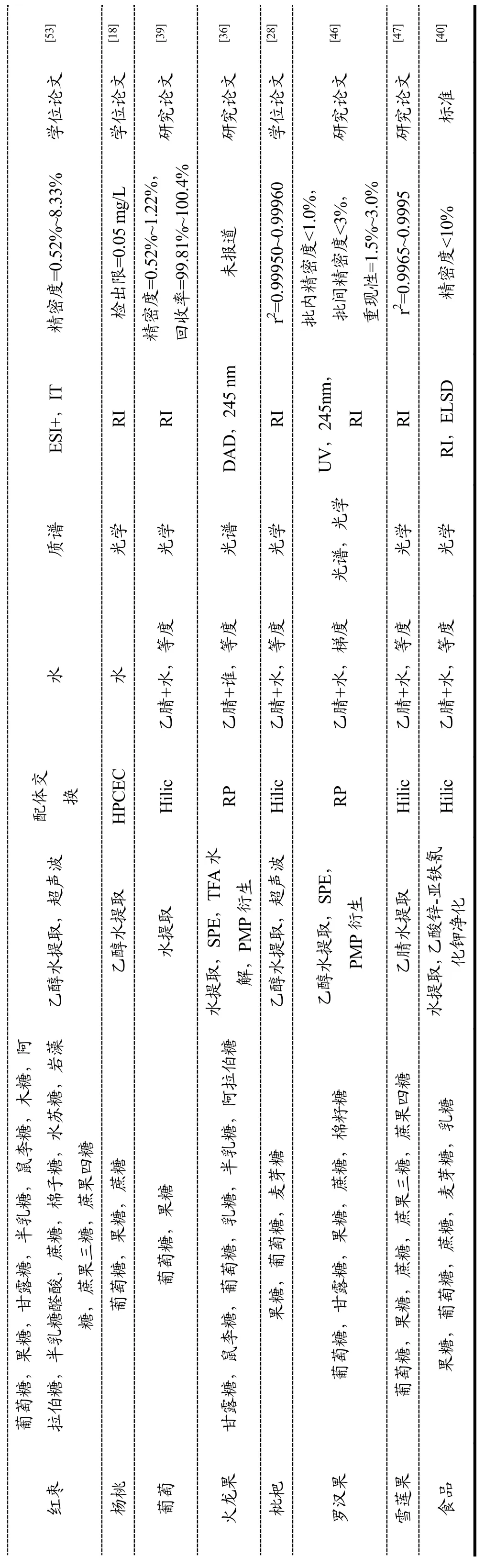
红枣葡萄糖,果糖,甘露糖,半乳糖,鼠李糖,木糖,阿拉伯糖,半乳糖醛酸,蔗糖,棉子糖,水苏糖,岩藻糖,蔗果三糖,蔗果四糖乙醇水提取,超声波配体交 换水质谱ES I+,IT精密度=0.52%~8.33%学位论文[53]杨桃葡萄糖,果糖,蔗糖乙醇水提取HP CE C水光学RI检出限=0.05 m g/L学位论文[18]葡萄葡萄糖,果糖水提取Hilic乙腈+水,等度光学RI精密度=0.52%~1.22%,回收率=99.81%~100.4%研究论文[39]火龙果甘露糖,鼠李糖,葡萄糖,乳糖,半乳糖,阿拉伯糖水提取,S PE,T FA水解,P MP衍生RP乙腈+谁,等度光谱DA D,245 nm未报道研究论文[36]枇杷果糖,葡萄糖,麦芽糖乙醇水提取,超声波Hilic乙腈+水,等度光学RI r2=0.99950~0.99960学位论文[28]罗汉果葡萄糖,甘露糖,果糖,蔗糖,棉籽糖乙醇水提取,S PE,PM P衍生RP乙腈+水,梯度光谱,光学UV,245nm,RI批内精密度<1.0%,批间精密度<3%,重现性=1.5%~3.0%研究论文[46]雪莲果葡萄糖,果糖,蔗糖,蔗果三糖,蔗果四糖乙腈水提取Hilic乙腈+水,等度光学RI r2=0.9965~0.9995研究论文[47]食品果糖,葡萄糖,蔗糖,麦芽糖,乳糖水提取乙钾酸净锌化-亚铁氰,化Hilic乙腈+水,等度光学RI,E LS D精密度<10%标准[40]
2 水果中测定小分子糖的HPLC和LC-MS方法
2.1 小分子糖测定中的前处理方法
水果中的小分子糖有两种存在形式,分别为组织中的游离糖,和多糖的组成部分。对于多糖中的单糖和寡糖单元,分析的前处理步骤之中需要将多糖水解,以得到游离状态的小分子糖。如表2所示,酸水解法是最常用的方法,其中三氟乙酸(TFA)[32~37]和盐酸(HCl)[32,38]都被用到。其中有研究[32]比较了TFA和HCl水解条件下单糖的回收率,发现在同样的水解参数下,TFA的得率更高,但是单糖的分解依然存在。这一研究表明,在多糖水解的步骤中,条件的优化是至关重要的。另外,酶也被用于香蕉中多糖的水解[38]。
对于游离的小分子糖,水[39~41]和有机溶剂[13,18,24,42~47]提取是常用的前处理提取方法。与有机酸的前处理一样,超声波也能应用于辅助提取[40,41,44]。由于后述的小分子糖类的色谱分离经常会涉及到耐受性较低的色谱体系,所以对前处理过程中的净化除杂需要更高的要求。除了利用乙腈和甲醇等有机溶剂本身来进行蛋白质沉淀以外,乙酸铅[43],铁氰化钾[40]和正丁醇[45]都有报道被用于蛋白质的脱除,SPE也被使用来进行小分子糖类试样的净化[18,46]。在检测桃核中游离小分子糖类的研究[45]中庚烷和乙酸乙酯分别被用来进行脂质和酚类的脱除。
2.2 小分子糖类的HPLC分离
对水果中小分子糖类的广义HPLC分离,按照原理,和有机酸类似,可以分为RP,Hilic以及IC。
小分子糖类作为多羟基化合物,拥有比较极端的亲水性,所以未经过衍生的小分子糖尚无 RP-HPLC直接的分离的报道。但是经过1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生的小分子糖,由于极性的改变在反相填料上能够进行保留,所以经过 PMP衍生步骤的小分子糖 HPLC分析,大多选用成熟稳定的 C18 RP-HPLC[33,36,37,46]。
由于糖类的高亲水性,Hilic是一种非常适合的色谱分离方法。除了常规的氨基柱和专用Hilic柱外,很多厂家都有推出为分离糖类针对性设计的 Hilic原理色谱柱。无论是对于多糖的水解产物[34,35]还是组织中的游离糖[39,40,42,43,47],Hilic色谱都做到了成功的分离。其中国家标准《GB 5009.8-2016食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》[40]即选用了氨基柱进行单糖的分离。如表2所示,Hilic色谱在研究中广泛用于小分子糖的分离,然而与其他分离模式比较,汇总的文献中Hilic色谱能够同时检测的糖类较少,这可能是由于分离专属性不足所致。
IC,特别是高效离子交换色谱在水果小分子单糖的分析中也有着广泛的应用[32,34,41,42,45]。基于糖类分子在高碱性条件下能够转化为阴离子形态[48,49],使用IC进行小分子糖分离时,必须选用强碱性流动相。其中AOAC官方分析方法《AOAC Official Method 2000.17 Determination of Trace Glucose and Fructose in Raw Cane Sugar》[50]将HPAEC/CEC定为果糖和葡萄糖的分离方法。
2.3 小分子糖的HPLC分析法中的检测器
由于大多数糖类分子在远离末端的波长下没有紫外吸收,所以对于未经衍生的小分子糖无法使用UV-VIS和DAD进行检测。对于经过PMP衍生后的糖分子,其在245 nm下有特征性的紫外吸收,所以对于PMP柱前衍生结合RP-HPLC分离的水果小分子糖类检测方法,均在245 nm下使用紫外检测器进行检测[33,36,37,46]。PMP衍生既能使糖分子在反相固定相上得到保留,又能够使待分析物呈现紫外吸收,是一种低投入的高效分析方法。但是衍生化的过程往往会带来误差和额外的成本,而且只有还原性的糖才能被PMP衍生。
对于未衍生的水果小分子糖类,不依赖紫外吸收的检测器都有很好的表现。其中示差折光检测器(refractive index detector,RI)作为常见通用检测器,在小分子糖类的检测中应用广泛。而归纳比较收集到的文献发现,示差检测器在水果小分子糖类的分析中,都是配合Hilic色谱使用[2,35,39,42,47]。这可能是和Hilic分离过程中流动相组成较为简单,并且没有极端的酸碱度有关。由于Hilic-HPLC和高普及度的RP-HPLC差异仅仅在色谱柱和流动相组成上,不需要额外购置HPLC配件,所以Hilic-RI是很好的低成本水果小分子糖类分析手段。但是由于RI检测器的灵敏度低,并且无法使用梯度洗脱条件,使得研究者们对其他更高效的检测手段有着巨大的需求。
蒸发光散射检测器(evaporative light scattering detector,ELSD)是新一代的通用检测器。得益于其通过将待测分子以气态或气溶胶颗粒形态的散射光作为检测原理,ELSD对没有发色基团的小分子糖类有着很好的适用性。其中前述的国家标准[40]将ELSD作为检测手段。和RI类似,使用ELSD的检测通常也会搭配Hilic分离进行[34,40,44]。这是因为ELSD的原理要求待测物质的挥发性必须低于流动相,并且流动相中需要尽量少的添加非挥发性物质所致[51]。相较于RI,ELSD在灵敏度和基线稳定性上有着更高的性能,并且能够使用梯度洗脱模式,但是ELSD除了较高的购置成本外,在运行时需要额外的载气供应使得其并没有RI使用的广泛。
在结合IC分离小分子糖的研究中,电化学检测器(electrochemical detector,ECD)特别是脉冲安倍检测器(pulsed amperometric detector,PAD)得到了广泛的应用。例如前述的AOAC官方标准[50]就将PAD设为检测方法。整理文献发现,IC和PAD通常都是配合使用[32,34,41,42,45,50],研究者们倾向于这种选择可能是由于在碳水化物分析中,PAD在强碱性的IC流动相环境中有着更好的信号响应,并且通过脉冲多电位能够抑制被分析化合物在电极上的沉积所带来的基线漂移[52]。如表2所归纳,ECD检测器的灵敏度和精密度媲美质谱检测器,而仪器的购置和运维成本则接近常规的HPLC,这可能是IC和ECD在小分子糖分析中广受青睐的原因。
同样,MSD在小分子糖的检测中也得到了应用[34,43,53]。如表2所示,其中对于ESI离子源的离子化极性,呈现了多样化,正离子模式[53]和负离子模式[43]都有使用。在关于椰枣中单糖和寡糖的研究中[43]正离子模式和负离子模式被进行了比较,发现负离子模式有着更多的信号响应。和IR以及ELSD一样,MSD在水果小分子糖的检测中与 Hilic色谱的配合使用最为常见。由于糖类通常存在多种同分异构体,所以MSD在应用于糖类检测时,通常会选用有多级质谱能力的TQD[43]或者IT[34,53]作为质量分析器。
综上所述,小分子糖因其分子结构特点,没有大的共轭体系,无法表现出远离末端吸收的光谱特特征,所以UV-VIS检测器无法适用于其色谱分析。而IR检测器由于检测灵敏度有限,以及无法适用色谱的梯度洗脱模式,其应用也受到了限制。所以在未衍生的情况下小分子糖类液相分析中检测器的选择相对有机酸范围狭窄。另外,由于单糖在组成寡糖时有多种接合位点和构象,导致小分子寡糖就有相对复杂的结构,所以在研究中,高精度和多级的质谱检测器被广泛应用以提高定性能力。
3 结论与展望
随着色谱分析技术的发展,HPLC方法对水果基质中少数特定种类的有机酸和单糖的测定已经趋于成熟,且有多种国内外的检测标准可供研究者和工业界参考。在探索性研究中,从目的和分析性能考虑,RP-HPLC-MS和Hilic-HPLC-MS是最佳的检测手段,不仅是因为其优秀的检测性能,而且MSD能够提供丰富的化合物结构信息,甚至能够一定程度脱离对标准物质的依赖。而出于成本考虑,RP-HPLC结合UV检测器并且在部分检测过程中进行柱前衍生化,可以在不需要购置任何额外组件的情况下在常规HPLC上完成检测。在工业界的应用中,被检测标准广泛采用,并且有成熟的商业化整合方案的HPEIC-PAD检测有着最高的综合性价比。
对于这两类化合物,未来的发展方向是提升总体的检测效率,比如开发能够同时检测多种目标化合物的分析方法。为此,在水果的研究中越来越多的用到,不需要依赖分析物特定的化学结构特征,并且可以对色谱分离中共流出问题和保留时间偏移问题形成互补性补偿的 LC-MS方法。另外各种针对有机酸和糖类分析优化的新型色谱柱和填料也被设计出来。此外,对于糖类来说,由于其普遍存在同分异构体并且能够形成数量众多的寡聚体,对于分析方法的定性能力有着更高的要求,应用多级质谱和高精度质谱检测器对于常规检测器难以分析结构的小分子寡糖的定性定量也至关重要。

