高通量测序分析Nisin对腹泻小鼠肠道菌群的影响
贺美玲,王纯洁,贾知锋,斯木吉德,敖日格乐*
(1.内蒙古农业大学 动物科学学院,呼和浩特 010018;2.内蒙古农业大学 兽医学院,呼和浩特 010018)
肠道菌群与人类的疾病有着紧密的联系,通过摄入适量益生菌可在一定程度上改善肠道微生物结构[1]。人体肠道中定植的菌群数量是人体基因总数的150倍左右。当肠黏膜微生物屏障被破坏时,大量的致病菌定植于肠道中,从而引起炎症[2]。腹泻病是由致病性大肠杆菌(pathogenicEscherichiacoli)所引起的人畜共患疾病之一[3]。目前,治疗由致病性E.coli所引起的腹泻病主要采用抗生素进行治疗,但是抗生素的滥用会导致诸多问题(如耐药性等),也会导致动物免疫力降低[4]。通过摄入益生菌可平衡动物肠道内菌群结构,使肠道内产生活性物质以及有益的活性微生物,动物及人肠道中乳酸杆菌、双歧杆菌、大肠杆菌及拟杆菌可作为人和动物肠道内生理指示菌[5]。近年来,研究发现,肠道菌群结构与多种疾病存在一定的关系,肠道菌群的紊乱可引起多种疾病的发生[6]。
据报道,肠道是人类及动物的主要消化、吸收的场所,肠道中存在大量的细菌[7-8]。Nisin具有抑菌作用,其机制是Nisin通过不同的结构域嵌入到细胞膜中,阻止细胞壁生物合成[9]。据研究,乳酸链球菌属于益生菌,可改善小鼠肠道微生物结构[10],有效治疗炎症性肠病,溃疡性结肠炎和腹泻等[11-12]。因此,研究乳酸菌代谢产物具有一定的价值。
酸马奶是蒙古族传统的发酵马奶[13],其含有丰富的益生菌(如乳酸乳杆菌等)[14]。Nisin是乳酸乳杆菌的一种独特的代谢产物,具有抗菌作用[15]。本试验通过致病性E.coliO1构建小鼠腹泻病模型,对腹泻小鼠灌胃Nisin,通过高通量技术对小鼠盲肠微生物进行分析,以研究Nisin对腹泻小鼠盲肠微生物的影响。
1 材料与方法
1.1 材料
1.1.1 试验动物 SPF级昆明小鼠,雌雄各半,体重(20±2)g(内蒙医科大学实验动物中心)。
1.1.2 试验材料 乳酸链球菌素(Nisin),由内蒙古农业大学牛生产学实验室提取保存[16];抗生素:氨苄青霉素(ampicillin),购自葵花药业集团湖北武当有限公司;盐酸环丙沙星(ciprofloxacin),购自吉林省百年六福堂药业有限公司。
1.2 主要仪器
恒温培养箱(JC-SPJ-480),济南精诚实验仪器有限公司;净化工作台,上海新苗医疗器械制造有限公司;全自动立式电热压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;电子分析天平(CP224C),上海奥豪斯仪器有限公司。
1.3 试验方法
1.3.1 Nisin对感染致病性E.coliO1小鼠体内抗菌保护率的测定 为改善细菌性腹泻病的发生,选择5~6周龄70只鼠(雌雄各半)随机分成7个组,空白对照组灌胃灭菌生理盐水(表1)。各试验组连续灌胃5 d,2次·d-1(上午8:00,下午16:00),每次0.3 mL,除空白对照组外,各组在第5天末次给药1 h 后,腹腔注射0.3 mL 80% MLD的E.coliO1(2.50×1011CFU·mL-1),试验结束时,观察并记录各组感染后48 h 内的死亡数量,计算其保护率[17]。
保护率=(阴性对照组死亡数-药物组死亡数)/阴性对照组死亡数×100%[17]。
表1Nisin对感染致病性E.coliO1小鼠的保护率分组情况及给药方案
Table1GroupinganddosageregimentofthetestaboutNisin’sprotectionratstomiceinfectedwithpathogenicE.coliO1

组别 group小鼠/只 Mice给药方案 Administration regiment空白对照组 Blank control group10注射生理盐水,灌服灭菌生理盐水阴性对照组Negative control group10灌服灭菌生理盐水,先给药5 d,注菌,再给药2 d,2次·d-1,0.3 mL·次-1环丙沙星组Ciprofloxacin group10灌服环丙沙星0.13 g·mL-1,同上注菌氨苄青霉素组Ampicillin group10灌服氨苄青霉素0.001 g·mL-1,同上注菌Nisin低剂量组Nisin low dose group10灌服Nisin 0.001 g·mL-1,同上注菌Nisin中剂量组Nisin medium dose group10灌服Nisin 0.002 g·mL-1,同上注菌Nisin高剂量组Nisin high dose group10灌服Nisin 0.003 g·mL-1,同上注菌
以上药物每次配合蒸馏水灌服,单只动物单次所用药量需用0.3 mL蒸馏水配合灌服。下表同
The above drugs are drenched to mice with distilled water each time, single dose of single animal need to use 0.3 mL of distilled water with gavage. The same as below
1.3.2 Nisin对感染致病性E.coliO1小鼠肠微生物屏障的影响 从保护率筛选情况可知,筛选出最佳剂量的药物组见表1。从50只SPF小鼠(雌雄各半)中随机抽取10只作为空白对照组灌胃生理盐水,其余小鼠腹腔注射E.coliO1悬液0.2 mL·只-1(0.5×109CFU·mL-1)建模,阴性对照组结束时(注菌48 h后),对存活小鼠进行样品采集,见表2。
表2Nisin对小鼠肠道菌群的影响试验分组情况及给药方案
Table2GroupofdosageregimentofthetestaboutNisin’seffectonintestiualmicroflorainmice

组别 Group小鼠/只 Mice给药方案 Administration regiment空白对照组 Blank control group10不造模,灌服灭菌生理盐水阴性对照组 Negative control group10先灌服灭菌生理盐水5 d,注菌造模,再连续灌胃10 d,先给药5 d再注菌,然后连续给药10 d,2次·d-1,每次0.3 mL·只-1环丙沙星组Ciprofloxacin group10灌服环丙沙星0.13 g·mL-1, 同上氨苄青霉素组Ampicillin group10造模,灌服氨苄青霉素0.001 g·mL-1,同上乳酸链球菌素组 Nisin group10造模,灌服0.002 g·mL-1,同上
1.3.3 Nisin对外周血淋巴细胞及其亚群的影响 对每组5只小鼠的眼眶取血置于肝素钠采血管中,取200 μL 抗凝血,加10倍稀释的溶血素2 mL,摇匀、离心及PBS洗涤3次,留沉淀,加150 μL PBS 稀释,调细胞浓度为 1×106·μL-1;每份50 μL,分成3份,加入上样管分别加10 μL小鼠淋巴细胞荧光标记抗体 CD3-R-PE/CD19-FITC、CD4-PE/CD8-FITC,4 ℃冰箱避光标记 30 min,加 2 mL PBS,1 500 g 离心7 min, 弃上清; 沉淀中加200 μL PBS,悬浮振荡,流式细胞仪分别计数10 000 个细胞,圈门淋巴细胞,检测 CD3+T、CD4+T、CD8+T 和CD19+B 细胞所占百分数。
1.3.4 盲肠粪样菌落计数[20]第15天灌药后2 h 内在无菌操作台中取出盲肠,将各组盲肠内容物分别用无菌生理盐水稀释(1∶10),即为原液的101~108倍,分别取50 μL涂布于选择性培养基[双歧杆菌培养基(BBL)、伊红美兰琼脂培养基(EMB)、乳酸菌培养基(MRS)、肠球菌选择性培养基(EF)]置于不同条件的培养箱中,分别检测双歧杆菌、E.coli、乳酸杆菌、肠球菌数量(每种菌设三个重复)。菌落计算公式为:菌落数量(lg CFU·g-1)=lg[X/0.5×稀释倍数/盲肠内容物质量(g)],同稀释度平均菌落数为X,菌群数量用lg CFU·g-1(盲肠内容物)表示[18]。给药方案同表2。
1.3.5 Nisin对盲肠微生物的影响 第15天灌药后2 h内在无菌操作台上收集各组小鼠盲肠粪便0.5 g置于无菌无酶EP管中,-80 ℃超低温冰箱保存。利用PCR对每组4只小鼠盲肠内容物341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′) 16S RNA V3~V4区进行扩增。对扩增产物用干冰保存送往北京诺禾致源生物信息科技有限公司针对样品进行PCR测序。详细步骤见参考文献[21-22]。
1.4 数据统计
应用Excel软件对测定数据进行处理;并用SAS 9.0统计软件ANOVA对数据进行方差分析,P<0.05为有显著性差异。
2 结 果
2.1 Nisin对感染致病性E. coli O1小鼠的体内抗菌保护率
Nisin对感染致病性E.coliO1小鼠的保护率见表3。Nisin中剂量组对感染致病性E.coliO1小鼠的保护率高于Nisin低剂量组为37.50%,环丙沙星和氨苄青霉素组保护率为50%,Nisin组保护率低于环丙沙星组,但是这种益生菌的代谢产物的耐药性极低,且副作用极小[18]。
2.2 E. coli O1对小鼠十二指肠的影响
十二指肠在腹泻期间的作用可能更明显[23]。模型组中小鼠出现腹泻、被毛蓬松、行动迟缓等症状,说明造模成功。模型组中十二指肠出现肿胀,短绒和绒毛脱落。对照组中十二指肠绒毛排列整齐紧密,上皮细胞无脱落,黏膜完整(图1)。
表3Nisin对感染致病性E.coliO1小鼠的保护率
Table3ProtectionrateofNisintomiceinfectedwithpathogenicE.coliO1

组别Groups动物数/只Animals存活数/只Survival保护率/%Protection rate空白对照组 Blank control group1010100阴性对照组Negative control group1020盐酸环丙沙星组Ciprofloxacin group10650氨苄青霉素组Ampicillin group10650Nisin低剂量组Low dose of Nisin10425Nisin中剂量组Middle dose of Nisin10537.5Nisin高剂量组High dose of Nisin10425

图1 大肠杆菌对腹泻小鼠十二指肠的影响Fig.1 Effects of E. coli O1 on the duodenum of mice with diarrhea
2.3 Nisin对外周血淋巴细胞及其亚群的影响
由表4可知,纵向看,乳酸链球菌素(Nisin)组中CD4+T、CD8+T、CD3+T及CD19+B细胞百分比显著高于空白对照组、环丙沙星组及氨苄青霉素组(P<0.05);阴性对照组中CD4+T、CD8+T、CD3+T及CD19+B细胞百分比均显著降低(P<0.05)。Nisin组中CD4+T/CD8+T细胞比值均小于其他各组。



%
大写字母不同表示同列组间差异显著(P<0.05)
Different capital letters means significant difference within the same column (P<0.05)
2.4 Nisin对腹泻小鼠盲肠微生物活菌数的影响
Nisin对小鼠盲肠微生物的影响,Nisin组、环丙沙星组以及氨苄青霉素组中大肠杆菌的数量显著低于阴性对照组(P<0.05),尤其以Nisin组效果最佳。Nisin组中乳酸杆菌的数量显著高于阴性对照组、环丙沙星组以及氨苄青霉素组(P<0.05),并且环丙沙星组中双歧杆菌的数量显著低于阴性对照组(P<0.05),环丙沙星组和氨苄青霉素组均显著低于Nisin组(P<0.05)(表5)。



lg CFU·g-1
小写字母不同表示同列间差异显著(P<0.05)。下表同
The difference in lowercase letters indicates significant difference between the same columns (P<0.05). The same as below
2.5 Nisin对腹泻小鼠盲肠微生物菌群多样性的影响
利用Mothur软件对每组样品的OTU数量进行计算,并且代表了组间样品的丰度[24](表6)。在所有样品中,OTU数量最多的为空白对照组(1 652.75) 和Nisin组(1 507.75),最小值为氨苄青霉素组(930.00),说明Nisin组和空白组中菌群丰度很高,并且各组样品存在差异。组间样品中菌群多样性指数为Nisin组(ACE=1 417.25,Chao1=1 378.45,Shannon=7.56)显著高于阴性对照组(ACE=969.54,Chao1=340.29,Shannon=6.63)。同时,Alpha多样性分析也表明,给小鼠注菌后,其Nisin组中肠道菌群的多样性高于阴性对照组,各组之间存在差异显著(P<0.05)。Shannon的值越大,生物多样越高,Nisin组为7.56,其余各组均在6.47~7.13之间,说明Nisin组对腹泻小鼠盲肠微生物的多样性越高。Nisin组中Simpson值显著低于除环丙沙星组外的其他各组(Simpson值越低表明菌落多样性越高)。各组之间Coverage的值均在0.97以上,因此,样品中序列未被检测到的可能性极低。
表6各组样品粪便菌群的OTU数量及Alpha多样性
Table6OTUnumberandAlphadiversityoffecalmicroflorainallgroups

组别GroupOTUACEChao1ShannonSimpsonCoverage空白对照组Blank control1 652.75a1 950.47a1 905.61a7.13a0.008 1b0.970 7阴性对照组Control1 227.75c969.54e340.29e6.63b0.017 4a0.971 1环丙沙星组Ciprofloxacin1 275.50c1 571.13b1 536.16b6.91b0.001 9e0.977 3氨苄青霉素组Ampicillin930.00d1 117.71d1 087.81d6.47b0.005 7c0.974 4Nisin组 Nisin 1 507.75b1 417.25c1 378.45c7.56a0.003 3d0.975 0
2.6 主坐标分析(PCoA)
主坐标分析反应各样本中菌群构成的相似性(图2)。基于Weighted Unifrac距离和 Unweighted Unifrac 距离来进行PCoA分析,并选取贡献率最大的主坐标组合进行作图展示。如果样品距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样品倾向于聚集在一起,群落差异很大的样品则会远远分开。本试验中,Nisin组(NIG)、空白对照组(BCG)、阴性对照组(NCG)、盐酸环丙沙星组(CIPG)、氨苄青霉素组(AMPG)几乎聚在一起。
2.7 Nisin对腹泻小鼠盲肠微生物菌群构成的影响
5组样品的菌群组成在门(phylum)水平上最大丰度排名前10的物种水平见表7,图3。以Bacteroidetes(拟杆菌门)、Firmicutes(厚壁杆菌门)和Verrucomicrobia(疣微菌门)3个菌门为主,所占比例90.75%以上。其中Nisin 组中Bacteroidetes(拟杆菌门)所占比例显著低于空白对照组(BCG)、阴性对照组(NCG)、盐酸环丙沙星组(CIPG)、氨苄青霉素组(AMPG)。Nisin组(NIG)中厚壁杆菌门(Firmicutes)所占比例显著高于空白对照组(BCG)、阴性对照组(NCG)、盐酸环丙沙星组(CIPG)及氨苄青霉素组(AMPG)。Nisin组(NIG)中Verrucomicrobia(疣微菌门)所占比例显著高于空白对照组(BCG)及氨苄青霉素组(AMPG),高于阴性对照组(NCG)。Nisin组(NIG)中Cyanobacteria(蓝藻门)所占比例显著高于空白对照组(BCG)、阴性对照组(NCG)及氨苄青霉素组(AMPG)。综上所诉,Nisin的摄入,有利于增加Firmicutes(厚壁杆菌门)、Verrucomicrobia(疣微菌门)和Cyanobacteria(蓝藻门)的数量,从而使肠道菌群的紊乱得到改善。
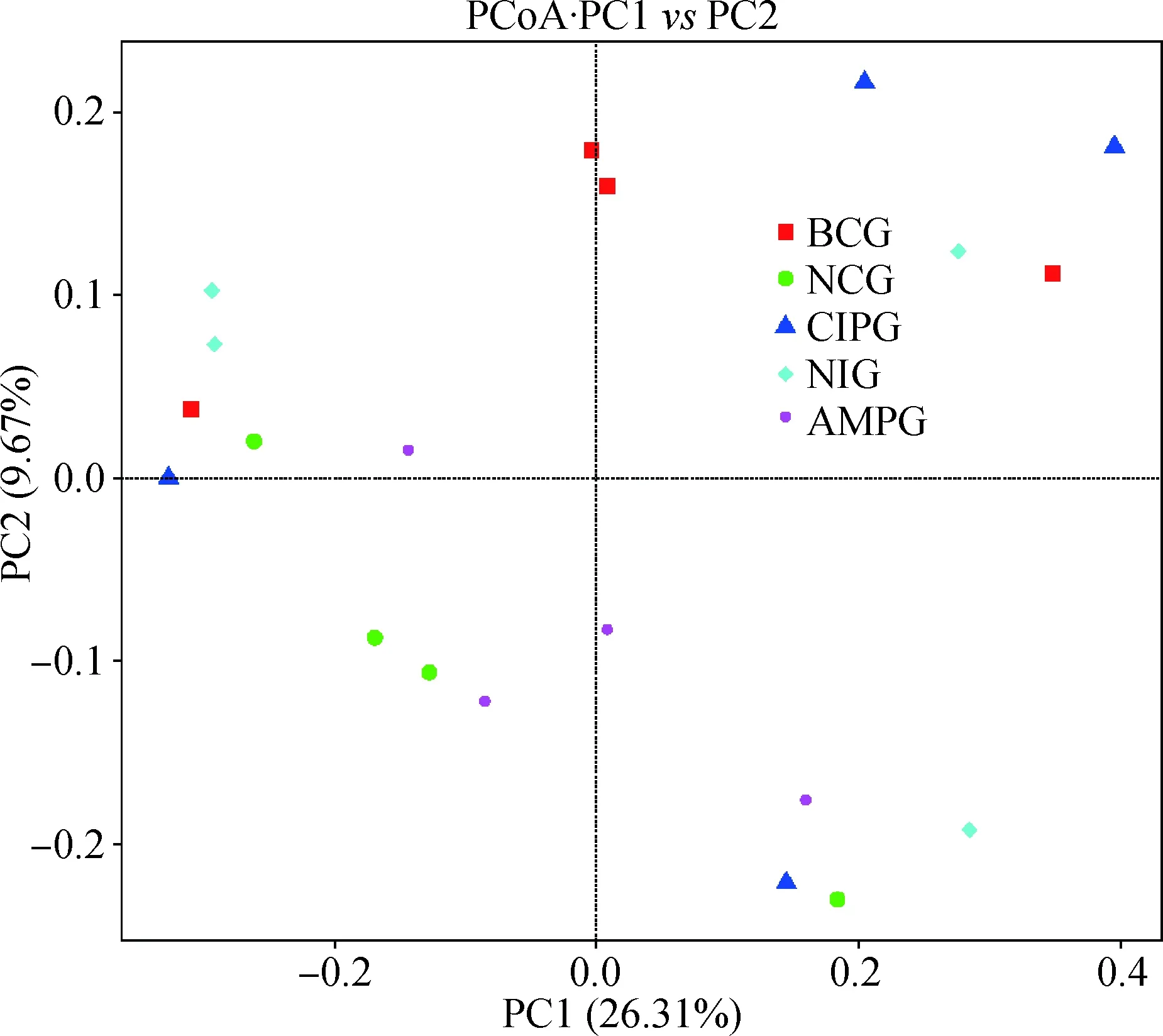
图2 各组样品Unweighted Unifrac 距离PCoA分析Fig.2 Unweighted Unifrac distance PCoA analysis for each group of samples
表7Nisin对微生物门水平上的影响

Table 7 Effects of Nisin on phylum levels%
大写字母不同表示同行间差异显著(P<0.05)。下同
Different capital letters indicate significant differences among peers (P<0.05). The same as below

图3 各组样品在门水平上的相对丰度Fig.3 Relative abundance of each samples at phylum level
由表8和图4可知,5组样品的菌群组成在属(genus)水平上丰度值:Nisin组(NIG)中Candidatus(变形杆菌纲)、Clostridium(梭状芽胞杆菌)、Akkermansia属和Lactobacillus(乳杆菌属)所占的比例分别为8.51%、8.03%、4.73%和4.09%。氨苄青霉素组(AMPG)中Bacteroides(拟杆菌属)和Lachnospiraceae(毛螺旋菌属)所占比例分别为10.27%和9.76%。纵向看:Nisin组可显著提升Candidatus(变形杆菌纲)、Clostridium(梭状芽胞杆菌)的比例;氨苄青霉素组(AMPG)可显著增加Bacteroides(拟杆菌属)和Lachnospiraceae(毛螺旋菌属)的比例。
表8Nisin对微生物属水平上的影响

Table 8 Effects of Nisin on microbial genus levels%

图4 各组样品在属水平上的相对丰度Fig.4 Relative abundance of each samples at the level of genus
3 讨 论
T细胞在成熟后分化出CD3抗原,随后转移至外周淋巴组织,它与特异性抗原或细胞相互接触时,发挥免疫功能,在机体的细胞免疫和体液免疫诱导中均具有重要作用[25]。据报道,乳酸链球菌素(Nisin)对呼吸系统的治疗具有显著的作用,可防止病原微生物感染的腹腔疾病[26]。本试验中,Nisin可显著增加CD4+T、CD8+T、CD3+T及CD19+B细胞百分比以及CD4+T/CD8+T的比值。Nisin是一种稳定性好、毒副作用小的抗菌肽,人或家畜食用后在消化道内可快速被蛋白水解酶消化成氨基酸[27]。根据口服给药药物特定传输这一特点,一些学者通过口服给予双歧杆菌三联活菌,进入肠道后,在肠道定植形成一道肠道菌群屏障来抵御外来病原菌及病毒的入侵[28-29]。研究表明,Nisin处理后可对大肠杆菌等具有显著的抑菌作用[30]。Stevens等[31]证明了Nisin对细菌的抑制作用主要是破坏其细胞壁的通透性。同时,通过摄入一定量的Nisin可以改善腹泻小鼠肠道菌群结构以及增加单胺类神经递质的浓度[18]。通常,E.coli进入动物机体后,使肠道菌群失调,通过破坏肠黏膜屏障功能而引起疾病(如腹泻等)[32]。肠道内致病菌(如大肠杆菌和肠球菌等)和益生菌(如双歧杆菌、乳酸杆菌等)数量的变化是肠道健康的重要指标[18]。体内试验表明,使用Nisin具有显著减少大肠杆菌的数量,显著增加乳酸杆菌数量的作用,这种趋势与文献[18]相符。Bacteroidetes(拟杆菌门)和Firmicutes(厚壁杆菌门)成为小鼠肠道优势菌群,这一结果与相关研究报道的优势菌群结果相似[33]。腹泻小鼠肠道微生物结果表明,Nisin组使ACE、Chao1、Shannon显著增加,而阴性对照组中ACE、Chao1、Shannon均显著降低,说明E.coliO1可破坏小鼠肠道微生物的动态平衡,使小鼠肠道微生物多样性显著降低,这一结果与参考文献相似[34]。
在门水平上,Nisin组中小鼠盲肠微生物Bacteroidetes(拟杆菌门)最低,接近空白对照组。Nisin组中Firmicutes(厚壁杆菌门)、Verrucomicrobia(疣微菌门)和Cyanobacteria(蓝藻门)所占比例最高且高于其他各组。Firmicutes(厚壁杆菌门)是维持肠道健康的主要益生菌,在肠道中可以加快多糖发酵[35]。阴性对照组和氨苄青霉素组中Firmicutes(厚壁杆菌门)、Verrucomicrobia(疣微菌门)和Cyanobacteria(蓝藻门)最低,Bacteroidetes(拟杆菌门)最高。据报道,Bacteroidetes(拟杆菌门)数量增多可增加患败血病和阑尾炎的风险,是肠道中主要的致病菌,这类细菌可以导致腹泻病的发生[35]。在属水平上,Nisin组中Candidatus(变形杆菌纲)、Clostridium(梭状芽胞杆菌)、Akkermansia属和Lactobacillus(乳杆菌属)所占比例较高。阴性对照组中Akkermansia属、Candidatus(变形杆菌纲)和Clostridium(梭状芽胞杆菌)所占比例显著低于Nisin组,很可能是因为E.coli打破了机体菌群平衡所引起的腹泻病。
4 结 论
Nisin可显著增加小鼠盲肠中乳酸杆菌的数量,显著减少大肠杆菌数量;同时增加OTU聚类丰度和淋巴细胞百分比,对提高厚壁杆菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、蓝藻门(Cyanobacteria)以及乳杆菌属(Lactobacillus)的数量效果显著。可见,Nisin对增加以上菌属具有一定的作用。

