铁观音茶树转录因子TCP4基因的克隆与序列分析
魏沙沙,邱小凤,蔡雪玲,孙威江1,,陈志丹*
(1.福建农林大学园艺学院,福建 福州 350002;2.福建农林大学安溪茶学院,福建 泉州 362400;3.福建省茶产业工程技术研究中心,福建 泉州 362400;4.福建省茶产业技术开发基地,福建 泉州 362400)
TCP转录因子家族在玉米TB1、金鱼草CYC和水稻PCF中最早发现,取首字母(TB1-CYC-PCF)进行缩写,得到名称TCP。TCP转录因子是一类植物特有的转录因子,其特征是拥有一个由60个氨基酸组成的高度保守的TCP结构域,此结构域是一个非典型的bHLH(碱性-螺旋-环-螺旋)结构域,广泛参与了植物生长发育的特定阶段连同部分生理生化反应的过程,如参与调控叶、花型和侧枝的生长发育,这些在拟南芥[1-3]、玉米[4]、水稻[5]、棉花[6-7]、苹果[8]、黄瓜[9]、葡萄[10]、西瓜[11]、矮牵牛[12-13]等的研究中已被发现。在对TCP2、TCP3、TCP4、TCP11、TCP16、TCP24等的研究中发现,TCP家族的功能在各成员内普遍存在着相似性[14-17]。根据TCP结构域的序列特点,分成Class I和Class II两个亚家族。又因TCP结构域的差异,Class II可以被细分为CIN支和CYC/TB1分支[18]。相关研究显示,TCP4基因在细胞分化环节中发挥着重要控制作用,表达变化将导致营养生长、生殖生长、细胞的增殖速度、育性、衰老速度以及叶片大小的变化[16]。TCP基因家族被证明能调控植物叶片大小和形状[19],但该转录因子在铁观音茶树中的功能研究较少,本研究克隆得到铁观音茶树CsTCP4基因,对其特征进行生物信息学分析,探究确定铁观音茶树CsTCP4基因对于茶树叶片的调控作用,为铁观音茶树种质资源研究利用提供理论基础。
1 材料与方法
1.1 试验材料
以种植在福建农林大学福州校区南区茶园的铁观音品种茶树为样品材料,采摘一芽一二叶鲜叶迅速用液氮固样,置于-80℃冰箱贮藏备用。
1.2 试验方法
1.2.1 总RNA的提取与反转录 参照多糖多酚植物总RNA提取试剂盒方法提取茶树总RNA,参考Takara公司的SMARTer 5′/3′ Kit Component试剂盒说明书,逆转录成cDNA用于RACE扩增。
1.2.2 TCP4基因5′端的克隆 根据陈志丹的前期试验[20]得出的已知片段TDP49,设计两条3′RACE上游引物TDF49 3′-1和 TDF49 3′-2,以AP为逆转录引物进行反转录,然后以反转录的cDNA为模板进行巢氏PCR扩增,第一轮反应引物用TDF49 3′-1和AUAP,将第一轮PCR产物稀释100倍作为模板,以TDF49 3′-2和AUAP作为引物进行第二轮扩增。
1.2.3 TCP4基因3′端的克隆 对于TCP4基因5′端序列的扩增,采用5′-RACE CDS Prime A进行反转录,然后以反转录的cDNA为模板进行巢氏PCR扩增,以UPM和TDF49 5′-1进行第一轮扩增,将第一轮PCR产物稀释100位模板,以UPM和TDF49 5′-2为引物进行第二轮扩增。
2 结果与分析
2.1 铁观音茶树总RNA的提取与检测
从提取的铁观音茶树RNA的电泳检测图谱(图1)可知,RNA的28S和18S的条带清晰,而28S rRNA的亮度和18S rRNA相比,亮了将近1倍,经紫外分光光度计检测结果(见表2),OD260/OD280值在1.8~2.2之间,说明样品中没有蛋白质和其它有机物的污染,且没有水解为单核酸,OD260/OD230大于2,说明RNA样品中没有其它小分子物质的干扰,因此可见提取的总RNA具有很好的完整性和很高的纯度,可以满足后续RACE扩增需要。

表1 铁观音茶树转录因子TCP4克隆涉及引物信息
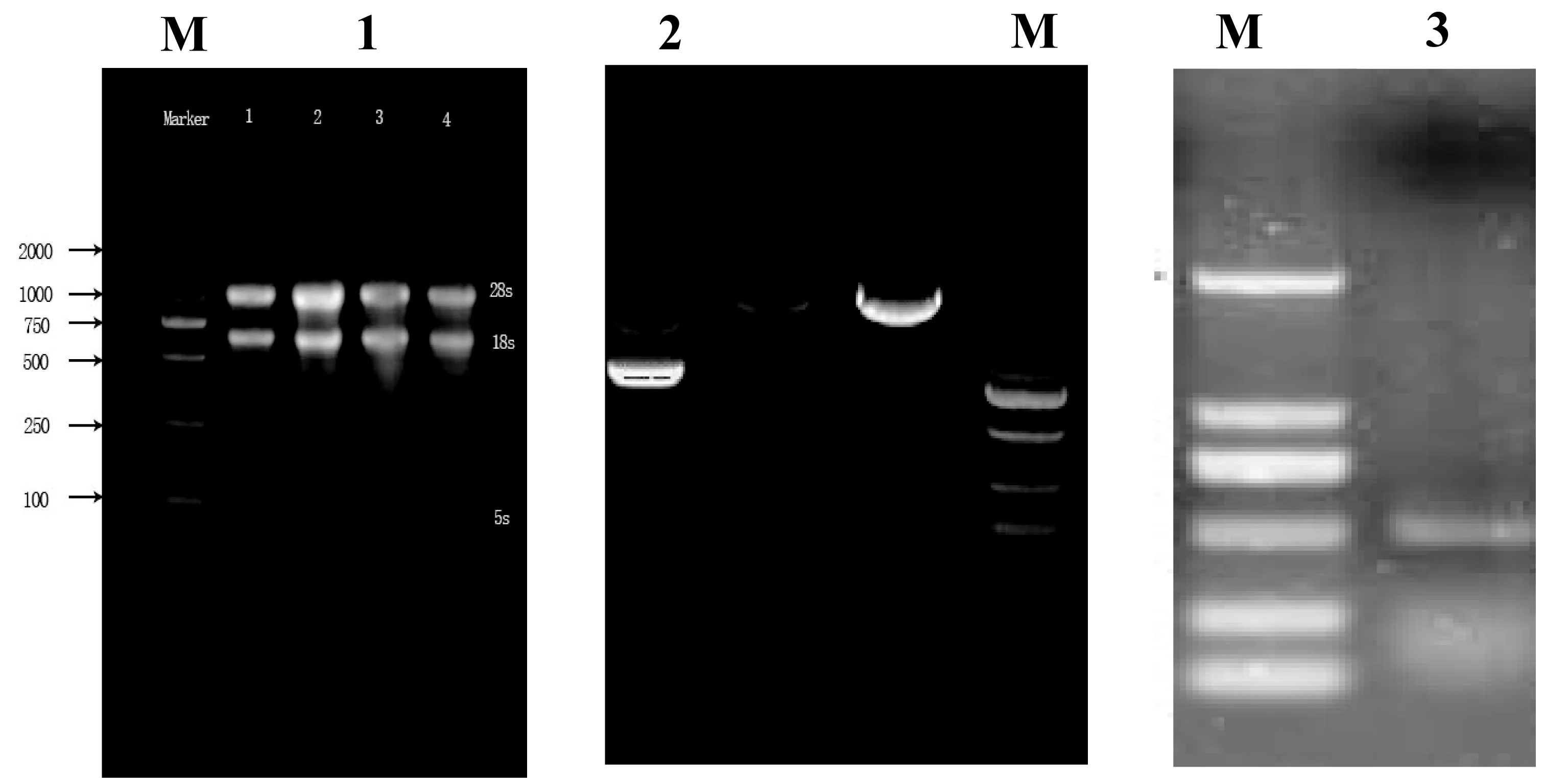
图1 铁观音茶树转录因子TCP4的克隆
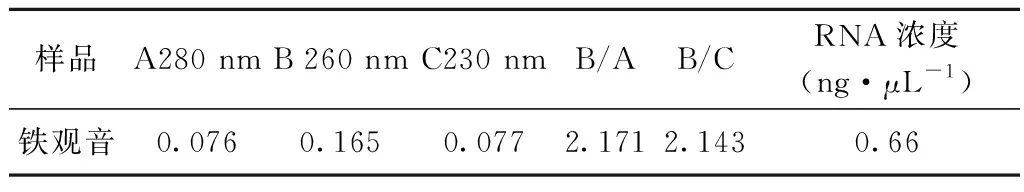
表2 铁观音茶树总RNA浓度
2.2 铁观音茶树TCP基因cDNA全长的克隆及序列分析
2.2.1 铁观音茶树TCP基因的cDNA 3′RACE的克隆与序列分析 以AP为逆转录引物进行反转录的cDNA作为模板,利用两条3′RACE的上游引物进行两轮PCR扩增,测序结果表明该3′RACE的产物为845 bp,与预期大小相符,且与已知保守区片段有100bp的碱基重叠,所以可以确定所获得的片段为铁观音茶树TCP基因的3′RACE部分。
2.2.2 铁观音茶树TCP基因的cDNA 5′RACE的克隆与序列分析 以5′RACE CDS Primes A反转录的cDNA 为模板进行巢氏PCR扩增,测序结果表明该5′RACE产物的片段长度为472bp,与预期大小相符,且与已知片段有108bp重叠碱基,所以可以确定此片段为铁观音茶树TCP基因的5′RACE部分。
2.2.3 铁观音茶树TCP基因cDNA全长序列分析 使用DNAman软件将5′RACE、已知序列和3′RACE cDNA核苷酸序列进行拼接,获得TCP基因的基因全长序列为1264bp(图3),其中开放阅读框(Open reading frame,ORF)为795bp,编码264个氨基酸,5′非编码区为171bp,3′非编码区为298bp,ATG为起始密码子,TAG为终止密码子。
2.3 铁观音茶树转录因子TCP4生物信息学分析
2.3.1 氨基酸序列的构成成分和理化性质 利用DNAman软件对TCP氨基酸进行基本信息分析,铁观音茶树TCP4基因开放阅读框为795bp,编码264个氨基酸。使用Expasy网站对其氨基酸基础结构及性质进行相关分析可知,转录因子TCP的组成有氨基酸264个;理论等电点是7.01;相对分子量是29559.02kDa;负电荷氨基酸残基(Asp+Glu)为30个;正电荷氨基酸残基(Arg+Lys)为30个;不稳定指数为58.57>40,属于不稳定蛋白;蛋白的亲水性平均系数(GRAVY值)是-0.717<0,属于亲水性蛋白;分子式:C1287H2010N372O407S11,总原子数为4087,氨基酸组成中丝氨酸(Ser)含量最高,为11.7%,谷氨酰胺(Gln)、甘氨酸(Gly)、亮氨酸(Leu)占比均为7.6%,含量仅次于丝氨酸。

图2 铁观音茶树TCP基因的cDNA全长序列
2.3.2 铁观音茶树TCP的系统进化树构建分析 采用MEGA5.05软件的NJ法,将铁观音茶树TCP基因的氨基酸序列与已知的茶树、草莓、桃树等14种TCP基因的氨基酸序列进行同源进化树分析(图3)。结果表明,所克隆出的铁观音茶树TCP蛋白与草莓、桃树蛋白的一致性高达100%,在亲缘关系上最接近。其次是亚麻荠,与胡桃、枣、葡萄等的进化距离较远。

图3 铁观音茶树TCP系统进化树
2.3.3 磷酸化位点的预测分析 真核细胞的蛋白质磷酸化位点能够识别和修饰不同蛋白质的不同位点,是生物体内一种普遍的调节方式,主要发生在丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)残基侧链的羟基上,在细胞信号转导的过程中发挥重要作用。结果表明,TCP基因含有多个磷酸化位点,其中丝氨酸位点最多,其次是苏氨酸位点,络氨酸位点最少,只有1个。说明磷酸化和去磷酸化的调控作用很大程度上影响到铁观音茶树TCP4转录因子蛋白的活性,如表3,图4所示。

表3 铁观音茶树TCP4磷酸化位点推测

图4 铁观音茶树TCP4蛋白磷酸化位点推测图
2.3.4 信号肽分析 利用在线网站SignalP对此序列进行信号肽分析,根据meanS-score大于0.5则预测为分泌蛋白,存在信号肽,小于0.5则没有信号肽,如图5所示,可知茶树转录因子TCP4不存在信号肽序列,属于非分泌蛋白转录因子TCP蛋白。

图5 铁观音茶树TCP4蛋白信号肽分析
2.3.5 跨膜区域推测 通过TMpred对铁观音茶树TCP基因进行跨膜区域分析,跨膜区域存在不同的两类(图6)。第一类是从外向内的跨膜螺旋,一处跨膜区位于182~204位氨基酸之间,得分率是787(++);第二处跨膜区在219~238氨基酸之间,得分率是121(++),总得分是908。第二类是从内向外的跨膜螺旋,仅存在一处跨膜,位于189~211位氨基酸之间,得分率是388。而TCP家族属于转录因子家族,与DNA结合在细胞核内进行,因此上述两种现象都不予以采用,TCP蛋白没有参与跨膜的可能。
2.3.6 蛋白的功能结构域分析 SMART软件分析结果表明该蛋白在25~160的位置具有一定的活性(图7)。同时经过Prosite软件分析结果表明,该蛋白还具有TCP家族特征多肽序列:RKDRHSKVCTARGPKDRRVRLSAHTAIQFYDVQDRLGYGRPSEAIDWLMKEAKSAIDAL,位于27-85位置(图8)。
3 讨论
TCP家族成员在细胞的伸长调控、雌雄配子发育、种子萌发、胚胎发育、叶片衰老、茉莉酸合成、光形态建成以及生物钟调节等方面发挥着重要功能[5],TCP家族被划分为classI和classII两个亚族,classI由相关度较高的蛋白组成,被称为PCF亚家族(PCF1和PCF2),主要是通过PCNA基因的启动子对DNA生理生化产生影响[3],对植物生长发育进行正调控。classII对植物生长起到负调控作用,据其结构域差异又被分成两个分支,CIN和ECE(CYC/TB1),CIN分支主要参与到植物叶片、子叶等边缘器官的发育,变异会导致叶片不正常且边缘褶皱[21-26]。
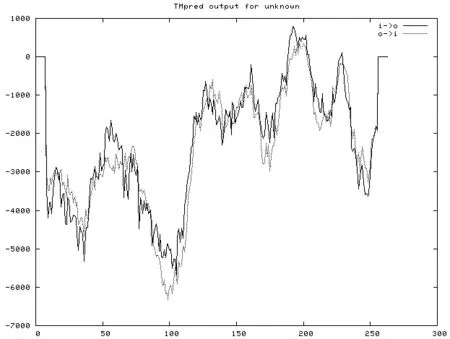
图 6 铁观音茶树TCP4蛋白跨膜区域分析
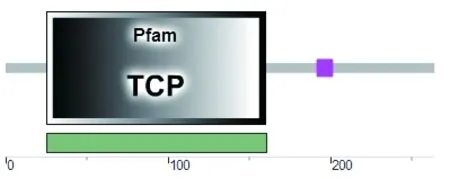
图7 铁观音茶转录因子TCP基因编码蛋白的功能构域
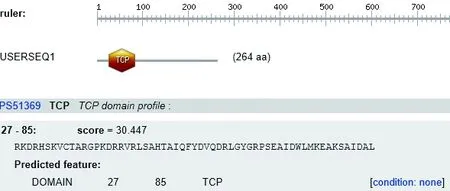
图8 铁观音茶树TCP合成酶活性位点
根据本试验的分析结果显示,铁观音茶树转录因子CsTCP4属于classII家族的CIN分支。Nath等人发现,CIN基因的突变会影响金鱼草的叶片形态,认为CIN基因会促进叶缘生长停滞[27]。CIN型转录因子对叶片形态变化功能的作用在拟南芥、金鱼草和番茄等已有研究,证明该基因能够限制正在发育的叶原基边源的细胞增殖[22]。其次在拟南芥的研究中发现,TCP4基因也是作为MicroRNA319a的靶基因参与到叶片的调控过程[3]。TCP4表达出现变化将导致营养生长、生殖生长、细胞的增殖速度、育性、衰老速度以及叶片大小的变化[16],有相关研究表明,TCP4基因表达若是向上调整,会引起植物花瓣变得狭小,花药的生长发育缺乏。而且它能促使茉莉酸的合成,进一步影响叶片的衰老过程。根据克隆出来的铁观音茶树TCP4基因的cDNA全长序列,采用生物信息学方式进行分析得出,它由264个氨基酸组成,分子量为29559.02kDa;等电点为7.01;属于亲水性蛋白;不稳定蛋白;未含信号肽;磷酸化和去磷酸化的调控在很大程度上影响到TCP4转录因子蛋白的活性基因;含有特殊固有的bHLH结构域。构建系统进化树,得出CsTCP4基因与草莓和桃树的TCP亲缘关系比较近。综上所述,推测出CsTCP4基因在铁观音茶树的生长发育中主要调控叶片的的生长发育,尤其是对叶片形态方面起到一定的影响作用。在前期研究中,本研究试验材料供体铁观音茶树也显示出茶树生长树型较直立、叶片生长较为旺盛、茶树叶片呈现稍斜向上生长的性状,基因荧光定量表达分析也显示该基因在试验茶树样品中表达量较高,因此推测该株铁观音茶树的这些性状可能与TCP4基因高表达的正向调控有关,后期试验可以运用实时荧光定量PCR技术,研究CsTCP4 基因在铁观音茶树不同时期和叶位的表达量,具体还需要进一步开展基因功能验证研究分析,从而利用科学手段来改变表达程度,调节叶片的生长发育,改良基因遗传特性,调整生长模式,对培育出整体品质更高的铁观音茶树有指导意义。

