严厉的监管成就强大的产业
——FDA药物监管110年剪影(连载二)
文/孟八一

勇敢的承担 艰难的博弈
从1906年的《纯净食品和药品法》到1984年的仿制药立法改革,美国的四部法律基本反映了美国制药工业的形成和发展过程。110年来,FDA在这四部法律,尤其是1938年、1962年和1984年的三部法律框架内执法,并扮演着美国公众健康保卫人的角色,承担了美国市场药物质量担保人的责任。而美国的制药工业也随着这些法律的变化而变化,从欧洲制药的跟随弱国演变成制药强国。至今,无论是美国药物监管法律,还是美国制药工业都已经成为全球制药工业的领跑者。一路走来,FDA所经历无疑是一条“严厉执法和艰难博弈”之路。
一、 与美国医学会的药物评价权之争
在20世纪70年代之前,AMA(美国医学会)对美国制药工业和美国医生、药剂师有着主导性影响。美国医学会无论从学术还是从医学伦理上,都是美国医生学术和职业心理的寄托。作为药品的使用者,美国医学会垄断了药物评价和药物推广的传播渠道,例如,1950年之前,美国医学会的“JAMA(美国医学会杂志)”和“ New and Nonofficial drugs(美国新药剂)”一直是药物评价领域的标杆型刊物,而其评价依据就是使用药品的医生和一些研究机构的研究结果。
但是,美国医学会和美国制药工业有着很深的商业利益关系。例如,JAMA利用人们对美国医学会的信任,每期都要登载大量的药品广告,从中获取巨额收入。由于经济利益的掺入和评价方法的落后,医生和病人逐渐对AMA的药效评价方法产生了怀疑。尤其是在1960年国会辩论Kefauver议员的反药物垄断法提案时,AMA在国会公开反对FDA有关“药效学监管”的提案。随着1962年Kefauver-Harris法案得以通过,药物评价权力之争就不可避免地摆在了FDA和AMA面前。AMA和PMA(美国制药协会)联合起来与FDA抗争。AMA提出要坚决维护医生用药的选择权(Self-Medication)。他们认为“医生用药体会”是药物药效学评价标准,或者至少是重要标准之一,反对FDA提出的新的、科学的药物评价方法(FDA已经从1950年开始建立医院网收集数据,并通过统计学方法进行药效评价)。在FDA要求普强公司的Panalba退市而打官司的时候,为了获得AMA对普强的支持,普强的老板居然威胁AMA要停止在JAMA上刊登广告。AMA为Panalba背书,反对FDA要求Panalba退市。随着法庭对Panalba一案的判决,不但普强输了官司,AMA也失去了药物评价权。由于FDA得到了部分独立立法权(rulemaking),FDA拟定了监管“虚假药物广告”的法规,并且在CFR21中写入了对药物促销和药物广告的监管权,广告商和促销人要对药物疗效负法律责任。就这样FDA完全堵死了AMA发布药物评价结果的渠道,FDA成为药物评价的唯一官方机构。
二、 药物市场大清洗——药物有效性评价(DESI 1966~1969)
(一)背景
发生于1960年的“沙利度胺”事件催生了美国的Kefauver-Harris法案。本着安全、有效的原则,Kefauver-Harris法案对新药研究、开发、上市多做出了严格、科学的规定以及制定了相应的审查和批准程序。但是,如何处理1938年至1962年上市“老药”是个令人棘手的问题。根据1938年的法案,这些药都没有经过“有效性”审查。Kefauver法案只是概念性地提出必须解决这4000个药物有效性问题,并授权FDA实施。但是具体由谁负责,采取什么方式来解决这一问题,却是当时大家都回避的问题。
第一,因为这4000个药物广泛用于美国各个医疗单位和个人,开启有效性评价有可能引发大面积的药物下架,会不会造成治疗上的混乱和无序?第二,当时FDA大量的人力资源在应付调查性新药(IND)和新药申请(NDA),抽不出多少人来进行药效评价。除了人力资源有限,FDA雇员本身的知识、经验和能力也不足以评价如此之多且正在使用的药物,其中有些是常用的药物。第三,按各州的法律,药物退市要经过听证。4000个药,4000个听证,那是不可能完成的任务。所以在这个问题上,时任FDA局长Larrick(1953~1966)对制药商采取了妥协态度,除了要求制药商在1964年4月17日前提交“药物有效性证据”(substantial evidence of effectiveness) 之 外,几乎什么都没做。
用1962年的Kefavuer新法规评价1962之前上市的药物,FDA有三个潜在的政治风险:
(1)“无效药物”由谁来发布?会引起治疗混乱吗?
(2)FDA 人手不够,技术上也做不了,那么由谁来做?
(3)退市权不在FDA手里,凡是退市就面临打官司,如何做。
这三个问题是纯粹的政治和法律问题,所以新上任的局长必须用政治和法律手段解决之。
(二)过程
1966年6月,James Goddard就 任FDA局长(1966~1968)。有着极大抱负的Goddard决心要解决摆在FDA面前的最大难题:开启1962之前上市药物(约4000个)的有效性评估,宣布开始DESI(Drug Efficacy Study Initiative)。Goddard 首先和美国国家科学院(NAS)、国家学术理事会(NRC)签订了合同,由国家级科学家按照学科对1962年前上市的药物做出有效性报告。同时,要求制药商在1967年1月14日前提交药物有效性证据。来自科学院的180位科学家分成30个课题组开始工作。他们审查和评估的依据是:
(1)制药商提供的药物简报;
(2)制药商提供的补充性有效证据;
(3)FDA文档;
(4)已有相关文献。
Goddard以其无比的智慧和大无畏的勇气开启人类药物史的一次革命,同时树立了很多敌人。只可惜,1968年由于Goddard 对儿童用大麻发表了不当言论而辞去了局长职务,由他推荐的Jey继任局长。截至1969年4月15日,NAS/NRC写出了有关4349个药物的2824份报告。FDA并没有马上公布这些报告,而是先由FDA的工作人员消化这些报告,按照报告把药物分为四类:
(1)effective 有效;
(2)probably effective 可能有效;
(3)possible effective 可疑有效;
(4)ineffective 无效。
有效药物(1)列入DESI 表,可能有效的(2)补充数据后列入DESI表,可疑有效(3)补充数据或退市,无效药物(4)退市。
FDA从1968年开始逐步在“联邦公告 ”(Federal Register) 上 公 布 评 价 结 果。1969年到1970年大批药物的评价结果公布,DESI转入了实施阶段(Drug Efficacy Study Implementation)。 随 着 Federal Register不 断公布DES报告,无效药物开始退市,矛盾爆发了。制药商和美国医学会AMA联手向FDA发难。1969年 FDA拿 Upjohn的 Panalba( 四环素和新霉素组合)开刀,拟将组合抗菌素类药物驱逐出市场,但是遇到了Upjohn的顽强抵抗。Upjohn认为FDA没有药物退市决定权,药物退市必须经过国会听证。美国医学会(AMA)站在Upjohn一边,认为“美国医生的自由用药权”不能侵犯,甚至当时FDA的顶头上司——美国健康教育和福利局长Finch要求FDA放水Panalba。FDA新任局长Ley不惜与自己的老板反目,也要将Panalba驱逐出美国市场。官司一直打到美国最高法院,美国最高法院驳回了Upjohn 的申诉,并修改了CFR21,给予了FDA药物退市权。从此,FDA彻底将临床使用了多年的组合抗菌素逐出美国市场。但此事过后不久,Ley还是被迫辞去FDA局长的职务。
(三)结果
截至1984年《药物价格竞争和专利期补偿法案》颁布,美国FDA与美国国家科学院、美国学术理事会合作,通过文献评价,专家评议,临床试验相结合的方法,评价了3443个药物,其中:2252个有效,1015个无效,167个未定。
由于1984年的Hatch-Waxman法制定了仿制药的新规则,从1966年开始的历时18年的美国药效性评价DESI很好地解决了“新法规”管理“老药”的难题,并使之与1984年法规衔接。DESI评价的药物数量之多,用人之多,占用的资源之多,利益对抗之复杂,在当时都是前所未有的。
(四)要素解析
1、“无效药物”的结论由谁来做,怎么做?
聪明的Goddard把它交给了美国科学院和美国学术理事会(NAS/NRC),由美国最高地位的科学家提交药效性评估报告,以取信于民。同时解决了FDA资源不足和技术能力欠缺的问题。
2、FDA对NAS/NRC的报告再评估
控制评估报告出台的时间、数量和范围便于各利益方和FDA逐步适应、调整DESI过程。将评 估(Drug Efficacy Study Initiative, 1966) 和实 施(Drug Efficacy Study Implementation,1969)分为两步走,给市场和企业改错的机会和时间。也给FDA自己提升水平,改正错误,调节利益的时间和空间。
3、联邦公告
在“联邦公告”上分批公布药物评估结果更彰显了药效学评价(DESI)的法律性和强制性。
4、敲山震虎
一开始就抓住最有影响力的典型药物,拿大公司开刀,致使人们相信FDA实施药物有效性评价(DESI)的坚定性,断掉劣质药的生存幻想。例如:1968年1月,FDA就在“联邦公告”宣布“生物黄酮素”(Bioflavonoids 维生素P)退市。之所以选择生物黄酮素,一是用药广泛,二是Bioflavonoids 背后是制药巨头Abbott,Bristol-Myers和Merck。经过激烈的国会听证,以FDA胜利,“生物黄酮素”退市告终。
5、借用法律诉讼得到药物退市权
打赢Panalba的官司,击败Upjohn制药公司(Upjohn是当时美国前十大制药公司之一,后来被辉瑞收购),使法官、陪审员,甚至民众都相信FDA有能力独立判断药物退市,而不需要听证。因为这一案例,改变了美国药物退市需要法院听证的制度,美国最高法院将药物退市权交给了FDA。
美国1966年~1969年的药物有效性评价(DESI)彰显了科学与法律相互协调和相互支持的重要性。科学支持了立法和执法,而法律又维护了科学。
三、 严格执法 以儆效尤
2011年,FDA查 出 了 印 度Ranbaxy生产Lipitor(通用名阿托伐他汀)的工厂存在数据真实性(Data Integrity)(修改报给FDA的数据)和GMP问题。Ranbaxy刚刚挑战了默克的Lipitor专利,拿到了180天独占权,为了Lipitor的生产和销售,Ranbaxy对FDA百依百顺,并且,在2012年向FD提交了预算为5亿美元的整改计划。但是FDA不依不饶,把Ranbaxy告到了美国司法部(因为Ranbaxy在美国的工厂也被查出问题)。 美国司法部(DOJ)做出判决, 要 求Ranbaxy实 施“Data Integrity” 法规,直到FDA认为达标为止。美国司法部还要求Ranbaxy必须雇佣完全独立的第三方,并且是“Data Integrity”的专家对Ranbaxy的整改进行审计,而且FDA还要对专家审计结果再审计。FDA提出了55条整改意见,Ranbaxy花巨资请了美国的顾问, FDA又要求Ranbaxy雇佣“Data Integrity”专家和GMP专家到现场监督整改。总之,Ranbaxy怎么做也满足不了FDA的要求。结果FDA撤销Ranbaxy的27个ANDA,并要求Ranbaxy对其在美国和印度的工厂做出彻底的改 变(to make fundamental changes to points in the US and India)。2013年 美 国 司 法 部 判决Ranbaxy虚假陈述,cGMP违规,对FDA数据欺诈,罚款5亿美元。2014年走投无路的Ranbaxy卖给了印度的太阳制药(引自:Justice News justice.gov May 13, 2013)。
如此严厉的监管给美国制药工业带来了什么?在FDA近似苛刻的监管之下,美国的制药工业衰退了吗?
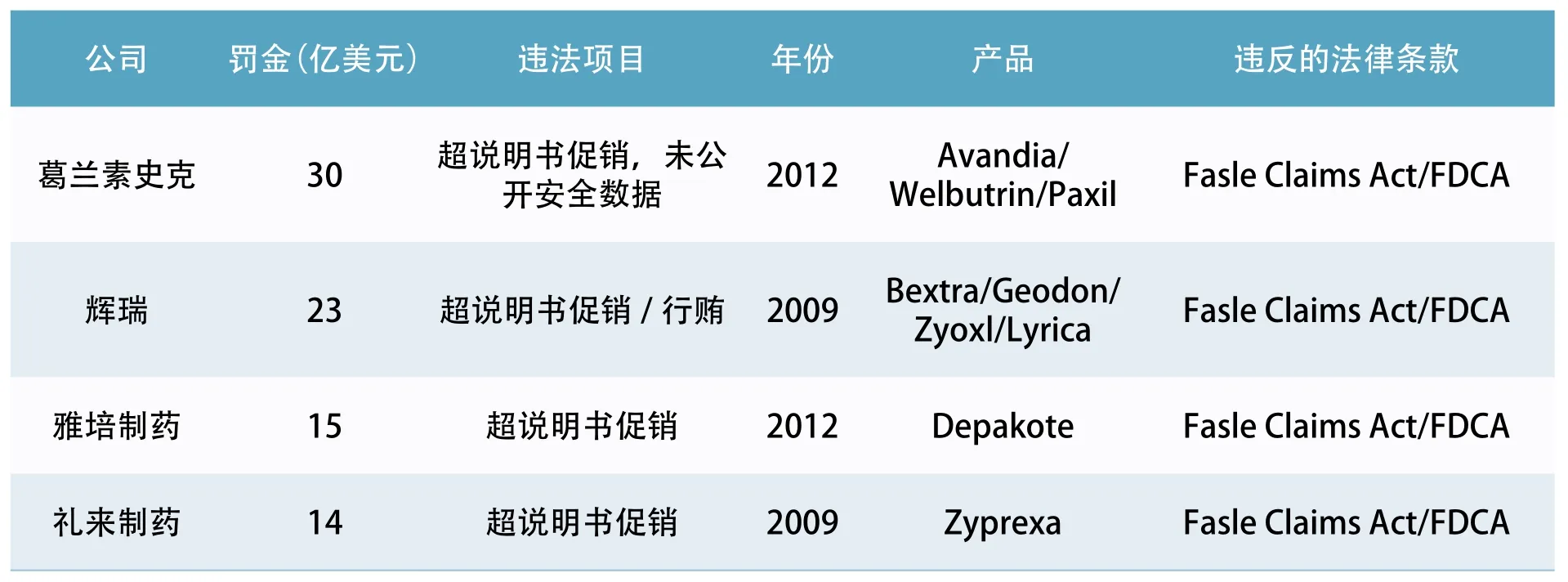
表2 .FDA对制药巨头超出说明书促销开出的罚单
严厉的监管成就强大的产业
一、 FDA与企业的关系
有人把美国制药企业和FDA的关系形象地描 述 为“A Marriage Not Made in Heaven”,直译为“非天堂之作的婚姻”(引自: BY ANHUSA Oct. 15, 2013 )。我觉得更好的译法是“婚配冤家”。
从FDA成立之日起到20世纪90年代,FDA一直与美国的制药工业进行着监管责任与商业利益的博弈。尤其是到20世纪60至70年代,在Kefauver-Harris修正案实施受阻的年代,FDA内部的政治家和国会的代言人公开宣称:FDA的监管追求和制药企业的逐利性存在着不可调和的对立,而二者的利益平衡点,唯有高质量的药物。
110年来,FDA一直刻意与制药企业保持距离。就执法而言,FDA的这种刻意比较容易被民众所接受。不过,由于美国执政党派的变更(民主党倾向于FDA强化药物监管,共和党倾向于放松监管),也曾强迫FDA与制药企业进行“蜜月期”合作(friendly business),FDA也曾经试图放松对制药企业的监管。但是,这种蜜月期很快就遭遇了社会舆论的强烈谴责和来自FDA内部的抵制(FDA的审查员为此把时任FDA局长告到了法院)。所以110年来,FDA与企业的关系主线还是监管与被监管。

1938年的FDCA和1962年的Kefauver-Harris修正案之后,由于监管标准的提高,美国的制药企业经常与FDA对簿公堂。但是,美国制药工业却在与FDA的争斗中得到了快速的发展。后来制药企业逐步认识到,监管标准本身可以构成企业的竞争力,可以排斥弱势企业的价格竞争。于是,更多的药企从与FDA的对抗转为与FDA的合作。客观地讲,即便在1938年FDCA颁布时,在大多数企业恐慌,畏惧,反抗的同时,仍然有一部分企业家赞同FDA的举措。例如,亨氏食品的创建人Henry J.Heinz就公开支持联邦政府对食品和药品监管,他认为这有助于民众对产业的信心重塑。创建施贵宝公司的Edward Robinson Squibb博士、创立雅培公司的Wallace Calvin Abbott都对FDA的药物监管给予了很高评价。例如,曾任Genetech总裁G.KirkRaab就认为,在美国,制药公司总裁的主要工作就是配合FDA,保持与FDA的良好沟通是每一个制药企业的生命线。Raab在Abbott任总裁时,其手下几个高管由于经常抱怨FDA而遭其解雇。
1992年,美国制药企业抱怨FDA工作效率太低,药物审批太慢,而FDA则向国会陈述资源紧张,人手短缺。于是,国会通过了处方药申请缴费法案(PDUFA),同意FDA向申请人收取费用,此费用专款专用,只能用于提高新药审批效率,同时也规定了FDA必须答复药物申请的时间限制。这样除了国会外,制药企业也成了FDA的拨款人。
现在FDA和美国制药企业的关系维持着一种很良性的互动关系。这些年,即便有药害事件发生或者有新的法规变更,FDA与企业更多的是沟通,已经没有了当年彼此之间的咄咄逼人和尖酸刻薄。
二、 美国制药工业的发展
美国制药工业在过去半个多世纪的成就有目共睹。欧洲是现代制药工业的发源地,也是美国制药的传授人。从20世纪60年代美国制药崛起,到80年代美国制药对欧洲制药全面赶超,再到今天无论是美国的药物研发水平还是新药上市数量和药物销售的世界占有率已经把欧洲甩在了身后,美国已经成为世界医药的霸主。如果要找出其中的差别,唯一就是美国有一个FDA!
前文已经比较详细的描述了FDA110年变化过程,FDA从当初成立不足20人,隶属于美国农业部的一个小小实验室,发展成为今天有着近17,000雇员,监管着占美国GDP 1/4经济的强大政府机构。110年前美国成立FDA初衷不过是为了对付“假药”和“食品掺假”,但到后来FDA承担了药物安全,药物有效的责任,直到成为美国医药产业的监管者和引领者。FDA的雇员总数比其他发达国家和地区药物监管人员的总数还要多。FDA仅药审中心CDER就接近6000名雇员。FDA的监管法规和文件接近11000页。如此强大的监管,引领着美国制药工业由弱到强。
美国成为世界制药霸主的过程已有很多文章描述。为说明这一过程,本文仅把从1974年到2017年世界制药15强、20强的变化,以销售额为指标,列表如下。
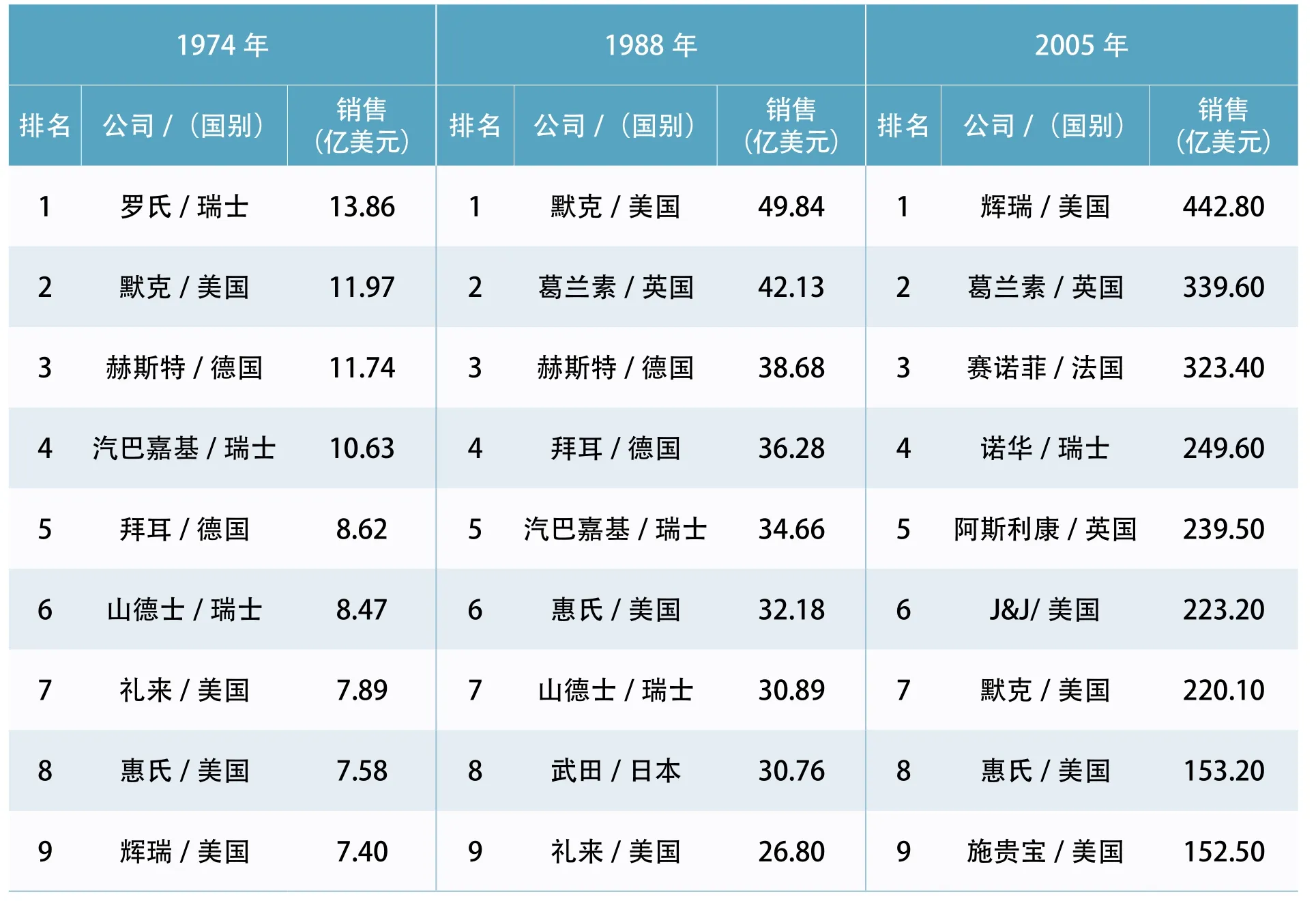
表3 . 1974年~2005年全球制药15强排名及药物销售额
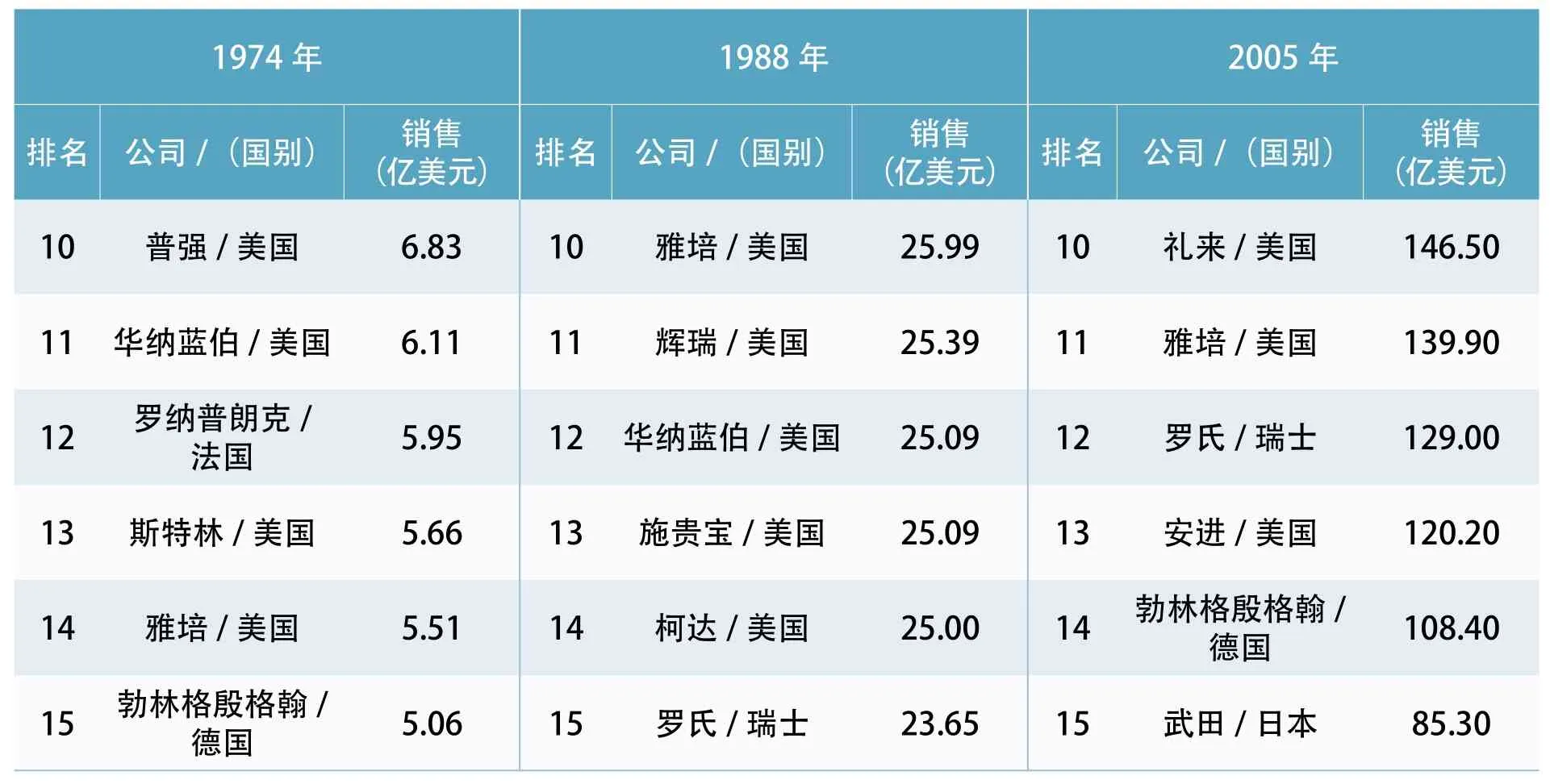
资料来源:根据Report 2009 by Arthur Daemmrich,Harvard Business School 数据整理

表4 . 2017年全球制药20强排名及销售额
如果把表3、表4的数据与FDA的人员扩张、经费扩张,权力扩张相联系,可以推论:正是FDA的“严厉监管”,成就了美国制药的“强大产业”!
三、 美国制药协会的更名轶事
最能说明FDA重塑美国制药工业的例子莫过于美国制药协会的更名过程。美国制药协会成立于1958年,是美国最具影响力的制药工业的协调者和组织者。其原来的名称为“Pharmaceutical Manufactures Association”, 简 称“PMA”。1962年Kefauver-Harris法案之后,美国制药工业经历了大约20年极为艰难的转型过程。PMA代表制药业公开抱怨,指责FDA监管给制药工业带来的困难。PMA在多次演讲和文章中使用的词汇生动地描述了当时制药工业的困惑与艰难:“药物研究是个无法完成的生意(The Unfinished Business of Drug Research)”, 是“ 科 学 的 两难( the Dilemma of Science)”, 制药行业是“艰辛的路程(Painstaking Road)”, 是“十分危险的生意(this is very risky business)”等等。
但是到了1994年,PMA不仅不再抱怨“科学的困惑”和“艰辛的路程”,反而为了强调美国制药工业对科学研究的投入和迷恋,主动把“美国制药协会”的名字改成“美国制药研究和制造商协会(Pharmaceutical Research and Manufactures of America) ”, 简 称 PhRMA。PhRMA的含义也真实地反映了美国制药实际上已经成为以科学研究为主导的一门生意,一个行业,而不是简单的产品制造。美国制药协会的更名和态度转变具体地反映了FDA通过“严厉的监管成就强大的产业”这一历史过程。
综上所述,无论1906年成立FDA的初衷是什么,但是110年来,尤其是1962年之后,FDA的监管领先促进了美国制药工业的技术领先,这或许是不争的事实。

比较有意思的是,特朗普就任美国总统以前公开指责,由于FDA苛刻的法规和官僚的审查体系,造成药物的高价格。其信誓旦旦的要对FDA大开杀戒,提出把FDA的法规砍掉一大半,要给予制药企业更多地自由经营的权利。特朗普就任总统后,很快就召集了15家制药企业的负责人到白宫会谈。令人意外的是,大多数制药企业并不赞成FDA降低监管标准,也不支持总统修改药物监管法律。他们认为,降低审核标准,意味着降低药品的声誉度,意味着药品质量的降低和药品价格的降低。FDA俨然已经成为美国制药的第一品牌,已经成为美国制药称霸世界的核心竞争力。
FDA,一个被监管者都不愿意伤害的监管部门!
20世纪90年代,由于加拿大实施药物价格管制,原创药价比美国便宜,很多美国人到加拿大和墨西哥购买药品。这场风波叫作“drug re-import”。为此国会专门听证,想解决这一问题。在听证会上,一向以保守著称,喜欢批评FDA的共和党议员在辩论时,要求制止“药物再进口”的理由竟然是“加拿大的药物没有经过FDA批准”。而民主党议员则要求在“烟草制品管制法”中引入FDA新药审批的工作方式和工作程序。
FDA的形象和权力已经到了无人撼动的地步!
结语
为了说明FDA对美国制药的监管作用,本文给予了FDA太多的赞扬,其实,110年来FDA也曾经背负过很多骂名,也曾经批准过很多对民众造成了伤害的药物,也曾大批召回FDA自己批准的药物。在艾滋病爆发时,由于FDA对进口药物的管制,使得很多艾滋病人无药可用,处境悲惨,为此遭到了媒体、团体尤其是艾滋病人的强烈攻击(好莱坞拍成了电影《达拉斯买家俱乐部(Dallas Buyers Club)》)。由于FDA迟迟不批准新型降胆固醇药入市,美国报纸攻击说FDA手上有血,每天杀死几百,上千美国人。1989年的FDA仿制药腐败案,几乎毁掉了美国仿制药。
有人说FDA是现代制药的奠基人和领导者,也是有人说FDA是制药商的同谋和助手;有人说FDA是美国健康的卫士,也有人说FDA是药物价格的推手;奥巴马总统在卸任前给予FDA极高的褒奖,特朗普总统则在就任前把FDA说的一无是处……1,000个人眼中有1,000个FDA。

