关键环境因子对螺旋藻营养元素生物积累及有机化程度的影响
吕冰心,徐青艳,常 蓉,颜志秀,李博生
(北京林业大学生物科学与技术学院食品科学与工程系,林业食品加工与安全北京市重点实验室,北京林业大学螺旋藻研究所,北京 100083)
螺旋藻(Spirulinaplatensis)是一种丝状蓝藻,其营养物质丰富,作为食物具有悠久的历史[1]。螺旋藻中蛋白质约占60%~70%,且含有丰富的碳水化合物、β-胡萝卜素及矿物质等营养物质,因而被世界卫生组织(WHO)誉为“人类21世纪的最佳保健品”[2]。工业化生产的螺旋藻,已广泛应用于食品保健、医药、化妆品和水产饲料等行业中[3-5]。
近年来,矿物质元素缺乏成为大家普遍关注的问题。根据第三次全国营养调查数据显示,我国人民的钙摄入水平只达到适宜摄入量(Adequate intakes,AI)的20%~50%,硒摄入量仅达到世界卫生组织推荐最低标准的72%,而缺铁性贫血率仍平均为20%左右,而在中国少年儿童中,缺锌率高达60%[6]。已有大量的研究表明螺旋藻能够通过大分子的吸附作用、与蛋白质和脂类等大分子结合作用以及螯合等不同的方式对不同的金属离子进行有效的富集而极易被人体消化吸收,转化利用率较高[7-10]。因此,利用螺旋藻的优势开发矿质元素高富集产品及相应的食品添加将对改善我国人民矿物质元素缺乏及螺旋藻产业化开发有重要意义及深远影响。在实际生产过程中,环境因子(温度、光照、pH)对螺旋藻生长量及其对矿物质富集作用具有重要的影响[11-13]。因此,本项研究突破了只通过增加螺旋藻外源培养液离子浓度达到细胞积累矿物质营养元素的方法,探讨通过调控主要环境因子(光照、温度、pH)的交互作用对其生长和元素积累的影响,同时配合外源离子浓度双重调控作用。在获得螺旋藻较高生物量的同时,达到螺旋藻最大化富集矿物质营养的目的,从而获得不同矿物质营养元素的高富集螺旋藻。
1 材料与方法
1.1 材料与仪器
钝顶螺旋藻 北京林业大学螺旋藻研究所。培养液为Zarrouk(简称为Z氏)培养液,成分如表1,表2;硫酸铵、十二水合磷酸氢二钠、二水合磷酸二氢钠、碳酸钙、亚硒酸钠、七水合硫酸亚铁、硫酸锌、冰醋酸等均为分析纯 西陇化工股份有限公司。

表1 Zarrouk培养液组成成分Table 1 Compositions of Zarrouk medium

表2 Zarrouk微量元素溶液组成成分Table 2 Compositions of the microelement of Zarrouk medium
721型紫外-可见分光光度计 上海菁华科技仪器有限公司;FD-I冷冻干燥机 北京德天佑科技发展有限公司;人工气候室 德国;ICPS-7000等离子体原子发射分光光度计 北京华科易通分析仪器有限公司;900Z原子吸收光谱仪、Optima700电感耦合等离子光谱发生仪 美国PE 公司;GTR10-1冷冻离心机 北京时代北利离心机有限公司;XO-1000D超声波细胞破碎仪 南京先欧仪器制造有限公司;WSJB-04电磁搅拌器 河南中良科学仪器有限公司;DK-SD电热恒温水浴锅 江苏金怡仪器科技有限公司;KDN-12C控温消煮炉 上海企戈实业有限公司;MD1470透析袋(8000~14000 Da) 上海源叶生物科技有限公司。
1.2 实验方法
1.2.1 螺旋藻接种及培养方法 选择对数生长期的螺旋藻,在Z氏培养液中培养,光暗比为12∶12。用纱布过滤除去死藻及结块的藻,取滤液,用300目生物网再次过滤,藻细胞用Z氏培养液冲洗三次后收集滤干。接种于500 mL锥形瓶中,接种量为OD560=0.3,每瓶加入300 mL Z氏培养液,置于恒温摇床培养(温度30 ℃,转速120 r/min)。在一定温度、光照、pH条件下培养7 d后收获,用300目生物网过滤,过滤得到的藻细胞用蒸馏水清洗至pH=7后置于冷冻干燥机(温度-76 ℃,时间24 h)中冻干,得螺旋藻干粉。
1.2.2 螺旋藻生长速率测定 将螺旋藻培养液充分摇匀,用紫外可见分光光度计,在波长为560 nm处测定藻液吸光度值,每天进行测定,平行三次,连续测7 d。螺旋藻生长速率公式如下:
式(1)
式中,K为生长速率,N表示培养t天的OD560值,N0表示初始OD560,t为培养天数,d[14]。
1.2.3 正交试验设计 钝顶螺旋藻的最适生长范围为温度20~40 ℃、光照4~12 kLux、pH在8.5~10.5[7,17]。本实验对温度、光照和pH三个环境因素进行单因素实验后进行三因素三水平正交试验,探究外界环境对螺旋藻生长及几种营养元素积累的交叉作用。正交试验设计表如下:

表3 正交实验因素水平表L9(34)Table 3 Orthogonal experimental factors and levels L9(34)
1.2.4 螺旋藻矿物质营养元素积累随时间变化规律 以Z氏培养基为基础,在最佳生长量条件:光照12 kLux,温度30 ℃,pH9.5培养3 d达到对数生长期后,第4 d调整环境条件,同时在培养液中加入CaCO30.6 g/L、FeSO4·7H2O 40 mg/L、ZnSO4·7H2O 40 mg/L、Na2SeO3100 mg/L[7,17-19],以Z氏培养液为对照,每组设置三个平行,连续培养,每天对生长量进行测定,其中钙富集培养条件为:温度20 ℃,光照12 kLux,pH8.5;铁富集培养条件为:温度30 ℃,光照4 kLux,pH10.5;锌富集培养条件为:温度30 ℃,光照8 kLux,pH8.5;硒富集培养条件同对照。分别在第3、5、7、9 d(钙)结束时取样,收集各条件下富营养元素的藻细胞,冻干(温度-76 ℃,时间24 h),测定其中微量元素含量。
1.2.5 富矿物质元素螺旋藻样品收集
1.2.5.1 富钙螺旋藻样品收集 富钙螺旋藻培养一定天数后,用300生物网过滤得到藻细胞,用0.1 mol/L醋酸冲洗数次,再用蒸馏水冲洗至pH为7[20]。收获,冻干(温度-76 ℃,时间24 h),测定螺旋藻细胞内钙元素含量。
1.2.5.2 富铁、富锌、富硒螺旋藻样品收集 富铁、锌、硒螺旋藻培养一定天数后,用300目生物网过滤得到藻细胞,用蒸馏水清洗至pH为7,收获,冻干(温度-76 ℃,时间24 h),测定螺旋藻细胞内铁、锌、硒元素含量。
1.2.6 螺旋藻矿物质含量测定 称取0.2 g培养后收集的藻粉,加入混酸HNO3∶HClO4(5∶1)30 mL,锥形瓶顶部盖漏斗,轻轻缓慢摇匀之后在控温消煮炉上进行消化,随着消解作用加强,锥形瓶内产生黄烟,待黄烟散尽瓶内出现白色烟雾装气体,消化结束。冷却后过滤,用去离子水定容至100 mL,待测。其中钙元素含量测定需要从定容后的100 mL样液中取2 mL,加入1 mL硝酸镧,定容至50 mL,待测。钙元素、铁元素、锌元素采用原子吸收光谱仪测定[21];硒元素采用电感耦合等离子光谱发生仪测定[22]。
1.2.7 有机化程度测定
1.2.7.1 螺旋藻藻粉总矿物元素含量测定 螺旋藻藻粉总矿物元素含量测定方法同1.2.6。
1.2.7.2 螺旋藻藻粉无机化矿物元素测定 称取0.2 g培养后收集的藻粉,用离子水混合均匀后在超声破碎仪上破碎30×5 s(间歇5 s),取上清液在4 ℃冷冻离心,离心条件为:8000 r/min、15 min,收集上清液过滤,定容至10 mL,用原子吸收光谱仪检测铁、锌元素含量,硒元素含量用电感耦合等离子光谱发生仪检测。钙元素含量测定需要从定容后的100 mL样液取2 mL,加入1 mL硝酸镧,定容至50 mL,用原子吸收光谱仪进行测定。
1.2.7.3 螺旋藻藻粉有机化程度 藻粉内各元素与螺旋藻细胞内物质的有机化结合量用总量与无机含量之差表示:

式(2)
式中:M1为藻粉总矿物质元素含量;M2为藻粉无机化总矿物质元素含量。
1.2.8 螺旋藻蛋白质提取及矿物质含量测定 称取一定量富矿物质螺旋藻粉,加入蒸馏水混合(过0.45 μm水系微滤膜)以1∶20比例配制成悬浮液,置于4 ℃条件下浸泡过夜。将浸泡后的悬浮液置于-18 ℃的冰箱中反复冻融三次,然后在400 W功率下进行超声破碎15×3 s(停3 s)后,置于4 ℃冷冻离心,离心条件为:8000 r/min、15 min。用50%的饱和硫酸铵对离心后的上清液进行盐析,盐析后冷冻离心,离心条件为:4 ℃、6000 r/min、20 min,收集沉淀;用浓度为0.005 mol/L,pH6.86的PBS溶液溶解沉淀后装于8000~14000 Da透析袋中冷藏透析,透析终点用氯化钡进行检测[23]。脱盐后用冷冻干燥机进行冷冻干燥(温度-76 ℃,时间24 h),得富矿物质螺旋藻粗蛋白,分别用原子吸收光谱仪和电感耦合等离子光谱发生仪对钙、铁、锌、硒元素含量进行检测。
1.2.9 螺旋藻蛋白质含量测定 凯氏定氮法(GB5009.5-2010)。
1.2.10 红外光谱分析 采用溴化钾压片法将富矿物质螺旋藻样品进行处理,经过红外扫描得到红外吸收光谱图[24]。
1.3 数据处理
本实验数据采用IBM SPSS Statistics 24.0软件及Excel 2010进行处理。
2 结果与分析
2.1 温度、光照、pH对螺旋藻生长及营养元素积累的影响
2.1.1 吸光度值与生物量之间的关系曲线 表示螺旋藻生长量的方法通常有两种,一种为连续测定螺旋藻的OD560值,另一种是测定螺旋藻细胞的干重,通过实验探究两者之间的关系,观察其在螺旋藻生物量表达上是否呈现一致性[25],其结果如图1所示。

图1 钝顶螺旋藻生物量干重与OD560相关性Fig.1 Relationship between Spirulina platensis dry cell weight and OD560
由图1知,在一定范围内,钝顶螺旋藻细胞干重与其OD560值之间具有较好的线性关系。回归方程y=0.5126x-0.0413,其中x为560 nm处OD值,Y为冻干后的螺旋藻细胞干重,相关系数R2=0.9954。因此可用OD560表示螺旋藻生物量变化规律,并可根据回归方程公式进行互换。
2.1.2 温度、光照、pH对螺旋藻生长速率及钙、铁、锌元素积累的影响 由表4中k值分析可知,钝顶螺旋藻最佳生长速率条件为:A2B3C2,即温度30 ℃,光照12 kLux,pH9.5。由极差分析可以看出:RB>RA>RC,三个主要环境因素对钝顶螺旋藻生长速率的影响依次是:光照>温度>pH,即光照对螺旋藻生长量影响最大。

表4 生长速率及钙、铁、锌积累正交实验结果与极差分析Table 4 Orthogonal experiment and range analysis of growth rate,calcium,iron and zinc accumulation
由表4中极差分析可见,有利于钙积累的最佳环境条件为A1B3C1,即温度20 ℃,光照12 kLux,pH8.5。影响钙元素积累的环境因素主次顺序为:RA>RB>RC,即温度>光照>pH,温度对钝顶螺旋藻钙积累影响最大。有利于铁积总累的最佳环境条件为A2B1C3,即温度30 ℃,光照4 kLux,pH10.5。由极差分析可知,三个环境因素对螺旋藻铁富集的影响主次顺序为:RB>RC>RA,即光照>pH>温度,光照对铁积累影响最大。有利于锌积总累的最佳环境条件为A2B2C1,即温度30 ℃,光照8 kLux,pH8.5。由极差分析可知,三个环境因素对螺旋藻铁富集的影响主次顺序为:RC>RA>RB,即pH>温度>光照,pH对锌积累影响最大。
2.2 外源矿物质添加对螺旋藻生长及其积累的影响
2.2.1 钙对螺旋藻生长及其积累的影响
2.2.1.1 不同钙富集时间对钝顶螺旋藻生长的影响 不同钙富集时间对钝顶螺旋藻生长的影响如图2所示。
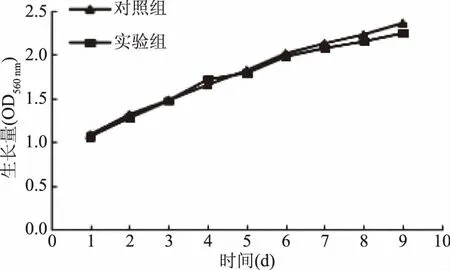
图2 钙富集时间对螺旋藻生长的影响Fig.2 Effect of different calcium accumulation time on the growth of Spirulina
由图2可见,对照组与实验组螺旋藻生长量随时间延长均呈线性增加关系。在生长前期和中期实验组与对照组生长量差异(p<0.05)不明显,生长末期从第7 d开始实验组相对生长量略低于对照组,至培养周期结束第9 d收获时,实验组生长量相比于对照组降低了2.5%。
2.2.1.2 螺旋藻富集钙元素含量随培养时间变化规律 通过上述实验获得富钙螺旋藻,分别于初始、第3、5、7、9 d进行钙元素含量及有机化测定,其结果如图3所示。

图3 螺旋藻培养过程中钙元素含量及有机化程度变化Fig.3 Calcium accumulation and organic level during Spirulina’s culturing
由图3可见,在整个培养周期内,钝顶螺旋藻钙元素富集总量呈上升趋势,第5 d比第3 d钙含量增加了1.24倍,第7 d比第5 d钙含量增加了2.23倍,在培养的第9 d达到最大值18.62 mg/g。螺旋藻钙元素有机化程度呈先上升后平稳的趋势,在第7 d时,达到最大有机化程度84.17%。由于螺旋藻钙元素富集最佳培养周期为7 d,在最有利于钙富集条件下,螺旋藻生长所受影响较小。因此,第7 d作为螺旋藻钙元素富集最佳采收时间,此时细胞内钙有机化程度达为84.17%,钙含量为18.21 mg/g。
2.2.2 铁对螺旋藻生长及其积累的影响
2.2.2.1 不同铁富集时间对钝顶螺旋藻生长的影响 不同铁富集时间对钝顶螺旋藻生长的影响见图4。

图4 铁富集时间对螺旋藻生长的影响Fig.4 Effect of different iron accumulation time on the growth of Spirulina
由图4可见,在整个培养周期内,实验组螺旋藻生长速率低于对照组,铁富集条件对螺旋藻生长产生一定影响。在整个实验过程中,在第3、5、7 d时,实验组相比于对照组光密度下降百分比分别为:11.96%、15.55%、17.92%,随时间延长,实验组生长量比对照组生长量降低幅度呈增加趋势。
2.2.2.2 钝顶螺旋藻富集铁元素含量随时间变化规律 通过上述实验获得富铁螺旋藻,分别于第3、5、7 d,收获螺旋藻细胞,冻干后进行铁元素含量及有机化测定,钝顶螺旋藻铁总含量及有机化程度随培养时间变化规律见图5。
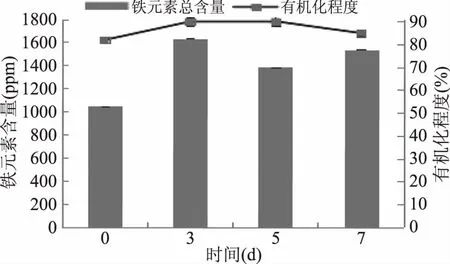
图5 钝顶螺旋藻富集铁元素含量随时间变化规律Fig.5 Iron accumulation and organic level during Spirulina’s culturing
由图5可知,螺旋藻铁的富集总量随时间延长呈先上升后下降,在生长周期末期又回升的现象,螺旋藻铁的有机化程度在这个培养期内均在80%以上。螺旋藻铁积累量第3 d比初始值增加了59%,达到最高值1634 ppm,此时有机化程度为89.98%。而到达第5 d时,螺旋藻铁有机化程度比第3 d增加0.12%,但由于部分二价铁离子被氧化成为三价铁,生成砖红色氢氧化铁不溶性沉淀,使得铁总含量却降低了15.24%。
因此,钝顶螺旋藻铁元素最佳培养周期为3 d,此时螺旋藻生长所受影响较小,铁元素富集量最多,含量为1634 ppm,螺旋藻铁的有机化程度为89.98%,维持较高水平。
2.2.3 锌对螺旋藻生长及其积累的影响
2.2.3.1 不同锌富集时间对钝顶螺旋藻生长的影响 不同锌富集时间对钝顶螺旋藻生长的影响生长曲线见图6。

图6 锌富集时间对螺旋藻生长的影响Fig.6 Effect of different Zinc accumulation time on the growth of Spirulina
由图6可见,在整个培养期内,实验组与对照组螺旋藻均成稳定增长的趋势,对照组光密度值略大于实验组,但两者之间生长速率差异不大,实验组比对照组生长速率平均降低4.2%。最佳锌富集条件下,螺旋藻生长未受到显著(p<0.05)影响。
2.2.3.2 钝顶螺旋藻富集锌元素含量随时间变化规律 上述实验中,分别于第3、5、7 d,收获螺旋藻细胞,冻干后进行锌元素含量及有机化测定,其结果见图7。

图7 钝顶螺旋藻富集锌元素含量随时间变化规律Fig.7 Zinc accumulation and organic level during Spirulina’s culturing
由图7可见,螺旋藻锌含量呈逐渐上升趋势,在培养周期的第3 d,钝顶螺旋藻锌元素有机化程度最高,为58.28%,是初始值的3.4倍,锌元素的富集量为88.30 ppm;到达第7 d时,虽然锌元素的富集量可达132.75 ppm,但有机化程度仅为5.34%。因此,螺旋藻锌富集最佳培养周期为3 d,此时螺旋藻锌的有机化程度达到58.28%,锌富集量为88.30 ppm。
2.2.4 硒对螺旋藻生长及其积累的影响
2.2.4.1 不同硒富集时间对钝顶螺旋藻生长的影响 不同硒富集时间对钝顶螺旋藻生长的影响结果见图8。

图8 硒富集时间对螺旋藻生长的影响Fig.8 Effect of different selenium accumulation time on the growth of Spirulina
由图8可知,随着培养时间的增加,实验组光密度值显著(p<0.05)低于对照组,说明硒对螺旋藻细胞产生一定胁迫作用,并且在培养后期由于藻细胞将亚硒酸根离子转化成易挥发性硒化物而导致培养液散发出一股刺激性气味[26],但选择合适的硒离子浓度添加,可使得这种对于生长量的影响维持在20%以内。
2.2.4.2 钝顶螺旋藻富集硒元素含量随时间变化规律 由图9可见,在100 mg/L Na2SeO3添加浓度下,螺旋藻硒元素含量及有机化程度均呈先上升后下降的趋势,变化趋势相同,两者均在周期培养第5 d达到最大值,螺旋藻总硒含量为1011 ppm,有机化程度为70.54%;相比于培养第3 d,螺旋藻含硒总量增加153%,有机化程度增加20%,增幅明显。
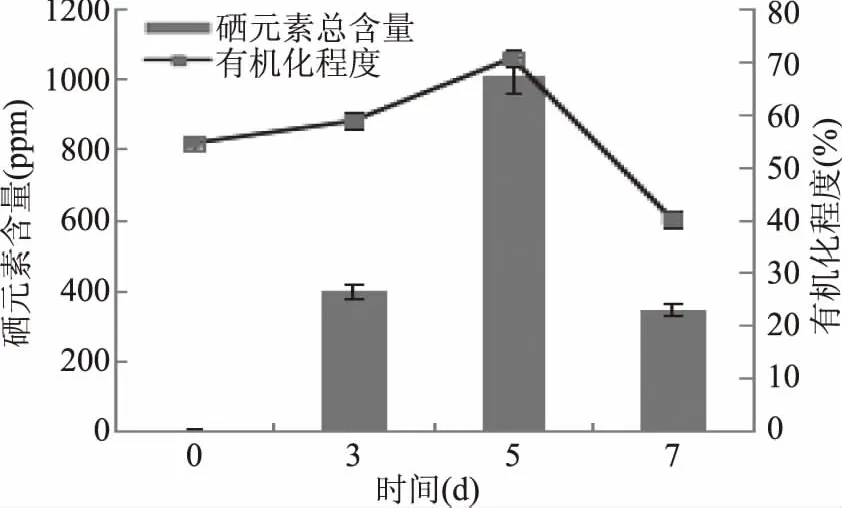
图9 钝顶螺旋藻富集硒元素含量随时间变化规律Fig.9 Selenium accumulation and organic level during Spirulina’s culturing
因此,钝顶螺旋藻对硒元素最佳富集时间为5 d,此时螺旋藻硒总含量最高达到1011 ppm,有机化程度为70.54%,在此条件下,螺旋藻生长量相比于最佳生长量降低12.9%。
2.3 螺旋藻蛋白与几种矿物质元素结合及其有机化程度分析
2.3.1 富钙、富铁、富锌、富硒螺旋藻蛋白分别与钙、铁、锌、硒的有机化结合程度分析 由表5可见,在富钙条件下培养的螺旋藻干粉的总钙含量为18.21 mg/g,从藻粉中提取的总蛋白含量为470 mg/g,由实验结果可知总蛋白中钙含量为1.07 mg/g,经测定,螺旋藻总蛋白含量是67.6%,以提取总蛋白含钙量计算藻粉总蛋白中钙的含量为1.04 mg/g;对比富钙螺旋藻粉蛋白含钙量与螺旋藻含钙总量,富钙螺旋藻粉总蛋白中钙含量占总钙的5.71%,占有机钙含量的6.78%。实验结果表明,钙与蛋白质有机结合程度较低,而钙具体有机化结合方式还有待进一步研究。

表5 富钙螺旋藻蛋白与钙的有机结合情况Table 5 Calcium-rich Spirulina protein’s organic binding of calcium
由表6可见,富铁螺旋藻干粉的总铁含量为1634.34 ppm,有机铁含量为1470.63 ppm,有机化程度为89.98%,有机化程度较高,这表明螺旋藻有效的将无机铁在细胞内转化为有机铁。从藻粉中分离提取的总蛋白含量为474 mg/g,提取总蛋白中铁含量为872.64 ppm,经测定,螺旋藻总蛋白含量是67.5%,以经计算得出螺旋藻干粉中蛋白的含铁量为838.81 ppm;对比富铁螺旋藻粉蛋白含铁量与螺旋藻含铁总量,富铁螺旋藻粉总蛋白中铁含量占总铁含量的51.32%,占有机铁含量的57.00%。

表6 富铁、富锌、富硒螺旋藻蛋白与钙的有机结合情况Table 6 Iron-rich,zinc-rich and selenium-rich Spirulina protein’s organic binding of calcium
富锌螺旋藻干粉的总锌含量为88.30 ppm,有机锌含量为36.84 ppm,螺旋藻锌有机化程度为58.28%,这表明螺旋藻在一定程度上将无机锌转化为有机锌。从藻粉中分离提取的总蛋白含量为466 mg/g,提取总蛋白中锌含量为30.26 ppm,经测得螺旋藻粉总蛋白含量是66.8%,计算得知螺旋藻粉总蛋白中锌含量为28.98 ppm;对比富锌螺旋藻粉蛋白含锌量与螺旋藻含锌总量,富锌螺旋藻粉总蛋白中锌含量占总锌的32.82%。占有机锌含量的78.66%。这表明,有机锌的结合态中,超过三分之二是与蛋白质结合。
富硒螺旋藻干粉的总硒含量为1011.00 ppm,而从藻粉中分离提取的总蛋白含量为455 mg/g。提取总蛋白中硒含量为513.64 ppm,经测定,螺旋藻总蛋白含量是66.3%,以提取总蛋白含硒量推算螺旋藻粉总蛋白中硒含量为496.22 ppm,对比富硒螺旋藻粉蛋白含硒量与螺旋藻含硒总量,富硒螺旋藻粉总蛋白中硒含量占总硒的49.08%。占有机硒含量的69.58%,这说明硒在螺旋藻中主要是与蛋白质结合。
2.3.2 螺旋藻蛋白结合矿物质营养元素有机化程度分析 对Z氏培养液培养的螺旋藻干粉(对照组)及最优富矿物质营养元素条件下培养的螺旋藻干粉(实验组)进行红外图谱扫描,图谱结果见图10。

图10 红外吸收光谱图Fig.10 Infrared absorption spectroscopy注:a为对照组;b为富钙培养螺旋藻;c为富铁培养螺旋藻;d为富锌培养螺旋藻;e为富硒培养螺旋藻。
图10中,与对照相比,添加过四种不同离子的样品在原波长为3352 cm-1处的吸收峰都有不同程度的蓝移现象,并且吸收峰减小,造成这种蓝移的现象是由于在加入以上四种离子后,羟基和胺基的混合峰的吸收峰减小,说明细胞表面氢键减弱,同时也说明藻体结合上述四种离子之后,羟基和胺基可能参与离子吸附与吸收,引起伸缩振动的最大峰位移。在2927 cm-1处甲基和亚甲基伸缩振动的相对强度减弱,这表明脂质对上述离子吸收也产生了不同程度的作用;由于螺旋藻是一种蛋白含量极其丰富的藻类,所以存在两个显著的红外光谱特征峰,分别是由于C=O的伸缩振动产生位于1658 cm-1吸收峰对应于酰胺I,由于 NH2剪式振动吸收产生的位于1545 cm-1处的吸收峰是酰胺II。与对照相比,仅钙离子可造成酰胺I特征的位移,这说明酰胺I中的C=O参与钙离子配位,而四种离子都造成了酰胺II特征峰的改变。很显然,上述的四种离子都与氨基酸中N-H弯曲振动(60%)和多肽链、碳骨架中的 C-N伸缩振动(40%)产生,这说明N-H同时参与离子配位[27]。由于多糖分子中存在多个C-OH基团,因此在1100~1000 cm-1之间出现多个C-O伸缩振动吸收峰,可能含有P-O-C伸缩振动的贡献;同时,在1000~800 cm-1之间发生了糖环的环振动,推测螺旋藻上述四种离子积累与糖类物质密不可分。
另外,由于藻细胞的细胞壁对钙离子进行有效吸附和吸收,因此位于1160 cm-1由于细胞壁上主要成分-碳水化合物中C-O键的伸缩振动产生吸收峰峰面积增加;螺旋藻富集铁离子和硒离子之后1320 cm-1处C-O振动收缩峰消失,1240 cm-1C-O伸缩振动加强,这是蛋白质和脂肪酸吸收铁离子后的结构变化。在添加硒离子后,在624 cm-1处,峰位由624.93 cm-1偏移至577.92 cm-1,吸收峰强度降低,这是由N-H面外变形振动形成氢键,使波峰向低波数移动[28]。
3 结论
本实验通过对主要影响螺旋藻生长的环境因子(温度、光照、pH)进行调控,确定螺旋藻最佳生长量的环境条件为:温度30 ℃,光照12 kLux,pH9.5。钙积累的最佳条件为:温度20 ℃,光照12 kLux,pH8.5,钙积累量提高了97%,外源添加0.6 g/L CaCO3,培养7 d收获,螺旋藻钙总含量和其有机化程度分别达到18.21 mg/g,84.17%。铁元素积累最佳条件为:温度30 ℃,光照4 kLux,pH10.5,铁积累量提高了175%,外源添加FeSO4·7H2O浓度至40 mg/L,培养3 d后收获,螺旋藻中铁总含量及有机化程度分别达到1634.34 ppm,89.98%。锌元素积累最有佳条件为:30 ℃,8 kLux,pH8.5,在此条件下同时外源添加ZnSO4·7H2O浓度至40 mg/L,培养3 d后收获,锌有机化程度最高,螺旋藻最高锌含量和有机化程度分别达到88.30 ppm,58.28%。硒元素积累最有利条件为:30 ℃,12 kLux,pH9.5,在此条件下外源添加100 mg/L Na2SeO3培养5 d后收获,螺旋藻中硒元素总含量及有机化程度达到最大值,螺旋藻中硒元素总含量及有机化程度分别为1011.00 ppm,70.54%。
由此可见,锌、硒和铁与蛋白质结合程度较高,占有机化程度的50%以上,这具有开发富矿质营养蛋白粉和食品添加的潜力。只有钙与蛋白质结合不足10%,定性研究表明其还可能与多糖和脂类结合,其他三种元素也具有此共性。本项研究实现了螺旋藻生长和营养元素积累同时调控,无机元素通过螺旋藻细胞载体实现高度有机化,在医药、食品、化妆品领域具有重要的应用价值。

