牛至油对绵羊瘤胃发酵特性及饲粮营养物质瘤胃降解率的影响
张 然 郑 琛 闫晓刚 梁 浩 班志彬 杨华明*
(1.吉林省农业科学院畜牧科学分院,公主岭136100;2.甘肃农业大学动物科学技术学院,兰州730070)
牛至油(oregano essential oil)是从植物牛至的叶和花中提取的一种挥发性油,主要活性成分为香芹酚(carvacrol,香荆介酚,2-甲基-5-异丙基苯酚)和百里酚(thymol,麝香草酚,5-甲基-2-异丙基苯酚)[1],其活性成分具有广谱高效的抗菌活性,与抗生素相比具有高效、环保、无残留、无毒、不产生耐药性等显著特点,可代替抗生素在饲粮中添加,是我国农业部批准使用的抗菌促生长添加剂(农牧法[2001]20)。牛至油的抗菌、杀菌作用主要是通过牛至油中的酚类化合物与细菌的细胞膜作用而改变细胞膜结构,增加了细胞膜的流动性和通透性或与细胞膜中的磷脂反应,破坏蛋白质的合成,使微生物细胞的生长受到抑制[2]。牛至油中的酚酸类和萜类物质可发挥抗氧化作用[3]。有研究表明,饲粮中添加牛至油可提高动物血清中超氧化物歧化酶、谷胱甘肽过氧化物酶活性和显著降低血清丙二醛浓度。同时,牛至油可提高动物免疫力,促进免疫器官生长发育[4]。
植物精油可选择性地抑制产甲烷菌、原虫和超级产氨菌等特定的微生物,这也是植物精油调控瘤胃发酵的主要机理[5-6]。一般认为,牛至油调控瘤胃发酵的正效应是降低乙酸和氨氮浓度及甲烷产量,升高丙酸和丁酸浓度,从而降低乙酸/丙酸,维持反刍动物葡萄糖代谢平衡。已有体外试验表明,牛至油在体外培养条件下能发挥类似于离子载体的作用,使得培养液的甲烷产量、乙酸、丙酸、丁酸和氨氮浓度及乙酸/丙酸发生改变,但这些结论都是在体外模拟反刍动物瘤胃环境的试验中得出的。虽然体外法能够直观地反映牛至油对瘤胃发酵的调控效果,但真实的反刍动物瘤胃内环境更复杂,影响因素多,变化快,体内环境和体外环境存在着较大差异。本试验通过在瘘管绵羊的基础饲粮中添加牛至油,研究牛至油不同添加水平对瘤胃发酵特性及饲粮营养物质瘤胃降解率的影响,旨在获取牛至油的最适添加水平和验证体外试验结果,为牛至油在绵羊养殖中的应用提供参考。
1 材料与方法
1.1 试验材料
牛至油购自涵乐生物科技有限公司(江苏,兴化),纯度为10%,其余部分为载体,成分为二氧化硅。
1.2 试验设计及分组
选用4只装有永久瘤胃瘘管的新疆细毛羊×杜泊羊杂交的4周岁公绵羊,平均体重(40.83±4.11) kg,采用4×4拉丁方试验设计,对照组饲喂基础饲粮,试验组分别饲喂在基础饲粮中添加0.015%、0.030%和0.045%牛至油的试验饲粮。试验共分4期,每期12 d,其中预试期10 d,正试期2 d,于预试期内添加相应水平的牛至油。试验绵羊分组见表1。

表1 试验绵羊分组
1.3 基础饲粮及饲养管理
参照肉羊饲养标准(NY/T 816—2004)推荐的育成公羊营养需要量(体重40 kg,日增重100 g)配制饲粮,饲粮精粗比为30∶70,其组成及营养水平见表2。每日于07:00和17:00等量饲喂2次,先粗后精,自由饮水。
1.4 待测饲粮的处理
饲粮粉碎过40目筛备用。尼龙袋大小为12 cm×8 cm,孔径为0.045 mm。称取5 g饲粮样品放入尼龙袋内,每6袋放入1个大的网袋中,根据“同时放入,依次取出”的原则,于正试期第1天晨饲前放入瘤胃内,处理6、12和24 h后取出,每次取出2个尼龙袋,即每个时间点有2个重复。取出的尼龙袋立即在自来水下冲洗,然后放入水中浸泡45 min,再在中等流速的自来水下漂洗后将尼龙袋65 ℃烘干,以测定饲粮干物质(DM)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和粗蛋白质(CP)含量。
1.5 瘤胃液的采集
于正试期的第2天,在试验羊0(晨饲前,07:00)、2(09:00)、4(11:00)、6(13:00)和10 h(晚饲前,17:00)从瘤胃内不同位点采集瘤胃液,立即测定pH,然后于-20 ℃冷冻保存,以测定总氮(TN)、氨氮(NH3-N)、尿素氮(UN)和挥发性脂肪酸(VFA)浓度。
1.6 测定指标及测定方法
瘤胃液pH:用酸度计(pHS-3C,上海雷磁仪器厂)测定。瘤胃液挥发性脂肪酸浓度:用气相色谱仪(6890N,Agilent,美国)测定;色谱柱为HP19091N-213毛细管柱(Agilent,美国);色谱条件为进样口温度220 ℃,氮气流量2.0 mL/min,分流比为40∶1,进样量0.6 μL,程序升温模式(120 ℃,3 min,然后10 ℃/min至180℃,保持1 min),火焰离子检测器(FID)250 ℃,FID空气、氢气和氮气流量分别为450、40和45 mL/min。瘤胃液总氮和饲粮及残渣中粗蛋白质、粗脂肪、粗灰分、钙、磷和水分含量:粗蛋白质含量用凯氏定氮法测定;粗脂肪含量依据国标(GB/T 6433—2006)方法测定;钙和磷含量依据国标(GB/T 6437—2002)方法测定;其余指标测定方法参见《饲料分析与饲料质量检测技术》[7]。瘤胃液氨氮浓度:用冯宗慈等[8]改进的比色法测定。瘤胃液尿素氮浓度:用二乙酰一肟法测定,试剂盒购自南京建成生物工程研究所。饲粮及残渣中中性洗涤纤维和酸性洗涤纤维含量:按照Van Soest等[9]的方法测定。按下式公式计算各营养物质瘤胃降解率:
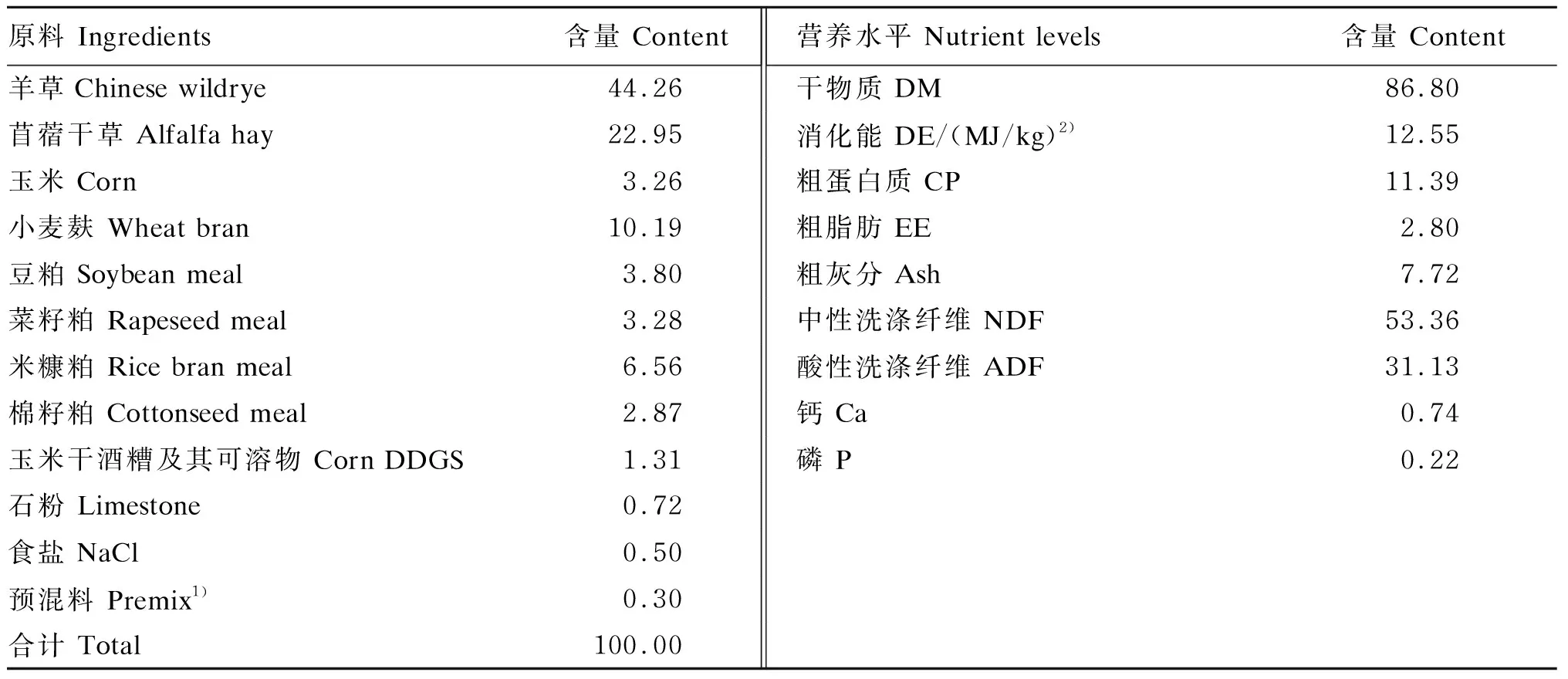
表2 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet:Fe 38 mg,Zn 44 mg,Cu 15 mg,I 0.5 mg,Mn 50 mg,Se 0.3 mg,Co 0.05 mg,VA 354 IU,VD 94.4 IU,VE 1.06 mg。
2)消化能为实测值。DE was a measured value.
营养物质瘤胃降解率(%)=[(尼龙袋内的营养物质含量-降解数小时后尼龙袋内营养物质含量)/尼龙袋内的营养物质含量]×100。
1.7 数据统计分析
采用SPSS 19.0软件的拉丁方方差分析处理数据,差异显著时,采用Tukey法(方差齐)或Tamhane法(方差不齐)进行多重比较,以P<0.05作为差异显著的判断标准。
2 结果与分析
2.1 牛至油对绵羊饲粮营养物质瘤胃降解率的影响
由表3可知,添加牛至油对饲粮各营养物质的瘤胃降解率均未产生显著影响(P>0.05),同一添加水平的牛至油在不同时间点的营养物质瘤胃降解率随饲粮在体内降解时间越长,各养分降解率越高。
2.2 牛至油对绵羊瘤胃液pH和挥发性脂肪酸浓度和比例的影响
由表4可知,添加牛至油对绵羊瘤胃液pH无显著差异(P>0.05)。0.030%组和0.045%组绵羊瘤胃液4 h的总挥发性脂肪酸浓度显著低于对照组(P<0.05);0.015%组绵羊瘤胃液0、2、6 h乙酸比例显著低于其余各组(P<0.05),6 h的乙酸/丙酸显著低于其余各组(P<0.05),而2 h丙酸比例显著高于除了对照组外的其余各组(P<0.05)。
2.3 牛至油对绵羊瘤胃液氮浓度的影响
由表5可知,饲粮中添加牛至油对绵羊瘤胃液的总氮、氨氮和尿素氮浓度均未产生显著影响(P>0.05)。

表3 牛至油对绵羊饲粮营养物质瘤胃降解率的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),无字母或相同字母表示差异不显著(P>0.05)。下表同。
Values in the same row with different small letter superscripts mean significant difference (P<0.05), while with no or the same letter superscripts mean no significant difference (P>0.05). The same as below.

表4 牛至油对绵羊瘤胃液pH和挥发性脂肪酸浓度和比例的影响

续表4项目Items时间Time/h牛至油添加水平Oregano essential oil supplement level/%00.0150.0300.045SEMP值P-value丙酸Propionate/%013.6615.0713.4613.630.300.206216.97ab17.61a16.30b16.48b0.180.040415.8116.6315.5315.500.220.226615.2016.4614.9415.160.220.0531014.2815.2314.2714.400.230.406丁酸Butyrate/%07.117.747.447.260.100.11128.559.238.528.370.130.08148.358.808.618.240.130.40968.278.658.358.210.120.572108.058.127.947.520.120.280其他酸Others/%02.172.302.072.150.050.50122.963.152.963.100.040.26942.402.452.402.020.080.14762.002.192.011.800.070.284101.882.071.571.630.090.147
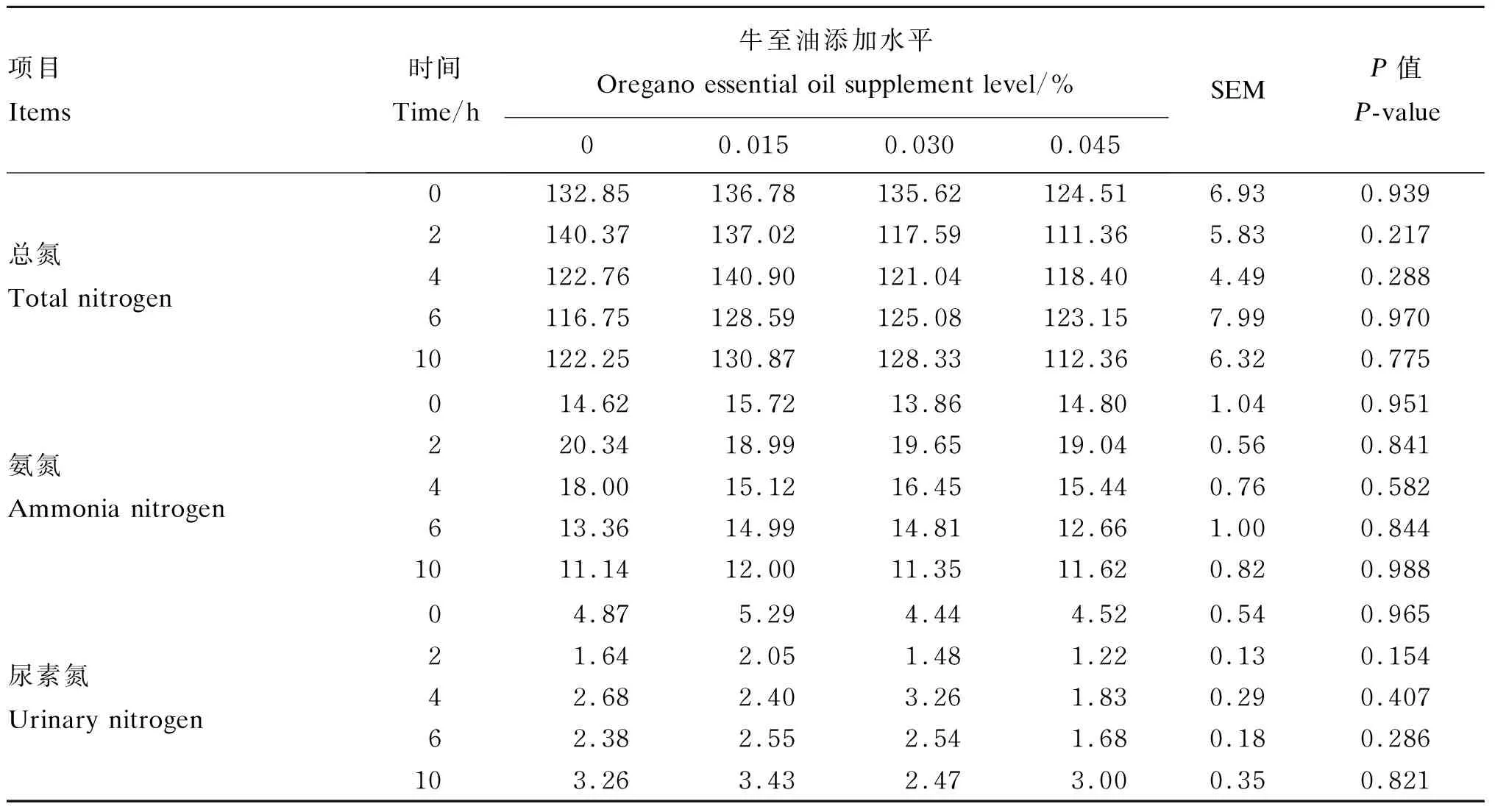
表5 牛至油对绵羊瘤胃液氮浓度的影响
3 讨 论
3.1 牛至油对绵羊饲粮营养物质瘤胃降解率的影响
利用尼龙袋法能较准确地评价饲粮营养物质在瘤胃内的降解效果且操作简单,而干物质、粗蛋白质、中性洗涤纤维和酸性洗涤纤维是评价饲粮营养物质瘤胃降解率的重要指标[10]。本次试验中,牛至油对干物质、粗蛋白质、中性洗涤纤维和酸性洗涤纤维的瘤胃降解率均没有产生显著影响。这是由于营养物质的消化率主要是由营养物质的理化性质决定,益生元不能改变饲粮营养物质的消化率,只能改变细菌的数量从而影响纤维的降解率[11]。也可能因为添加牛至油后并未降低真菌的数量,也不会对纤维的降解产生影响[12]。Benchaar等[13]用安装瘤胃瘘管的荷斯坦奶牛进行拉丁方试验,分别给以青贮苜蓿和青贮玉米为基础饲粮的奶牛饲喂750 mg/d混和植物精油,干物质、粗蛋白质、中性洗涤纤维和酸性洗涤纤维的瘤胃降解率都没有产生显著影响,与本试验研究结果一致。但有研究认为,精油的作用效果与饲粮类型有关,植物精油进入瘤胃后,可能通过改变瘤胃微生物对饲粮的附着和定植,从而影响饲粮可溶组分的裂解;当采用瘤胃可溶物质作为基础饲粮时,植物精油对饲粮蛋白质或肽的水解没有影响,只是抑制了氨基酸的脱氨基作用[14]。Molero等[14]将700 mg/(d·头)混和精油添加到育成牛的饲粮中,结果表明,混和精油只降低了高精料饲养条件下的粗蛋白质降解率。Newbold等[15]研究发现,在绵羊精粗比为40∶60的基础饲粮中添加混和精油,降低了豆粕的粗蛋白质降解率。Mcewan等[16]给绵羊饲喂混和精油,影响了瘤胃微生物对富含淀粉的谷物饲粮和富含蛋白质的粕类饲粮的附着和定植的能力,Duval等[17]试验也得出了相同的结论。而大多数体外试验的结果却表明,植物精油会影响饲粮营养物质体外降解率。Righi等[18]体外试验结果显示,添加0.5 mg/L牛至油能显著降低豆粕4和24 h的干物质降解率及玉米粉和全混合日粮24 h的干物质降解率。Kilic等[19]试验也得出在含有大麦、大豆和麦秸的混和饲粮中添加牛至油产气量显著降低。白乌日汗[20]通过体外批次培养法测定添加水平为0、45、450和4 500 mg/L的牛至油对瘤胃发酵特性的影响,发酵0、2、6和24 h后,综合各时间点平均值得出,45 mg/L组和450 mg/L组干物质降解率显著高于对照组,但4 500 mg/L组与对照组相比没有显著差异。
3.2 牛至油对绵羊瘤胃液pH和挥发性脂肪酸浓度和比例的影响
pH是评价瘤胃代谢的重要指标,主要受饲粮性质、唾液分泌量和有机酸积累的影响,决定着瘤胃微生物对底物的发酵利用情况[21]。挥发性脂肪酸主要来源于饲粮中碳水化合物的发酵,是供应反刍动物能量代谢的主要形式,可为反刍动物提供所需能量的60%~80%,乙酸、丙酸及丁酸是饲粮在瘤胃中发酵后的主要产物。本次试验中,牛至油对绵羊瘤胃液pH没有显著影响,各组绵羊瘤胃液的pH在5.61~6.42,处于有利于微生物发酵的变化范围内(5.5~7.5)[22]。各组绵羊pH的变化也符合饲喂前最高,采食后1~5 h降至最低点,而后缓慢回升的规律。总挥发性脂肪酸浓度的变化随时间表现出先升高后降低的规律,是因为动物进食后刺激了瘤胃微生物的生长和繁殖,发酵过程产生大量的挥发性脂肪酸,但因有机酸不断被瘤胃壁吸收或流入消化道后段或被唾液中的缓冲物质中和,使得瘤胃内pH又缓慢上升,总挥发性脂肪酸浓度逐渐降低,说明瘤胃内有机酸的积累是影响瘤胃内pH的主要因素。本次试验中,添加牛至油0.030%和0.045%时绵羊瘤胃液4 h的总挥发性脂肪酸浓度显著低于对照组;0.015%组绵羊瘤胃液0、2、6 h乙酸比例显著低于其余各组,6 h的乙酸/丙酸显著低于其余各组,而2 h丙酸比例显著高于除了对照组外的其余各组。有关牛至油对反刍动物瘤胃发酵影响的测定,以体外试验居多且结果不一,如有研究认为饲粮中添加牛至油会降低瘤胃内总挥发性脂肪酸浓度[23-24]或对其无影响[25-26],但也有研究认为,添加牛至油可增加瘤胃内总挥发性脂肪酸浓度[27-28]。而一些体内试验结果表明,饲喂牛至油或精油混合物对瘤胃发酵指标无显著影响。如Beauchemin等[25]报道,肉牛饲喂混合植物精油1 g/d时,对瘤胃总挥发性脂肪酸浓度及单个挥发性脂肪酸浓度无影响;Benchaar等[13]试验也表明,泌乳奶牛饲粮添加混合植物精油750 mg/d时,对瘤胃总挥发性脂肪酸浓度、单个挥发性脂肪酸浓度和乙酸/丙酸都无显著影响;石宁[29]选用4头瘤胃瘘管奶牛,采用4×4拉丁方设计,研究牛至油对泌乳奶牛瘤胃发酵的影响,对照组饲喂基础饲粮,试验组牛至油添加水平为250、500和750 g/d,试验结果表明,牛至油对奶牛瘤胃pH、总挥发性脂肪酸浓度和除丁酸比例以外的其他单个挥发性脂肪酸浓度均无显著影响。Giannenas等[30]在母羊饲粮中添加不同水平含有麝香草酚的植物精油混合物(0、50、100和150 mg/kg),结果表明植物精油对绵羊瘤胃液pH、总挥发性脂肪酸浓度及单个挥发性脂肪酸浓度均没有显著影响,但添加组较对照组显著降低了乙酸/丙酸。Günal等[31]体外试验表明,百里香油添加水平为125、250和500 mg/L时,体外发酵液pH、乙酸、丙酸、丁酸比例和乙酸/丙酸无显著差异。此外,饲粮中添加牛至油对绵羊瘤胃发酵的影响较小,不如体外培养时的效果显著,主要是由于牛至油的特殊气味限制了其在动物饲粮中的添加水平,使得牛至油有效添加水平较低,再加上活体环境远比体外培养复杂,导致动物试验与体外培养结果出现较大差异。
3.3 牛至油对绵羊瘤胃液氮浓度的影响
本试验中牛至油对绵羊瘤胃液总氮、氨氮和尿素氮浓度均没有产生显著影响,氨氮浓度在11.14~20.34 mg/dL,符合瘤胃微生物最佳生长所需的氨氮浓度(8.5~30.0 mg/L)[32]。瘤胃液氨氮浓度与饲粮蛋白质或含氮物降解速度、瘤胃内微生物合成氨的能力、能量及碳架供给有关。有学者认为植物精油能够抑制瘤胃产氨菌的生长,降低脱氨酶活性,使得氨基酸脱氨基作用降低[33-34]。Giannenas等[30]试验表明植物精油对总活菌、纤维分解菌和原虫数量无影响,但100和150 mg/kg植物精油组显著降低了瘤胃超级产氨菌数量,150 mg/kg植物精油降低瘤胃氨氮浓度。Wang等[35]给绵羊基础饲粮中添加250 mg/d牛至油预混剂,连续饲喂15 d后与对照组相比,绵羊瘤胃液氨氮浓度显著降低。石宁[29]体内试验表明,随牛至油添加水平的增加,奶牛瘤胃液氨氮浓度显著降低,各组间尿素氮浓度差异不显著。Castillejos等[24]用体外批次培养研究植物精油活性成分对瘤胃发酵特性的影响,发酵24 h后,500和5 000 mg/L麝香草酚显著降低了氨氮浓度;而在连续培养系统中恒定条件下培养6 d后,与对照组相比,各麝香草酚添加组(5、50和500 mg/L)氨氮浓度均无显著差异;他认为这是由于瘤胃微生物将植物精油的活性成分钝化为惰性物质,批次培养的试验时间不足以完全说明植物精油的作用效果,可能是试验后期瘤胃微生物对麝香草酚有了一定的抗性和适应性,导致瘤胃微生物菌群的改变,也可能是植物精油在试验后期被瘤胃微生物降解利用。本次试验中,绵羊在每期试验中连续饲喂牛至油12 d,可能会导致牛至油活性成分被钝化或试验后期微生物菌群改变。综上所述,牛至油对瘤胃氮代谢的影响效果会由于活性成分不同而不同,此外,试验装置、饲粮类型、添加水平和主要成分都会影响作用效果。
4 结 论
在本试验条件下,综合各项指标得出,0.015%~0.045%牛至油对饲粮营养物质的瘤胃降解率无显著影响,对绵羊瘤胃液氮浓度无显著影响,会影响瘤胃液挥发性脂肪酸浓度,0.015%牛至油会降低瘤胃内乙酸比例,添加效果最好。

