膜分离鸡骨素酶解液美拉德反应产物的初步研究
李 侠,沈青山,胡 礼,,张春晖,,*,唐春红,郑乾坤
(1.中国农业科学院农产品加工研究所,北京 100193; 2.重庆工商大学环境与生物工程学院,重庆 400067;3.得利斯集团有限公司,山东潍坊 262216)
近年来我国屠宰骨副产物年产量持续升高,作为世界上的鸡肉生产大国,据中国产业信息网报道,2016年我国鸡肉产量约为1200多万吨,占全球鸡肉总产量的14%,年产鲜鸡骨大约200万吨。鸡骨营养丰富,含有大量的营养活性物质,脂肪和蛋白质含量也显著高于鱼骨、猪骨、牛骨[1]。研究表明,从鸡胸软骨中提取的多糖成分,具有很强的自由基清除活性[2],张根生等[3]研究表明,鸡骨胶原蛋白肽可以有效地增强小鼠机体的抗氧化能力,从而延缓D-半乳糖诱发的小鼠衰老。然而,目前由于资金、技术等方面的原因,大量的鸡骨通常是被丢掉,或经简单粗加工生产成附加值很低的产品,并没有完全体现出鸡骨的营养价值[4]。这样不仅会造成巨大的浪费,还会污染环境。因此,需要加大对鸡骨的深度高效加工,实现其高值化利用。鸡骨素是以鸡骨为原料,提取获得的一类以骨胶蛋白为主体的复合风味基料。但是,鸡骨素存在风味单一、香气不足等问题,后期应用过程中,需要对其进行生香处理以增加其应用价值,例如可对其进行美拉德反应改善其风味。
在食品加工或者贮藏过程中,还原糖与蛋白质、多肽等含氮物质之间发生的一种非酶褐变反应称为美拉德反应[5]。该过程中会产生大量的美拉德反应产物(Maillard reaction products,MRPs),其中包括一些抗氧化物质[6]。因此,美拉德反应不仅能够赋予食品特殊的色泽风味,还可以延长货架期。虽然关于美拉德反应能够产生抗氧化物质[7]和一些特殊风味[8]的研究很多,但其反应机制依然不明确。目前,对美拉德反应产物中的小分子化合物的研究已经取得一定进展,但是对中间体和最终产物形成机理及结构和性质尚不清楚,目前认为Hoge提出的网络系统分类图解仍然是对美拉德反应机理公认为最经典的诠释[9]。
膜分离技术是利用膜分离元件对目标物质进行分离、浓缩和提纯的一种技术,主要包括微滤(Microfiltration,>50 kDa)、超滤(Ultrafiltration,50~3 kDa)、纳滤(Nanofiltration,1~0.3kDa)及反渗透(Reverse osmosis,<0.3 kDa)等[10]。本研究首先将鸡骨素进行酶解得到鸡骨素酶解液,然后鸡骨素酶解液再经美拉德反应,从而得到鸡骨素酶解液MRPs,然后基于膜分离技术对鸡骨素酶解液MRPs进行微滤、超滤、纳滤和反渗透,从而实现其不同分子量的分离,并对不同分离组分的褐变程度、风味色泽变化及抗氧化活性进行研究,为鸡骨素的进一步深度开发利用提供了一定的理论支撑。
1 材料与方法
1.1 材料与仪器
鸡骨素 可溶性固形物含量42%,河南省鹤壁市普乐泰生物科技有限公司提供;复合蛋白酶(120U/mg)、风味蛋白酶(20U/mg) 北京索莱宝公司;2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、2,2-偶氮二(2-甲基丙基咪)二盐酸(AAPH)自由基、荧光素钠盐、血管紧张素转换酶(ACE)、马尿酰-组氨酰-亮氨酸(HHL)、水溶性VE(Trolox) 美国sigma公司;pBR322型超螺旋质粒DNA 美国Thermo Fisher科技公司;其他试剂为分析纯 国药集团化学试剂有限公司。
PEN3型便携式电子鼻系统 德国Airsense公司;Agilent 1260 Infinity II型高效液相色谱仪 美国安捷伦公司;LR-2.ST型美拉德反应釜 德国IFA集团;D25L色差仪型 美国Hunterlab公司;Chameleon多功能酶标仪型 芬兰Hidex公司;1812型膜分离设备、陶瓷膜设备 合肥风云膜公司;微滤、超滤、纳滤及反渗透膜元件单支膜,有效膜面积0.37 m2北京中科瑞阳膜技术有限公司;FD-1型真空冷冻干燥机 北京博医康实验仪器有限公司;T6型紫外分光光度计 北京普析通用仪器公司;F-2500型荧光分光光度计 日本Hitachi公司。
1.2 实验方法
1.2.1 鸡骨素酶解液及其MRPs样品的制备 鸡骨素酶解液的制备:参照Dong等[11]工艺条件。鸡骨素(Brix=42%)按1∶3 (w/w)用蒸馏水稀释,调节pH至6.8。按鸡骨素质量的1.5%(w/w)添加复合蛋白酶,于40 ℃条件下水浴振荡2 h酶解。然后,将酶解液在100 ℃下水浴10 min使酶失活,冷却至室温,再按鸡骨素质量的1.5%(w/w)添加风味蛋白酶,40 ℃水浴振荡2 h继续酶解,100 ℃,10 min水浴使酶失活;2000×g离心10 min,除去沉淀得到鸡骨素酶解液。
鸡骨素酶解液MRPs样品的制备:参照孙红梅等[12]的研究方法。按鸡骨素质量的2%(w/w)向酶解液中依次添加木糖、半胱氨酸盐酸盐、硫胺素,之后取部分样液作为初始样品处理组,用NaOH溶液调节pH为5.0,在105 ℃条件下于美拉德反应釜中反应90 min后,立即冰水冷却,得到鸡骨素酶解液MRPs。
1.2.2 鸡骨素酶解液MRPs样品的分离:将制得的鸡骨素酶解液MRPs留样后,依次经过微滤、超滤、纳滤及反渗透设备过滤,滤出液经过旋转蒸发仪浓缩后,进行真空冷冻干燥,得到干粉于干燥器内保存;同时取适量鸡骨素(Stock solution of chicken bone extract,Sc)、鸡骨素酶解液(Stock solution of enzymatic hydrolysate of chicken bone extract,Se)及鸡骨素酶解液MRPs原液(Stock solution of MRPs from enzymatic hydrolysate of chicken bone extract,Sm),进行真空冷冻干燥,得到干粉于干燥器内保存,其中鸡骨素酶解液MRPs的微滤组分、超滤组分、纳滤组分、反渗透组分分别用MF、UF、NF、RO表示。准确称取5 g各类样品,用蒸馏水定容到50 mL。
1.2.3 鸡骨素酶解液MRPs吸光度及色泽测定 参考Jiang等[13]的方法,样品用蒸馏水稀释10倍,以蒸馏水为参照,使用紫外可见分光光度计,于420 nm处测定各样品褐变程度,于294 nm处测定其紫外吸收。样品用蒸馏水稀释10倍,使用荧光分光光度计测定样品的荧光强度,其中激发波长347 nm,发射波长420 nm。参考孙方达等[14]的方法测定样品色泽,样品稀释10倍后,仪器经过自检和零点、白板校正后,取50 mL样品于比色杯中测量其亮度值L*、红度值a*及黄度值b*。
1.2.4 电子鼻及感官评价 便携式电子鼻风味分析系统包含有10个检测器,对不同的挥发性风味物质灵敏[15],载气为干燥空气,流速600 mL/min。先将样品稀释5倍,置于密封管内50 ℃振荡20 min,冷却后通过顶空抽样方式进行检测,检测时间60 s,取58~60 s数据用于主成分分析。
参考钟海雁等[16]的方法,选取12名(6男6女)经过感官评定训练的初级专业评价员进行感官评价。在进行评价前12 h内,要求感官评价员不吸烟饮酒,不食用刺激性食物,且在评价过程中不能交谈。首先将待评价样品稀释5倍,用相同的容器盛装,用于挥发性风味感官评价,样品品质分为5个等级评价标准如表1所示。

表1 鸡骨素酶解液MPRs挥发性风味评分标准Table 1 Scoring standard of volatile flavor from the MRPs of onzymatic hydrolysates of chicken bone extract
1.2.5 鸡骨素酶解液MRPs抗氧化活性的测定
1.2.5.1 还原力测定 参照Wang等[17]的方法并做适当修改。吸取稀释5倍后的待测样品0.2 mL,加入1 mL磷酸缓冲液(0.2 mol/L,pH6.6)及1 mL铁氰化钾溶液(1%,w/v)。水浴(50 ℃)20 min,冷却至室温后,加入1 mL三氯乙酸溶液(10%,w/v)终止反应,2000×g离心10 min;吸取离心后的上清液1 mL,依次加入蒸馏水1 mL、三氯化铁溶液0.2 mL(0.1%,w/v),混合均匀,静置10 min后于700 nm处测定吸光度。
1.2.5.2 ABTS+自由基清除能力测定 参照Re等[18]的方法测定ABTS+自由基清除能力。配制ABTS+溶液(7 mmol/L)和过硫酸钾溶液(2.45 mmol/L)的混合液(v/v=1/1),室温避光静置12 h,使用前进行适当稀释,使其在734 nm处的吸光值为1.5~1.6;吸取稀释50倍的样品溶液200 μL加入到4 mL ABTS+溶液中,轻微振荡,暗处反应1 h,然后测定反应液在734 nm处的吸光值,记为Asample,以相同体积的纯水替代样品溶液作为空白对照,记为Ablank。
ABTS+自由基清除率(%)=(Ablank-Asample)/Ablank×100
式(1)
1.2.5.3 ACE抑制能力测定 按照Wu等[19]的方法测定ACE抑制能力。配制ACE溶液:将0.1 U ACE溶于1 mL 0.15 mol/L硼酸缓冲液(pH8.3,含0.3 mol/L NaCl),分装冻藏;HHL溶液:取HHL适量以0.15 mol/L硼酸缓冲液溶解配成5 mmol/L HHL溶液,分装冻藏。取稀释50倍的样品100 μL,加入80 μL ACE溶液,在37 ℃下保温10 min后,加入100 μL反应底物HHL溶液,在37 ℃条件下反应60 min后,加入250 μL 1.0 mol/L HCl以终止反应,高效相液相色谱检测反应液中马尿酸的含量。
色谱条件为:Agilent ZORBAX Eclipse Plus C18分析用色谱柱(4.6 mm×150 mm,5 μm),柱温25 ℃,流动相为乙腈-超纯水(V/V=1∶1,含0.05%的三氟乙酸),流速1 mL/min,检测波长228 nm,自动进样,进样体积为20 μL。
R(%)=(A-B)/A×100
式(2)
式中,R为样品对ACE活性的抑制率(%);A为空白对照组中马尿酸的峰面积(mAU·s);B为样品组中马尿酸的峰面积(mAU·s)。
1.2.5.4 氧自由基吸附能力测定 参照Dávalos等[20]的方法并加以修改,测定氧自由基吸附能力(ORAC)。在黑色96微孔板中分别加入待测样品20 μL,然后加入120 μL荧光素钠盐溶液(70 nmol/L),37 ℃下孵育15 min,用多道移液器迅速在各孔中加入60 μL氧自由基溶液(12 mmol/L)启动反应,所有溶液都用磷酸盐缓冲液配置或稀释。将微孔板迅速置于酶标仪中以485 nm激发波长,520 nm发射波长进行连续测定,每分钟测定一次各孔荧光强度,测定时间100 min(荧光衰减呈基线后为止)。空白设置为用磷酸盐缓冲溶液代替样品。所有样品为3平行,各孔不同时间点的绝对荧光强度数据fi与0 min时荧光强度f0相比,从而得到相对荧光强度值,用近似积分法算出荧光衰减曲线下的积分面积(AUC)。
式(3)
抗氧化剂的保护面积为抗氧化剂作用下的荧光衰减曲线下的面积(AUCantioxidant)与无抗氧化剂存在时自由基作用的荧光衰减曲线下的面积(AUCblank)之差,即荧光熄灭曲线的延迟部分面积(net AUC)。
net AUC=AUCantioxidant-AUCblank
式(4)
1.2.5.5 DNA损伤保护能力测定 参照Gao等[21]方法并做适当修改,用于测定鸡骨素酶解液MRPs对环状超螺旋pBR322型质粒抵抗H2O2氧化的保护能力。15 μL的反应液由1 μL pBR322型质粒DNA溶液(0.5 μg/μL)、5 μL待测样品、5 μL PBS溶液(pH7.4,10 mmol/L)、2 μL FeSO4溶液(1 mmol/L)和2 μL H2O2溶液(1 mmol/L)组成,37 ℃孵育30 min。然后进行DNA电泳检测条带,电泳条件:电压60 V,电泳50 min,于凝胶成像系统中获得电泳条带图,利用Quantity One凝胶分析软件(BIO-RAD公司)分析条带光密度获得各处理组闭环结构质粒DNA相对含量。Trolox溶液(100 μmol/L)与PBS分别替代样品作为正、负对照,用PBS替代鸡骨素酶解液MRPs、FeSO4、H2O2溶液作为空白对照。
1.2.6 层次分析及综合评分 参照聂继云等[22]的研究方法,使用yaahp层次分析软件对鸡骨素酶解液MRPs颜色、风味及抗氧化性等关键品质指标赋予权重,并根据评价指标的重要程度,构造判断矩阵进行一致性检验。参照黄曙光等[23]的研究方法,对各个不同样品进行综合评价得分。
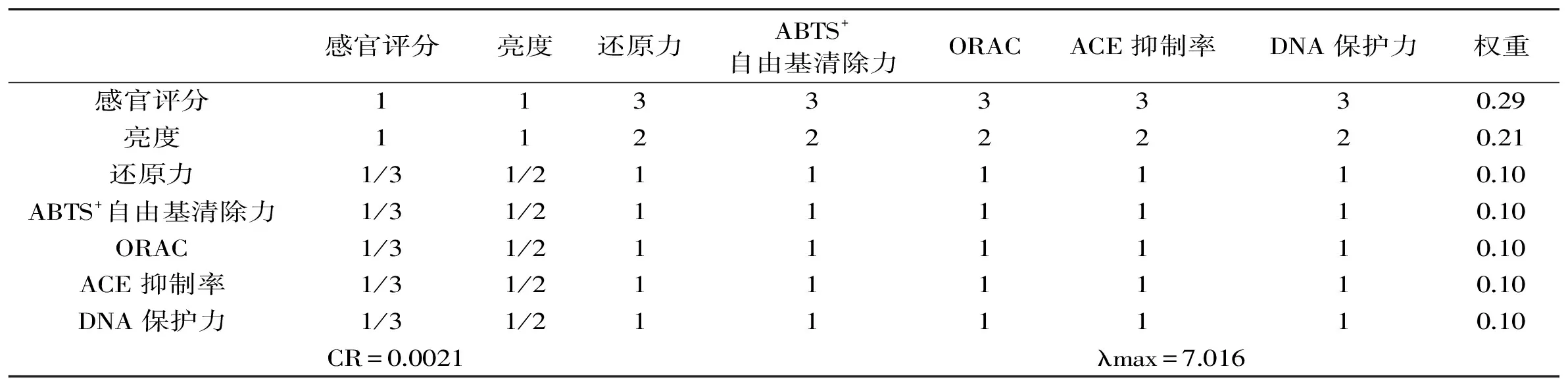
表2 鸡骨素酶解液MRPs主要指标权重判断矩阵及其一致性检验Table 2 Discriminant matrix and its consistency of evaluation indices for MRPs of enzymatic hydrolysates of chicken bone extract
利用层次分析对鸡骨素酶解液MRPs颜色、风味及抗氧化性等关键品质指标赋予权重[19],根据评价指标的重要程度,构造判断矩阵(如表1所示)。其中(max=7.016,一致性比率CR<0.1,表明此判断矩阵通过一致性检验。7个指标中,感官评价的权重为0.29,各抗氧化性指标均为0.1。
各样品的综合评价得分计算参照黄曙光等[20]的方法,具体计算公式如下:
M(b)=[bi-Min(bi)]/[Max(bi)-Min(bi)]
式(5)
M(b)=[Max(bi)-bi]/[Max(bi)-Min(bi)]
式(6)
Y=∑WiMi
式(7)
公式(5)和(6)分别为单因素“合理-满意度”的计算公式,对于越大越好的指标利用公式(5)计算,对于越小越好的指标利用公式(6)计算;其中bi表示第i个指标;Wi表示第i个评价指标的权重,Mi表示第i个指标的合理-满意度值;Y表示各个样品组的综合品质得分。
根据“合理—满意度”以及确定的评价指标的权重,利用公式(7)计算得到Y,具体公式如下:Y=0.29×M(感官评分)+0.21×M(亮度)+0.1×M(还原力)+0.1×M(ABTS+自由基清除能力)+0.1×M(ORAC)+0.1×M(ACE)+0.1×M(DNA损伤保护),由此公式计算出不同处理组鸡骨素酶解液MRPs综合品质得分。
1.3 数据分析
本研究中所有试验样品均设置3次重复。用SPSS11软件one-way ANOVA对数据进行方差分析同时利用Duncan新复极差法进行显著性检测(p<0.05)。Orgin 8.0进行绘图,其中各图同一指标中不同字母表示差异显著(p<0.05)。使用yaahp层次分析软件进行权重分析。
2 结果与分析
2.1 膜分离鸡骨素酶解液MRPs的吸光度及色泽差异
研究表明,鸡骨素酶解液MRPs在420 nm处的吸光值代表美拉德反应的褐变程度,吸收值越大,美拉德反应高级反应阶段类黑精物质的生成越多,褐变程度越高[13];在294 nm处的紫外吸收值可以反映美拉德反应中间产物的生成程度,其值越大,表明中间产物生成程度越高,初级阶段羰氨反应和分子重排的速度越快[24]。如图1A所示,微滤和超滤的鸡骨素酶解液MRPs在420 nm的吸光值较大,表明引起褐变的物质分子量大于3 kDa;而鸡骨素酶解液MRPs原液紫外吸收值最大,表明美拉德反应中间产物生成程度最高,其次纳滤的鸡骨素酶解液MRPs紫外吸收较高,表明反应中间生成物质可能集中在0.3~1 kDa,这与中间产物主要为羰氨缩合物在失去一分子水后会转变为希夫碱,再经过环化作用后形成其对应的N取代葡基胺等小分子物质是一致的[13]。

图1 MRPs中不同组分吸光度及色泽差异Fig.1 Changes of absorbance and color about the different components from MRPs注:同一指标不同字母代表差异显著(p<0.05);图4~图7同。
鸡骨素酶解液MRPs中的荧光吸收物质被认为是大分子褐变物质的重要前体物,常作为美拉德反应的指示剂,能灵敏的反映出该反应的早期过程[13,25],Morales等[26]研究发现,荧光吸收物质与DPPH等自由基清除能力有密切关系。各反应体系鸡骨素酶解液MRPs荧光强度的差异如图1B所示,鸡骨素酶解液MRPs经纳滤和反渗透后的荧光强度较强,说明美拉德反应高级产物的主要前体物分子量范围小于1 kDa。
色差仪对鸡骨素、鸡骨素酶解液、鸡骨素酶解液MRPs及其不同分子量组分进行色泽分析,结果如图1C所示,鸡骨素酶解液MRPs经超滤、纳滤、反渗透后的亮度值均超过85,且呈上升趋势,这表明鸡骨素酶解液MRPs中多数呈色物质分子量大于1 kDa。各组分红度值主要分布在0.84~3.22之间,且鸡骨素酶解液经美拉德反应后红值降低,膜分离得到的美拉德产物红度值均为负值。黄度值主要集中在10~30。鸡骨素酶解液MRPs经膜分离后的色泽变化与其褐变程度存在对应关系,随着膜孔径的变小褐变物质减少亮度增大,黄度值减小。
2.2 膜分离鸡骨素酶解液MRPs后挥发性风味物质的差异性
利用电子鼻对鸡骨素及其酶解液经膜分离鸡骨素酶解液MRPs后的挥发性风味物质进行了主成分分析,同一坐标轴上,各实验组间距越大,表示主成分差别越大[15]。图2显示第一主成分和第二主成分的贡献率分别为72.13%和16.98%,总贡献率为89.11%,大于85%,说明主成分可以很好的反映多指标信息。并且鸡骨素、鸡骨素酶解液及其鸡骨素酶解液MRPs原液在第一主成分上各个膜分离组分基本上没有重叠,表明各组分在第一主成分上差异明显,并且鸡骨素酶解液MRPs原液及其各分离组分与鸡骨素和鸡骨素酶解液在两个主成分上都与其他两者差别较大(图2),说明美拉德反应有效改变了鸡骨素酶解液的风味成分;纳滤组分和反渗透组分有重叠,表明美拉德反应产物的风味物质在不同分子量范围内都有分布,随着膜孔径的变小鸡骨素酶解液MRPs各组分在第一主成分差异逐渐增大。
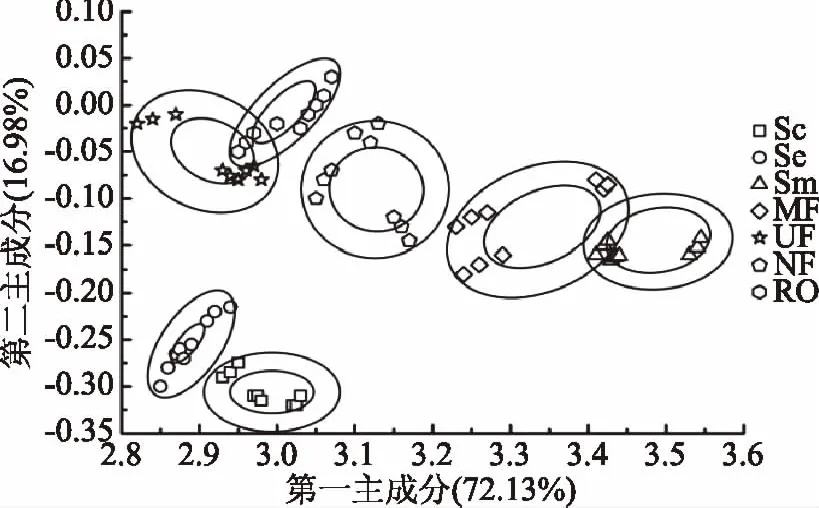
图2 膜分离后鸡骨素酶解液MRPs的主成分分析Fig.2 Analysis of principal component about the MPRs separated by membrane
对鸡骨素、鸡骨素酶解液及其MRPs感官评定得分如图3所示。由图3可知,鸡骨素、鸡骨素酶解液感官评价得分较低,进行美拉德反应生香后,感官得分明显提高;随着膜分离的进行,不同分子量范围的鸡骨素酶解液MRPs组分的感官评分基本呈现降低趋势,感官评价得分较高的组分主要集中鸡骨素酶解液MRPs的微滤组分,这是因为挥发性风味物质主要来源于美拉德反应的高级阶段,中期生成的大量活性中间体缩合、聚合或与氨基酸反应得到高分子色素、吡嗪、咪唑,生成类黑素物质,同时生成大量挥发性风味物质[27]。电子鼻测量和感官评定挥发性呈味物质,结果表明美拉德反应可以显著改变鸡骨素酶解液的风味,且呈味物质集中在微滤和纳滤组分。
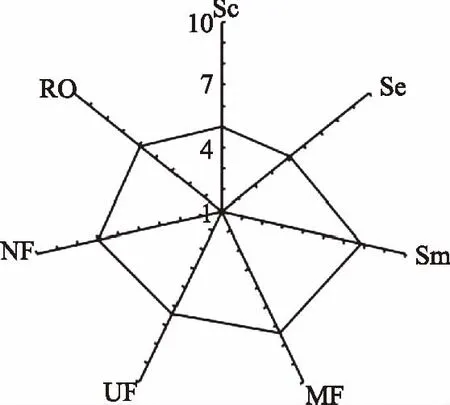
图3 膜分离后鸡骨素酶解液MRPs感官评定Fig.3 Sensory evaluation about the MRPs separated by membrane
2.3 膜分离鸡骨素酶解液MRPs抗氧化功能性差异
2.3.1 鸡骨素酶解液MRPs还原力差异性分析 当样品具有良好的供电子能力时,可将Fe3+还原成Fe2+,并可以与自由基反应,反应产物在700 nm处吸光值可用于表示还原力的强弱[28]。鸡骨素酶解液MRPs原液的铁离子还原力相对于鸡骨素酶解液显著提高(p<0.05),还原力从0.12增加到0.55,提高了3.6倍。鸡骨素酶解液MRPs各分离组分的还原能力基本呈现降低趋势(如图4),说明酶解液经美拉德反应后产生了一些还原性物质,且该物质主要集中在美拉德反应高级产物中。
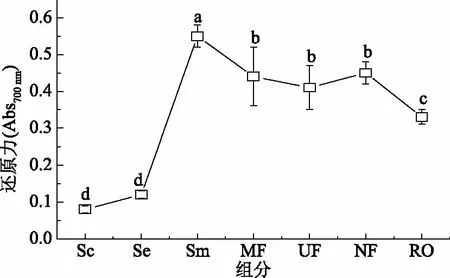
图4 鸡骨素酶解液MPRs还原力的差异性Fig.4 Difference of the MPRs about the reducing power
2.3.2 鸡骨素酶解液MRPs对ABTS+自由基清除力及ACE抑制率差异性分析 ABTS+自由基溶液不受离子强度影响,可以在多种介质中用于测定亲水和亲脂性物质的抗氧化活性[29]。如图5所示,鸡骨素酶解液MRPs经膜分离的纳滤级别的产物对ABTS+自由基清除能力较强,其他鸡骨素酶解液MRPs分离组分的清除能力次之。总体来讲鸡骨素酶解液MRPs原液与鸡骨素酶解液相比自由基清除能力显著较高(p<0.05),ABTS+自由基清除力从30.26%增加到50.42%,提高了0.7倍。
ACE抑制率的测定是以HHL作为基质,该物质与血管紧张素Ⅰ具有相同的C末端,可与ACE反应,所得产物之一马尿酸(HA),利用高效液相色谱法测定马尿酸从而计算ACE抑制率[30]。抑制ACE活性可以降低血管中紧张素Ⅱ的浓度起到降低血压的作用,研究表明食物蛋白水解物可以通过抑制ACE的活性降低高血压老鼠的血压[31]。由图5可知,鸡骨素酶解液MRPs原液相对于鸡骨素酶解液ACE抑制能力显著提高(p<0.05),ACE抑制能力从21.95%增加到72.28%,提高了2.3倍。鸡骨素酶解液MRPs各分离组分抑制率也显著高于鸡骨素、鸡骨素酶解液,但均显著低于鸡骨素酶解液MRPs原液。这表明美拉德反应产生了可以抑制ACE活性的物质,为美拉德反应的广泛应用提供新思路。
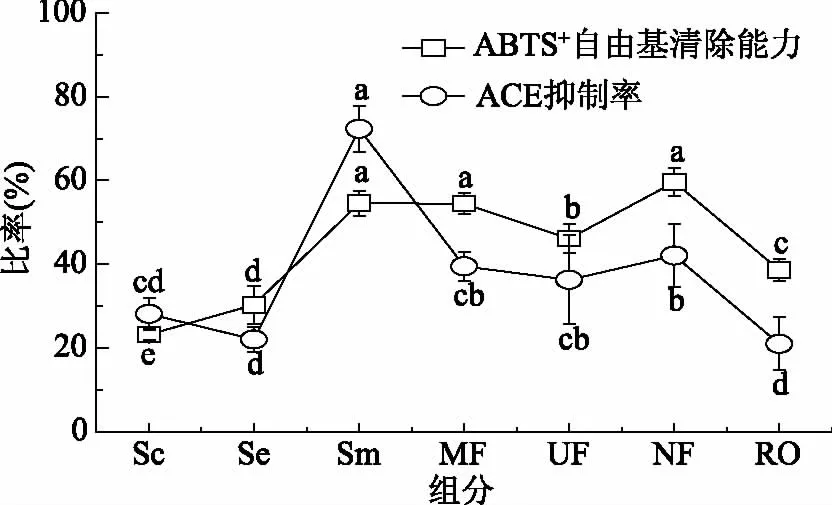
图5 鸡骨素酶解液MRPs对ABTS+自由基清除力及ACE抑制率的差异性Fig.5 Differences of the MPRs about the capacity of scavenging ABTS+ free radical and the ACE inhibitory rate
2.3.3 鸡骨素酶解液MRPs对氧自由基吸附能力差异性分析 抗氧化物质可清除氧自由基,减少氧自由基对荧光素钠盐的破坏,从而引起荧光强度变化[20]。根据图6显示结果,鸡骨素酶解液MRPs具有较高的氧自由基吸附能力,显著高于鸡骨素、鸡骨素酶解液(p<0.05),氧自由基吸附能力从7.78增加到12.09,提高了0.6倍,其他鸡骨素酶解液MRPs分离组分对氧自由基吸附能力虽然显著高于鸡骨素酶解液(p<0.05),但与鸡骨素酶解液MRPs原液相比无显著性差异。

图6 鸡骨素酶解液MRPs对氧自由基吸附能力的差异性Fig.6 Difference of the MPRs about oxygen radical absorbance capacity
2.3.4 鸡骨素酶解液MRPs对DNA氧化损伤保护能力差异性分析 H2O2、Fe2+等氧化剂能够破坏超螺旋质粒DNA环状分子,从而环状DNA会断裂形成开环结构,进一步会形成线性结构。不同的DNA分子构型在琼脂糖凝胶电泳中的迁移率不同,其中超螺旋质粒DNA泳动最快,其次为线状DNA,最慢为开环质粒DNA[32]。鸡骨素酶解液MRPs的不同组分对H2O2诱导超螺旋质粒DNA氧化损伤的保护能力差异如图7所示,在没有氧化剂(H2O2和Fe2+)的条件下,质粒DNA为闭环结构,相对含量约94.94%(C1),而加入氧化剂的处理后,闭环相对含量降低至0.25%(C2),而加入的Trolox的阳性对照组能起到有效的防止DNA损伤作用(C3)[21],鸡骨素基本对环状质粒DNA损伤无保护能力,鸡骨素酶解液对环状质粒DNA的保护能力为8.91%,鸡骨素酶解液MRPs原液对环状质粒DNA损伤保护能力达到51.94%,保护能力提高了4.8倍,显著高于酶解液(p<0.05)。除纳滤组分外,鸡骨素酶解液MRPs的其他组分对环状质粒DNA的保护能力与鸡骨素酶解液MRPs原液相比有所降低但依然显著高于VE的保护能力(p<0.05)。研究表明DNA损伤会导致细胞周期抑制、细胞凋亡和细胞衰老等不正常的生理现象[33],该研究结果表明,美拉德反应产物尤其是微滤和超滤组分,对于由氧化胁迫导致的DNA损伤有很好的保护作用,为美拉德反应在细胞抗氧化抗衰老领域的应用提供参考。
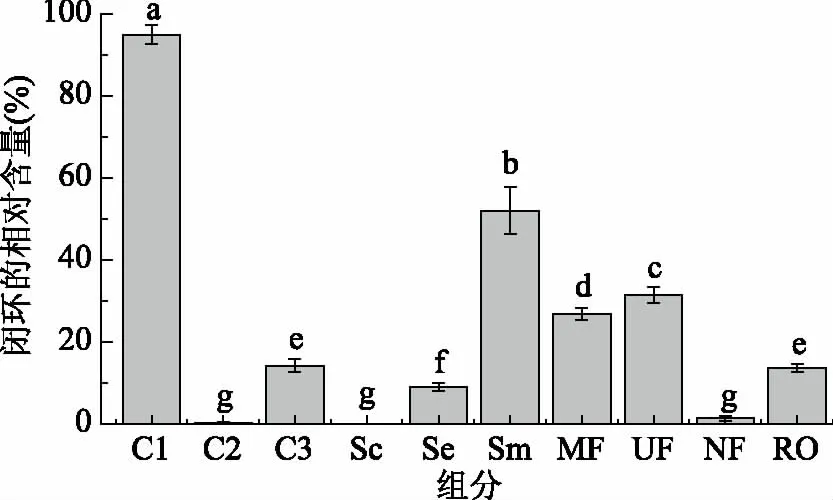
图7 鸡骨素酶解液MRPs对DNA氧化损伤保护能力的差异性Fig.7 Difference of the MPRs about the capacity of protecting DNA oxidative damage
总体来讲鸡骨素酶解液经美拉德反应后抗氧化活性得到显著提高(p<0.05),但鸡骨素酶解液MRPs经膜分离后得到不同分子量的组分抗氧化活性随着分子量的减小而减弱,各组分(除反渗透组分外)依然显著高于鸡骨素酶解液(p<0.05),这表明鸡骨素酶解液MRPs的抗氧化活性物质的分子量>0.3 kDa。
2.4 层次分析及综合评分
由各个不同样品综合评价得分(表3)可知,鸡骨素酶解液MRPs原液、纳滤及微滤为前3名,鸡骨素、鸡骨素酶解液为倒数1、2名,说明美拉德反应能显著提高鸡骨素衍生化产品的综合品质,其中鸡骨素酶解液MRPs原液,在风味、色泽及主要抗氧化能力都显著较高,鸡骨素酶解液MRPs的纳滤组分综合品质要高于其他组分。
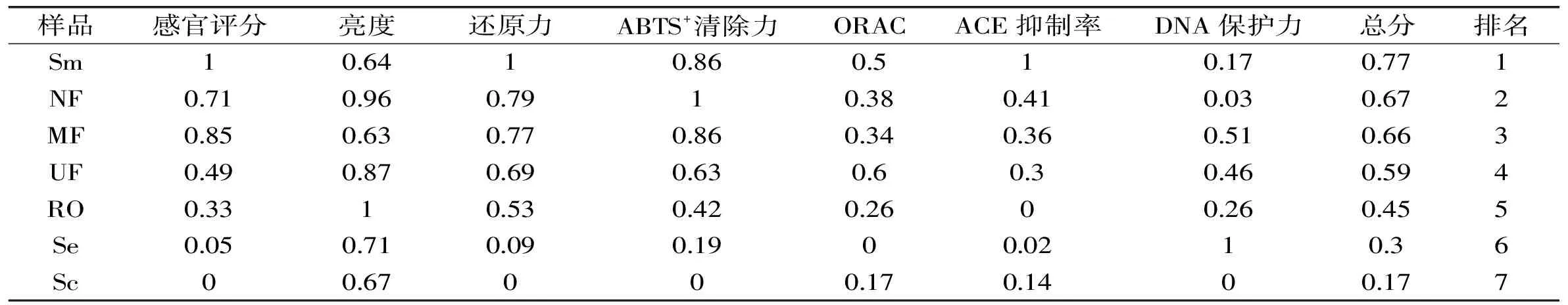
表3 鸡骨素酶解液MRPs不同组分综合品质得分Table 3 Scores of the quality evaluation for MRPs with different components
3 结论
本文对鸡骨素酶解液美拉德反应产物膜分离后的各组分进行初步探究。研究发现:鸡骨素酶解液经美拉德反应后能够有效改善鸡骨素酶解液的风味,抗氧化能力显著提高(p<0.05);鸡骨素酶解液美拉德反应引起褐变物质的分子量大于3 kDa;鸡骨素酶解液美拉德反应中间生成物质的分子量集中在0.3~1 kDa范围内;鸡骨素酶解液美拉德反应各组分的抗氧化能力随分子量的减小稍有降低,没有呈现明显的线性关系,但各组分(除反渗透组分外)抗氧化能力依然显著高于鸡骨素酶解液(p<0.05);综合评分,美拉德反应能显著提高鸡骨素衍生化产品的综合品质,与其他组分相比鸡骨素酶解液MRPs原液,在风味、色泽及主要抗氧化能力综合得分都较高,膜分离后的鸡骨素酶解液MRPs各组分综合评分虽然低于鸡骨素酶解液MRPs原液综合评分但都高于鸡骨素和鸡骨素酶解液的综合评分。本文为鸡骨素进一步深度开发利用提供了一定的理论支撑,同时为美拉德反应产物不同组分分子量的分布提供了基础信息。

