Apelin-13对H9c2心肌细胞增殖及ERK1/2信号通路活化的影响
李新春,丁水印,王霞
目前心脏疾病严重威胁着中国居民的健康,心脏病患者存在不同程度心肌细胞凋亡现象,可导致患者慢性心力衰竭[1],探讨对心肌细胞的增殖和凋亡的调控可以为心脏的发病机制及治疗从分子水平提供理论依据。Apelin作为G蛋白耦连受体的内源性配体,在人体心、肺、肝等不同组织中均有不同程度表达[2]。左心室肥大的大鼠模型中,Apelin-13的表达显著高于正常大鼠,且已证实,它与病理状态下的心脏保护有关[3]。研究表明,Apelin-13通过ERK1/2信号通路诱导肺腺癌细胞的增殖和自噬,同时可通过上调细胞周期蛋白D1诱导血管平滑肌细胞增殖[4],但Apelin-13对心肌细胞增殖的影响未见报道。因此,本研究将通过Apelin-13及ERK1/2抑制剂-U0126的干预在细胞水平探讨Apelin-13对H9c2心肌细胞增殖及ERK1/2信号通路活化的影响,进一步阐释Apelin-13对心肌细胞影响的机制,以期为心脏疾病的治疗提供新的药物治疗靶点。
1 材料和方法
1.1 主要试剂及仪器H9C2心肌细胞(中国科学院上海细胞研究院);胎牛血清(FBS)、二甲亚砜(DMSO)、胰蛋白酶、DMEM培养基(碧云天生物技术研究所);Apelin-13、U0126、MTT(美国圣克鲁斯生物技术有限公司);兔抗鼠p-ERK抗体、鼠单克隆抗体ERK、β-tubulin抗体(上海生物工程有限公司);BCA蛋白定量试剂盒(美国Hyclone-PIERCE生物技术有限公司)。
IX73倒置荧光显微镜(日本奥林巴斯光学有限公司);聚丙烯酰胺垂直电泳(美国Bio-Tek生物仪器有限公司);转膜成像系统(美国Bio-Tek生物仪器有限公司);Labwork凝胶图像分析系统(美国Bio-Tek生物仪器有限公司);ELX-808酶标仪(德国Eppendorf仪器有限公司)。
1.2 细胞培养H9C2心肌细胞使用含10% FBS、90% DMEM培养基、链霉素(100 μg/ml)和青霉素(100 μg/ml)的细胞培养液,在含有5%CO2和95%空气的培养箱中37℃恒温培养[5]。使用的培养液每2~3 d更换1次。待细胞生长到对数期时,接种到96孔培养板上,每孔4 ml(细胞数4×105/孔),最后进行分组处理。
1.3 实验分组和干预培养后的H9c2心肌细胞分为对照组、Apelin-13组、U0126组和Apelin-13+U0126四组,并分别用FBS、Apelin-13、U0126和 Apelin-13+U0126处理。Apelin-13溶解于磷酸盐缓冲液(PBS,pH=7.2~7.3)中,U0126溶解于DMSO中。
对照组H9c2心肌细胞使用10%的FBS处理和DMSO处理;Apelin-13组H9c2心肌细胞分别使用浓度为0.0001,0.001,0.01和0.1 μmol/L的Apelin-13恒温培养24 h;U0126干预组H9c2心肌细胞使用浓度为10 μmol/L的U0126恒温培养24 h;Apelin-13+U0126组H9c2心肌细胞使用0.1 μmol/L的Apelin-13和10 μmol/L的U0126恒温培养24 h。
1.4 MTT实验采用MTT法测定H9c2心肌细胞的增值率[6]。将以上各实验分组培养后的H9c2心肌细胞分别加入10 μl的MTT溶液(5 mg/ml)继续恒温培养4 h,然后弃去各组的培养液,使用PBS缓冲液洗涤2~3次后,各孔依次加入150 μl DMSO,随后在37℃恒温摇床上缓慢震荡10 min使结晶物充分溶解,最后使用酶联免疫检测仪在490 nm处测量各组各孔的光密度值(OD值,n=5)。细胞增殖率=OD实验孔/ OD对照×100%。
1.5 Western blot实验采用Western blot法测定各实验组ERK1/2信号通路磷酸化水平[7]。将以上各实验组处理的H9c2心肌细胞使用100 μl细胞裂解液(RIPA:PMSF=94:6)裂解,随后在冰上孵育30 min,细胞裂解液在4℃低温离心机中(r=18000 g)离心8 min,BCA蛋白试剂对离心后的上清蛋白定量,SDS-PAGE电泳对目的蛋白进行分离并转移到硝酸纤维(PVDF)膜上。封闭液封闭1h后,使用鼠抗β-tubulin(1:250)、鼠抗ERK1/2(1:250)、兔抗p-ERK1/2(1:250)等一抗21℃孵育过夜,随后PBS清洗后加入,分别加入辣根过氧化物酶标记的山羊抗兔二抗(1:1000),室温孵育4 h,超敏ECL化学发光显色液显色,AlphaImager 2200凝胶图像分析系统对胶片扫描分析。ERK1/2和p-ERK1/2的相对表达量在β-tubulin灰度值基础上进行比较和半定量分析。
1.6 统计学分析所有数据均使用SPSS 21.0统计软件处理,计量资料采用均数±标准差(±s)表示,多组间均数比较采用单因素ANOVA检验,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Apelin-13促进H9c2心肌细胞增殖在H9c2心肌细胞中,Apelin-13的干预显著升高各浓度组心肌细胞的OD值,并随Apelin-13浓度的增加OD值亦逐渐增加。与10%FBS的对照组比较,0.0001 μmol/L Apelin-13组的OD值差异无统计学意义(P>0.05),但0.001、0.01、0.1 μmol/L Apelin-13的干预增加了H9c2心肌细胞的OD值,差异有统计学意义(P<0.05);其中在0.001、0.01、0.1 μmol/L Apelin-13三组间的OD值差异有统计学意义(P<0.05)。从增值率的结果来看,各浓度组Apelin-13的干预明显促进了H9c2心肌细胞的增殖,并且在0.001~0.1 μmol/L Apelin-13之间,随着浓度的增加H9c2心肌细胞的增殖率升高(P<0.05)。以上结果表明:Apelin-13显著促进了H9c2心肌细胞的增殖,并存在一定的浓度依赖性,见表1。
2.2 U0126抑制Apelin-13诱导的H9c2心肌细胞的增殖加入ERK1/2抑制剂U0126降低Apelin-13诱导的H9c2心肌细胞的OD值。DMSO组、U0126组、Apelin-13+U0126组与10%FBS组组间OD值无显著统计学差异(P>0.05),且均低于0.1 μmol/L Apelin-13组(P<0.05);从增值率的结果来看,与0.1 μmol/L Apelin-13组比较,U0126的干预降低了H9c2心肌细胞的增值率,差异有统计学意义(P<0.05)。以上结果表明:ERK1/2抑制剂U0126显著抑制了Apelin-13诱导的H9c2心肌细胞的增殖(表2)。
2.3 Apelin-13上调H9c2心肌细胞p-ERK1/2的表达在H9c2心肌细胞中,Apelin-13的干预升高各组心肌细胞的p-ERK1/2表达量,并随Apelin-13浓度的增加表达量亦逐渐增加。与10%FBS对照组比较,0.0001、0.001、0.01、0.1 μmol/L Apelin-13的干预上调H9c2心肌细胞p-ERK1/2的表达(P<0.05),并且Apelin-13不同浓度四组间的p-ERK1/2的相对表达量差异有统计学意义(P<0.05),图1为p-ERK1/2及ERK1/2蛋白Western blot结果,图2为相对定量结果。Apelin-13各浓度干预组H9c2心肌细胞ERK1/2的相对表达量较10%FBS对照组无显著的统计学差异(P>0.05)(图3)。以上结果表明,Apelin-13显著上调H9c2心肌细胞的p-ERK1/2表达量,并存在浓度依赖性,同时表明,ERK1/2信号通路调控Apelin-13诱导的细胞增殖。

表1 Apelin-13各浓度对各实验组OD值的影响(x ±s,n=5)

表2 U0126对Apelin-13诱导的H9c2心肌细胞OD值的影响(x ±s,n=5)
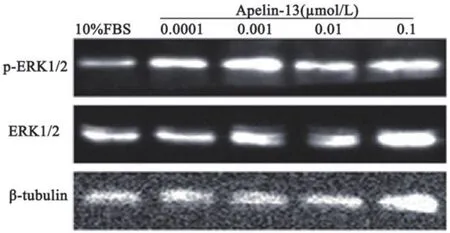
图1 各浓度Apelin-13干预组p-ERK1/2及ERK1/2蛋白的表达

图2 Apelin-13各浓度对各实验组p-ERK1/2蛋白表达的影响
图3 Apelin-13各浓度对各实验组ERK1/2蛋白表达的影响
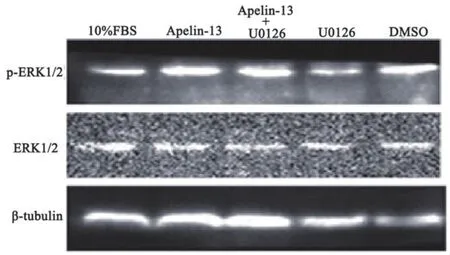
图4 U0126和Apelin-13干预组p-ERK1/2及ERK1/2蛋白的表达
2.4 U0126抑制Apelin-13诱导的H9c2心肌细胞的p-ERK1/2的表达ERK1/2抑制剂U0126降低Apelin-13诱导的H9c2心肌细胞的p-ERK1/2的表达。图4为U0126加入后p-ERK1/2及ERK1/2蛋白Western blot结果,图5为相对定量结果,在10%FBS组、DMSO组与U0126组间p-ERK1/2的表达差异无统计学意义(P>0.05);与10%FBS的对照组比较,Apelin-13组的p-ERK1/2的表达升高,差异有统计学意义(P<0.05);与Apelin-13组比较,Apelin-13+U0126组的p-ERK1/2的表达降低(P<0.05),且U0126干预后p-ERK1/2的表达较10%FBS的对照组亦无显著的统计学差异(P>0.05)。如图6所示,U0126加入后H9c2心肌细胞ERK1/2的相对表达量较10%FBS对照组无显著的统计学差异(P>0.05)。以上结果表明,U0126抑制Apelin-13诱导的H9c2心肌细胞的p-ERK1/2的表达,从而再次证明ERK1/2信号通路调控Apelin-13诱导的细胞增殖。

图5 U0126对Apelin-13干预组 p-ERK1/2蛋白表达的影响
3 讨论
心血管疾病一直困扰着中老年人的生活,严重危害人们的健康,其中多数心脏疾病主要原因为心肌缺血诱导心肌细胞凋亡,从而造成心肌肥大受损,最终导致心力衰竭[8]。在系列研究中发现,极少的心肌细胞凋亡仍会对心脏疾病的发生和发展产生极大的影响,在多种病理因素诱导的心肌细胞死亡的生理病理学过程不断伴随着心肌细胞的增殖和新生[9]。当前,关于心肌细胞凋亡和增殖的分子机制仍在研究当中,其中多种信号转导途径都可以调节心肌细胞的的增殖和凋亡,其中涉及NF-kB、MAPK、PI3K等信号通路,从多种信号途径抑制心肌细胞凋亡、促进其增殖将显著改善心肌损伤[10]。因此,进一步研究心肌细胞的增殖凋亡机制将有助于探讨心脏疾病的发病机制,并可能为临床治疗筛选出新的治疗靶点。
丝裂原活化蛋白激酶(MAPK)是生物体内一种重要的信号转导系统,ERK是MAPK家族中传递丝裂原信号的关键激酶,可依赖于Ras/Raf/MEK/ERK通路的依次磷酸化而被激活,从而介导细胞增殖和分化[11]。ERK1/2 MAPK信号传导通路是引起细胞增殖最为重要的信号传导通路之一,现有研究表明,ERK1/2参与了慢性支气管哮喘大鼠气管平滑肌细胞增殖和凋亡的调控,在平滑肌细胞中,ERK1/2 mRNA和蛋白的表达量显著增高[12];同时多种体外细胞实验证实,ERK1/2 MAPK信号通路调控卵巢癌、子宫内膜癌、表皮样癌、非小细胞肺癌、恶性胶质细胞瘤等肿瘤的增殖和凋亡[13]。
血管紧张素受(AT1-R)相关受体蛋白(APJ)为跨膜G蛋白偶联受体,其中Apelin为APJ的内源性配体[14]。Apelin /APJ调节系统广泛存在于人体内各个系统并发挥着不同的生物学效应,并且APJ与高血压、心力衰竭、心肌肥大、缺血性心脏病、肺动脉高压型心脏病等多种心血管疾病密切相关[15]。研究发现,Apelin可对小鼠表皮生长因子tdgf-1基因进行调控,进而干扰小鼠胚胎干细胞向心脏的增殖发育[16]。

图6 U0126对Apelin-13干预组ERK1/2蛋白表达的影响
Apelin-13为APJ 的内源性激动剂,它在提高细胞酸化率、抑制cAMP生成和促进细胞趋化等方面有较强的生物活性,研究证明,Apelin-13可以通过增强 APJ 的作用,提高人胚胎干细胞(hESCs)向心肌细胞的定向分化效率[17],同时Apelin-13可通过PKC-ERK1/2 -Cyclins通路促进大鼠血管平滑肌细胞增殖[18]。相关实验证明Apelin-13还可以促进多种癌细胞的增殖转移,Apelin-13可通过激活ERK1/2从而作用于相关转录因子和蛋白激酶等多种底物进入人乳腺癌细胞系MCF-7细胞细胞核,调控cyclinD1等相关基因的转录,进而参与癌细胞的生长、增殖、侵袭及转移等多种生理过程[19]。
Apelin-13对多种因素引起的急慢性心肌损害均具有明显的保护作用。与急性心肌缺血模型组相比,Apelin-13的干预显著提高了大鼠的心肌收缩力,降低左心室舒张期末压和改善多种心脏功能指标[20]。左心室肥大的大鼠模型中,Apelin-13的表达显著高于正常大鼠,且已证实,这与病理状态下的心脏保护有显著的相关性[21],但具体机制仍未明确。本研究证明Apelin-13在细胞水平显著促进了H9c2心肌细胞的增殖,并存在显著的浓度依赖性,此研究结果与上述动物体内实验结果相一致,同时表明,Apelin-13通过促进心肌细胞增殖而显著改善了大鼠的心功能;同时本研究表明,Apelin-13显著上调了H9c2心肌细胞p-ERK1/2的表达,并与Apelin-13的浓度显著相关,并且ERK1/2抑制剂U0126明显抑制了H9c2心肌细胞的增殖,并下调了p-ERK1/2的表达。
综上所述,以上结果表明ERK1/2信号通路调控Apelin-13诱导的细胞增殖,这一结果首次阐明Apelin-13促进心肌细胞增殖的机制,并可为心脏疾病的治疗及预防提供了新的研究方向。在临床中,心肌细胞的凋亡广泛存在于多种心肌病以及心功能衰竭的患者中,因此Apelin-13将可能成为治疗与心肌细胞凋亡有关疾病的重要手段。

