304不锈钢在FeCl3溶液中腐蚀行为的电化学研究
王庆顺, 关 鹤, 张 瑜
(沈阳大学 机械工程学院, 辽宁 沈阳 110044)
不锈钢因其具有优越的耐蚀性、耐热性和力学性能,并且具有良好的加工性和可焊性,而广泛应用于现代社会各个领域[1-2].不锈钢中发挥耐蚀作用的合金元素为铬(Cr),当其元素含量高于10.5%时,在腐蚀环境中会形成致密的保护膜,对基体金属有良好的保护性[3].304不锈钢是应用最为常见的不锈钢之一,具有较好的耐蚀性能,广泛应用于石油石化、汽车制造等各种领域.然而304不锈钢在含有Cl-等卤素离子的环境中,基体所形成的致密保护膜极易被破坏而引发严重的点蚀,影响材料的性能和使用寿命[4-5].由于局部腐蚀中的点蚀均是在不经意情况下造成金属材料的腐蚀穿孔,因此其破坏性和危险性比均匀腐蚀大得多[6-8].
鉴于此,目前有关304不锈钢在Cl-环境中腐蚀行为的研究十分广泛[9-12],杨瑞成[6]等认为温度升高和Cl-质量分数增大,304不锈钢的击穿电位Eb负移,钝化膜破坏严重,点蚀坑的孔径和数量均变大.高丽飞等[9]研究了304不锈钢在不同海水中点蚀行为,认为随着Cl-浓度的升高,304不锈钢的点蚀敏感性随之增加.李季[13]等研究发现304不锈钢局部腐蚀可分为4个阶段,即钝态期、亚稳态点蚀期、稳态点蚀期、稳态点蚀后期.以上研究均侧重于点蚀过程的研究及外部环境变化对点蚀敏感性的影响,而对整个腐蚀行为的研究没有深入开展.故本文采用开路电位、循环极化曲线、电化学阻抗谱测量方法研究304不锈钢在Fe3+浓度为0.001 mol·L-1时,Cl-浓度对其腐蚀行为的影响.
1 实验部分
1.1 实验材料
实验材料采用厚度为3 mm的304奥氏体不锈钢板材,其化学成分为(质量分数/%):C 0.055,Si 0.44,Mn 1.21,S 0.003,Cr 18.28,Ni 8.13和Fe余量.采用线切割的方法,将304奥氏体不锈钢板材加工成10 mm×10 mm×3 mm的方形试样.预留一个10 mm×10 mm的电极工作面,在非工作表面上采用锡焊方法焊接铜导线后,用环氧树脂将非工作面封装,待环氧树脂固化后,用150#水砂纸进行打磨直至漏出不锈钢工作表面,其有效工作面积为1 cm2,随后工作面经240#~1000#的水砂纸逐级打磨至裸露表面光亮如镜.依次应用酒精、丙酮擦拭干净,再经蒸馏水清洗干净,放在干燥器中以备电化学测试实验使用.实验配置所需的FeCl3·6H2O试剂为分析纯,溶液用去离子水配制.实验中腐蚀介质均用去离子水和分析纯化学试剂配制而成.
1.2 电化学测量
电化学测试实验仪器采用CS350电化学工作站,测量时采用标准的三电极体系,工作电极为304不锈钢,以铂(Pt)电极为辅助电极,参比电极体系由盐桥和饱和甘汞电极(SCE)组成.
测量体系开路电位-时间曲线的采样频率为5 Hz,记录48 h.循环极化曲线测试304不锈钢工作电极,循环极化测试的扫描范围为(相对于开路电位)-0.8~+2.0 V,扫描速率为5 mV·s-1,当阳极极化电流密度>1 mA·cm-2后,立刻进行反向扫描.电化学阻抗谱(EIS)测试施加的正弦交流信号的振幅为10 mV,扫描频率范围105~10-2Hz,由高频向低频扫描,测试得到阻抗谱采用Zview软件进行拟合处理.
2 实验结果与讨论
2.1 Cl-浓度对304不锈钢腐蚀电化学行为的影响
将Fe3+浓度控制在0.001 mol·L-1,配置不同Cl-浓度的溶液,监测304不锈钢浸泡48 h的开路电位-时间曲线(EOCP-t), 其结果如图1所示,Cl-浓度分别为0.003、0.03、0.1、0.2 mol·L-1. 由图可见,电极在上述溶液体系中, 开路电位随时间变化的曲线趋势大体一致. 在浸泡初期,EOCP值迅速上升,表明电极表面状态发生明显变化, 应该为不锈钢表面在三价铁离子的作用下发生钝化作用,表面生成致密的氧化物薄膜而引起电位迅速升高.浸泡1 h后,EOCP值上升幅度变慢, 电极表面钝化膜开始缓慢生长并逐渐趋于稳定.此时EOCP值也基本趋于平稳, 电极表面可能存在钝化膜的破坏和生成, 达到动态上的平衡.在浸泡后期EOCP值有缓慢下降的趋势,应为Cl-对电极表面覆盖的钝化膜发生破坏反应, 引起钝化膜破裂造成EOCP值下降.在Cl-浓度为0.003、0.03 mol·L-1的体系中,EOCP值在约5~15 h是缓慢上升阶段, 电极表面生成钝化膜逐渐稳定;而在Cl-浓度为0.1、0.2 mol·L-1的体系中,EOCP值在1~3 h为缓慢上升阶段. 与上两种体系中相比,缓慢上升的阶段极小, 说明304不锈钢在高Cl-浓度的体系中,表面钝化膜更易被破坏, 而发生腐蚀.从电极浸泡48 h的EOCP定值可以看出,随着Cl-浓度的升高,EOCP值由0.07 V减小到-0.036 6 V,说明随着Cl-浓度的升高电极表面钝化膜稳定性降低, 进而304不锈钢耐蚀性降低.

图1 304不锈钢在不同浓度Cl-溶液中开路电位时间曲线
图2为304不锈钢在Fe3+浓度为0.001 mol·L-1,对应Cl-浓度分别为0.003、0.03、0.1、0.2 mol·L-1溶液中的Nyquist图,图3为其等效电路图,表1为其拟合参数.其中,RS为溶液电阻,Rct为电荷转移电阻,CPE为双电层电容CPE-T和弥散系数CPE-P构成的常相位角元件,弥散系数可反映钝化膜的致密度,理想的光滑平面的CPE弥散效应指数为1[9].在Nyquist图中可以看出,阻抗谱为单一容抗弧的半圆,呈容抗特征.随着Cl-浓度的升高,容抗弧的半径逐渐减小,说明Cl-浓度的增加使304不锈钢在电化学反应过程中电阻减小,抗腐蚀能力减小,钝化膜稳定性变差,加速了腐蚀进行.Rct越小,表明电荷移动的阻力越小,金属腐蚀反应越易进行,腐蚀速率增大.由表1拟合参数看出,电极在随着Cl-浓度升高的体系中,RS逐渐减小,Rct值逐渐下降,说明Cl-浓度的升高促进304不锈钢离子化过程,电化学反应速率加快,促进腐蚀发生.溶液/金属界面电容CPE-T值增大,弥散系数CPE-P减小,表明弥散效应增大,离子扩散能力增加,钝化膜稳定性变差,这与Rct变化规律一致.

图2 304不锈钢在不同浓度Cl-溶液中的Nyquist图

图3 等效电路图Fig.3 Equivalent circuit diagram
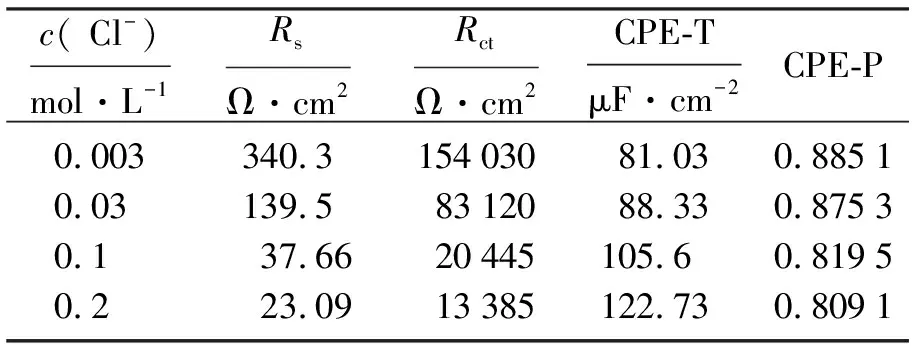
c( Cl-)mol·L-1RsΩ·cm2RctΩ·cm2CPE-TμF·cm-2CPE-P0.003340.315403081.030.88510.03139.58312088.330.87530.137.6620445105.60.81950.223.0913385122.730.8091
图4为304不锈钢在Fe3+浓度为0.001 mol·L-1,对应Cl-浓度分别为0.003、0.03、0.1、0.2 mol·L-1的溶液中浸泡12 h的循环极化曲线图.表2为其特征参数.从图4和表2数据中可见,在电极电位正扫时,自腐蚀电位随着溶液中Cl-浓度升高,自腐蚀电位Ecorr发生负移.当电位扫描过自腐蚀电位后,阳极电流密度随电极电位升高迅速增大 ,当增大一定值时,阳极电流密度随电极电位升高而减小,经过一个S型转折,表现为电极电位的升高对电流密度影响很小,为钝化区[14].Cl-浓度0.003、0.03、0.1、0.2 mol·L-1溶液中的钝化区与开路电位中钝化膜生成变得致密的电位区相一致.从图4中可见4种Cl-浓度钝化区分别为0.83、0.81、0.74和0.70 V,可见随着溶液中Cl-浓度的升高钝化区减小,钝化膜的稳定性减小,钝化膜对基体保护作用减小,这与EIS分析规律相一致.随后电极电位扫描一定值时,电流密度迅速增大,钝化膜发生破裂,即击穿电位Eb,由表2得知随着溶液中Cl-浓度增加,Eb负移,击穿电位Eb值越小,越易发生点蚀,电极耐蚀性降低.回扫时,4种浓度对应曲线均表现为相同电位下回扫的电流密度大于正扫的电流密度,形成滞后环,这是电极表面发生点蚀的特征[15-16].回扫曲线与正扫曲线的交点为保护电位Ep,从表2中看出Ep值随着溶液中Cl-浓度的升高而降低,当Cl-浓度由0.003 mol·L-1增加到0.2 mol·L-1时,Ep值由0.427 8 V减小到0.186 5 V,且Eb-Ep值随Cl-浓度的升高而增大,说明随着溶液中Cl-浓度的升高,保护电位下降,304不锈钢耐点蚀能力下降,钝化膜修复能力下降,这与Eb规律相一致.
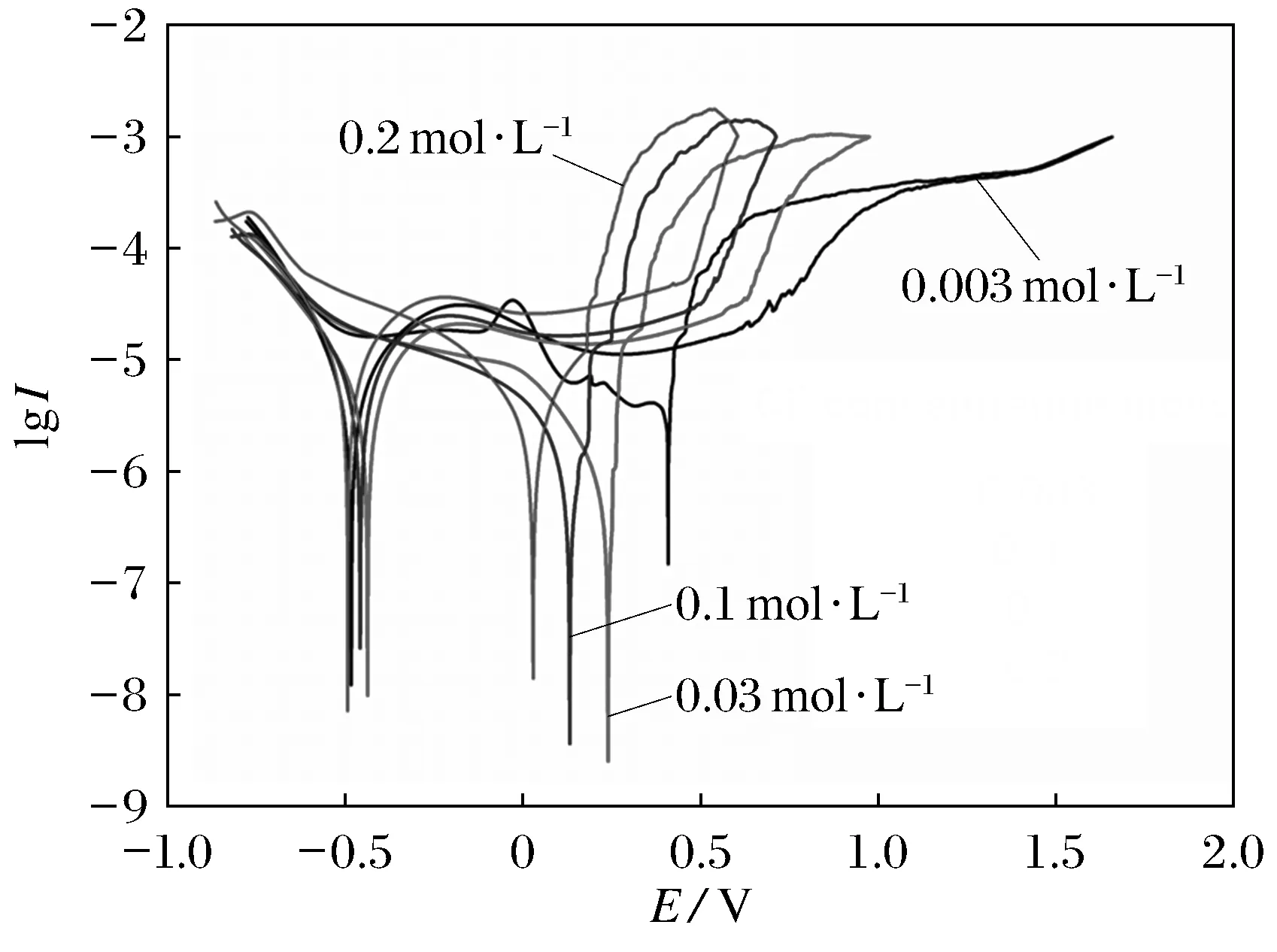
图4 304不锈钢在不同浓度Cl-溶液中的循环极化曲线

c(Cl-)mol·L-1Ecorr/ VEb/ VEp/ V(Eb-Ep)/ V0.003-0.48310.65750.42780.22970.03-0.43750.62150.28740.33410.1-0.45830.49600.24730.24870.2-0.49320.45320.18650.2667
根据以上分析可知,溶液中Cl-的浓度对304不锈钢的腐蚀行为影响很大,随Cl-浓度的增大,电极表面的钝化膜生成,且变得致密的电位区减小,钝化膜的稳定性变差,击穿电位Eb负移,耐点蚀能力下降.根据PDM理论[17-18],随着溶液中Cl-浓度的增大,Cl-与钝化膜形成的阴离子存在竞争吸附[18].Cl-的吸附造成膜/溶液界面产生的阳离子空位被Cl-取代,金属氧化物变成可溶性氯化物.Cl-浓度的增大,电极表面钝化膜极易发生局部破裂.所以电化学测量表明,随Cl-浓度的增大,304不锈钢耐点蚀性降低.
2.2 浸泡时间对304不锈钢腐蚀电化学行为的影响
图5为304不锈钢在Fe3+浓度为0.001 mol·L-1,Cl-浓度为0.2 mol·L-1溶液中浸泡不同时间的EIS图,图3为其等效电路图,拟合的电化学参数值列于表3.根据图5a、图5b和表3可见电极在浸泡初期容抗弧半径增大,Rct值在6 h时达到最大值,说明电极钝化膜生成致密,耐蚀性极好,这与开路电位变化规律相一致.随着浸泡时间的延长,溶液电阻Rs减小,48 h的Rct值比1 h的Rct值缩小约6倍,其阻抗值|Z|和相位角逐渐减小,对应的相位角的峰也逐渐变窄,说明随着浸泡时间的增加,电极钝化膜稳定性降低,耐蚀性降低.CPE-T值逐渐增大,CPE-P值减小,说明弥散效应增大,离子扩散能力增加,Cl-迅速吸附在钝化膜表面O空位处,导致膜/金属界面阳离子空位增加,阳离子空位浓度浓缩,导致钝化膜的溶解速率加快,说明钝化膜稳定性降低,极易造成点蚀的发生.

图5 304不锈钢在0.001 mol·L-1 Fe3++ 0.2 mol·L-1 Cl-溶液中浸泡不同时间EIS图Fig.5 The EIS of 304 stainless steel immersed in 0.001 mol·L-1 Fe3++0.2 mol·L-1 Cl- solution for different hours
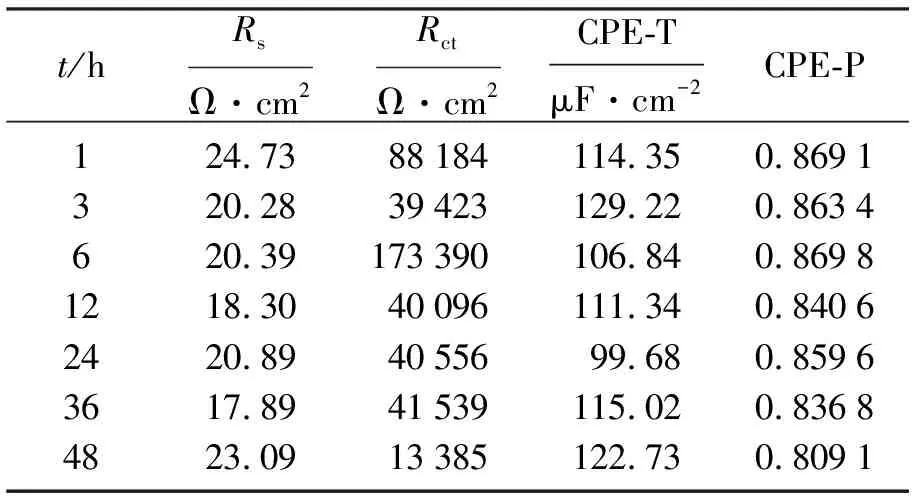
t/hRsΩ·cm2RctΩ·cm2CPE-TμF·cm-2CPE-P124.7388184114.350.8691320.2839423129.220.8634620.39173390106.840.86981218.3040096111.340.84062420.894055699.680.85963617.8941539115.020.83684823.0913385122.730.8091
图6所示为304不锈钢在Fe3+浓度为0.001 mol·L-1, Cl-浓度为0.2 mol·L-1溶液中浸泡不同时间的循环极化曲线图,其特征参数见表4.


图6 304不锈钢在0.001 mol·L-1 Fe3++0.2 mol·L-1 Cl-溶液中浸泡不同时间的循环极化曲线
可以看出,阴极极化曲线变化趋势一致,阳极极化曲线差异显著.浸泡初期Eb值增大,在6 h时达到最大值,说明钝化膜稳定耐蚀性好,这与EIS浸泡初期分析结果相一致.随着浸泡时间的延长,Ecorr和Eb值负移,说明随浸泡时间的增加304不锈钢越易发生点蚀,钝化膜的稳定性降低.Eb-Ep值随浸泡时间增加,说明电极表面极易发生点蚀,且钝化膜自我修复能力减弱.这与EIS浸泡后期分析结果相一致.
图7中可见304不锈钢在4种不同浸泡时间下表面均发生了点蚀,图7a、图7b中可以看出,样品表面有极少点蚀坑,但点蚀坑深度较浅.当浸泡12 h时,样品表面出现较多的腐蚀坑,且腐蚀坑有加深变大;当浸泡48 h时,样品表面点蚀发展为几乎全面腐蚀,且腐蚀深度继续增加.这说明随浸泡时间的增加304不锈钢钝化膜易破裂,且发生点蚀.这与循环极化曲线及EIS分析结果相一致.

图7 304不锈钢电极在 0.001 mol·L-1 Fe3++0.2 mol·L-1 Cl-溶液中浸泡不同时间的表面形貌
3 结 论
(1) 304不锈钢在Fe3+浓度为0.001 mol·L-1,对应Cl-浓度分别为0.003、0.03、0.1、0.2 mol·L-1溶液中,随Cl-浓度的升高,在开路电位中,钝化膜生成且变得致密的电位区减小,电极浸泡48 h的EOCP值下降;Nyquist图中,Rct值逐渐减小,弥散效应增大,离子扩散能力增加;循环极化曲线图中,自腐蚀电位Ecorr负移,钝化区间减小,击穿电位Eb值减小.三种方法均说明了随Cl-浓度的升高,304不锈钢钝化膜稳定性变差,耐点蚀能力下降.
(2) 304不锈钢在Fe3+浓度为0.001 mol·L-1,Cl-浓度为0.2 mol·L-1溶液中,在浸泡至6 h时,钝化膜稳定性强,耐蚀性最好.随浸泡时间的延长,钝化膜稳定性下降,自我修复能力减弱,极易发生点蚀.

