两个非自然年度猪病病原检测分析报告
徐翠 ,陈慧婷 ,黎家祥 ,左明开 ,陈良荣 ,黄冬艳 ,花象柏
(南昌珠安生物技术有限公司,江西 南昌 330013;2.江西农业大学动物科学技术学院)
1 病料来源与检测方法
1.1 病料来源
从2016年7月至2018年6月两个非自然年度,共在江西省大、中、小不同规模的猪场409户次,收集病料1 304头份。这些病料绝大部分是笔者所在团队的执业兽医师应邀前往上述猪场出诊,选择发病典型的猪只现场剖检采集。到达现场后,先详细询问病史,后进入猪舍观察病猪的临床症状,最后选择该次发病有代表性的病猪1至数头剖检,记录剖检变化,拍摄病变器官图片。所取病料1头猪作为1头份,通常包括扁桃体、肺脏、脾脏、肝脏和肾脏等器官及颌下、腹股沟、肠系膜和肺门等部位淋巴结的组织各少许,装入自封袋中,贴上标签。如临床初诊见有神经症状的,加取大脑、小脑和嗅球等脑组织;见有腹泻或肠道有明显病变者,加取小肠和大肠等组织。这些病料均一式两份,一份南昌株安生物有限公司实验室检测,一份备用或送其他实验室检测会诊。疑难细菌性病例,带培养基至现场接种。疑难病例,带固定液现场取病理组织固定切片观察。少部分病料由猪场兽医人员,经与本团队执业兽医师沟通,自行采集送来,病毒性疾病病料亦可冰冻后寄送过来。
1.2 检测方法
1.2.1 病毒类
1.2.1.1 主要试剂与仪器。饱和酚、氯仿、异丙醇、无水乙醇、RNAiso Plus、Proteinase K、2*Taq PCR MasterMix(with Dye)和DL2000 Marker等均购自宝生物工程(大连)有限公司。超净台,PCR扩增仪和高速离心机等。
样品处理及核酸抽提。根据RNAiso Plus的使用说明书进行操作。
1.2.1.2 引物设计与合成。根据GenBank登录的猪繁殖与呼吸综合征病毒(PRRSV),猪瘟病毒(CSFV),伪狂犬病病毒(PRV),猪圆环病毒 2型(PCV2),猪流行性腹泻病毒(PEDV),猪丁型冠状病毒(PDCoV),猪圆环病毒 3型(PCV3),猪捷申病毒(PTV),猪细小病毒(PPV),日本乙型脑炎病毒(JEV),猪传染性胃肠炎病毒(TGEV)和猪轮状病毒(PoRV)的基因序列,用oligo6.0软件设计引物,由生工生物工程(上海)股份有限公司合成。
1.2.1.3 核酸检测。病毒的扩增以上步抽提好的总产物为模板,用TaKaRa one Step RNA PCR Kit试剂盒进行扩增,RNA病毒如PRRSV,CSFV,PEDV等进行 RT-PCR 反应条件 RT:37℃ 15 min,85℃ 5 s;PCR:94℃ 5 min,(94℃ 30 s,56℃ 30 s,72℃ 45 s)×35个循环,72℃延伸 10 min;DNA病毒如 PRV,PCV2等进行PCR反应,反应条件:94℃5min,(94℃ 30 s,60℃ 30 s,72℃ 45s)×35个循环,72℃延伸10 min;PCR产物经1.0%琼脂糖凝胶电泳鉴定。
1.2.2 细菌类。无菌采集病料,接种于TSA培养皿上,37℃培养 24h。
1.2.3 病理切片。常规石蜡切片和H-E染色,光镜下观察。
2 结果与分析
2.1 全部检测结果统计
自2016年7月至2018年6月,两个非自然年度各病原的阳性检出率如下:病毒类:PRRSV为63.7%(497/780),PCV2 为 89.3%(475/532),PRV 为11.6%(47/404),CSFV 为 7.2%(32/446),PEDV 为28.4%(119/419),PDCoV 为 34.9%(15/43),PCV3 为37.5%(3/8),PTV 为 43.3%(13/30),PPV 为 15.4%(4/26),JEV为2.6%(1/38),未检出TGEV和 PoRV。细菌类:猪丹毒杆菌为66.7%(4/6),副猪嗜血杆菌为22.2%(4/18),猪副伤寒沙门氏菌为 100%(3/3),猪链球菌为53.1%(17/32)。
2.2 混合感染的统计
依据2.1所示的全部病原检测结果,可知PRRSV,PCV2和PEDV等3种病原检出率较高,故混合感染情况统计,分别以这3种病原为基础感染来进行。
2.2.1 以PRRSV为基础感染,见表1。
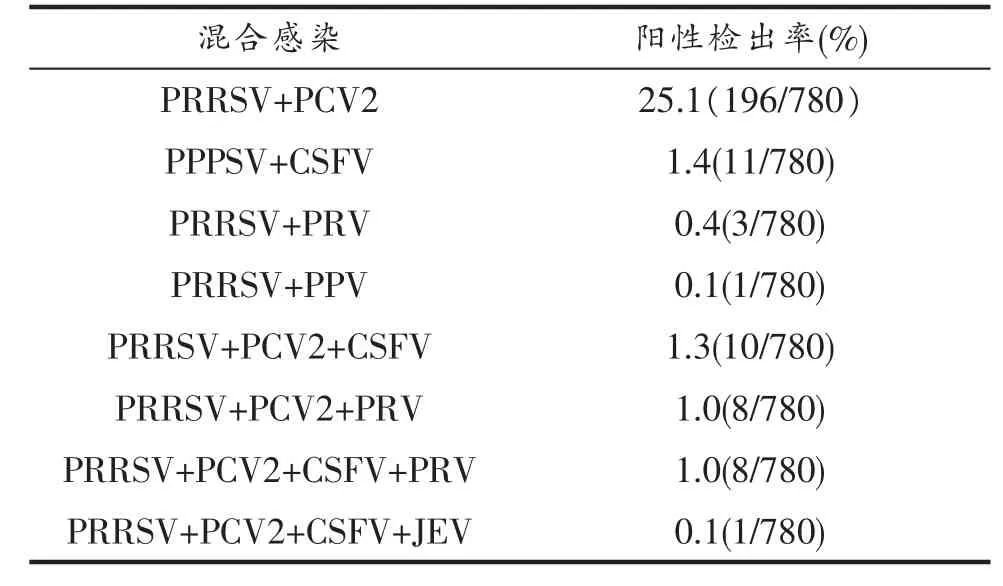
表1 PRRSV与其他病毒混合感染情况
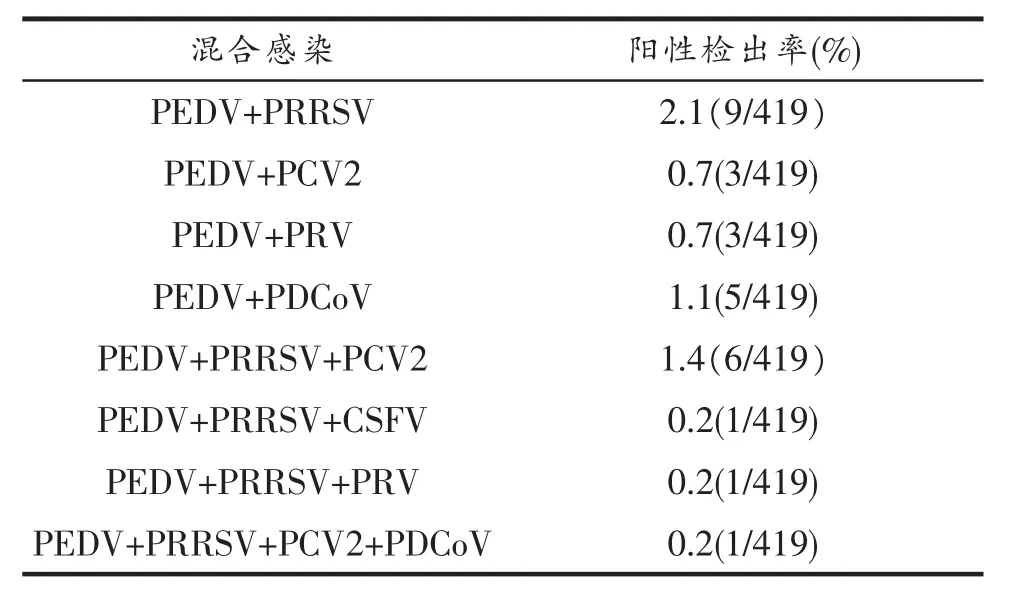
表2 PEDV与其他病毒混合感染情况
2.2.2 以PEDV为基础感染,见表2。
2.2.3 以PCV2为基础感染,二重感染为CSFV,或PRV的阳性检出率分别为2.3%(12/532),或0.6%(3/532)。
3 小结与讨论
3.1 自2016年7月至2018年6月两个非自然年度的猪病病原检测结果表明,检测病例数较多且检出率较高的是PRRSV,PCV2和PEDV等3种病原。说明全省各类型猪场危害严重的猪病是以PRRSV为病原的蓝耳病,以PCV2为病原的圆环病毒病和以PEDV为主要病原的低日龄仔猪腹泻。由于猪场蓝耳病疫苗接种情况为少数未接种,多数为接种不规范,或病原类型发生变化,导致PRRSV检出率高。由它导致的猪体免疫功能降低,可继发多种其他猪的病原感染,尤其是PCV2的继发,使这种二重感染
检出率达25.1%(196/780)[1],尽管绝大多数猪场都接种了PCV2型疫苗。事实上,这种二重感染已成为猪场普遍存在的问题,并导致了猪场严重的经济损失。2017年7月,江西余江一养殖户,因多年未对其饲养的猪群接种蓝耳病疫苗,结果暴发类似2006年下半年普遍发生的那种蓝耳病,损失惨重。采取该场4头病死猪的病料检测证实PRRSV、PCV2、PRV和CSFV均为阳性,构成四重感染,尽管后3种病原引起的猪病均接种了疫苗,这种情况是较为罕见的。
3.2 本报告结果中列出了PTV的检出,值得一提的是该病原的检出过程。2017年5月,我省一大型法系纯种猪场50 d以上的保育猪发生一种类似蓝耳病的猪病,但病料经针对PRRSV的RT-PCR检测结果并不支持蓝耳病的临床初诊。病理切片观察揭示了该病的端倪。病料经针对PTV的PCR检测,并通过测序确定为PTV,于是明确了该场所发猪病是捷申病,属我省首次报道[2]。
3.3 自2010年以来,全国各地先后发生发病与致死率均极高的低日龄(2~5 d)仔猪腹泻。该病的一个特点是一种针对PEDV的疫苗在不同的发病猪场使用,效果不尽相同,引发思考。经过对本报告中报道的相关PEDV的混合感染的多量检测分析,初步认为下列因素左右了该病的防控。一是:病原的多样性,不只是PEDV,还存在PDCoV及其两者的混合感染;二是:发病诱因(或混合感染)为PRRSV、PCV2、PRV和CSFV的一个或多个存在于该病当中[3];从而增加了低日龄仔猪腹泻的防控难度,也为防控低日龄仔猪腹泻找到了更好的途径。
3.4 本报告中一些检测病例数较少或检出率较低的病原,原因各不相同。由于未接种疫苗,副猪嗜血杆菌病在实践中发病很多,是蓝耳病的一种重要继发感染;但因其剖检病变明显,故被病理诊断确定;只是进行药敏试验的病例才取病料检测。猪丹毒在未接种疫苗的猪场发病也较多,但因用青霉素治疗效果好,只是在反复发生的病例才取病料检测确诊。猪副伤寒沙门氏菌多年来已淡出人们的视线,疫苗亦不再使用;但近来剖检时见到一些大肠粘膜发生糠麸样坏死的病例,病料检测证实为副伤寒沙门氏菌,应引起重视。猪链球菌是在未应用疫苗或应用疫苗后发病才进行检测,后者分离菌血清型鉴定证实疫苗中确实没有包含所检测到的血清型。PPV、JEV和TGEV等所引起的猪病因疫苗的使用得到了有效的控制。PCV3和PTV(目前均无该两种相关疫苗)检出少,PoRV(未接种该疫苗)未检出,则反映了它们真实的发病情况。CSFV和PRV两种疫苗都是猪场的常规免疫,CSFV的少量检出由各种因素导致的免疫失败所致,PRV的少量检出则可能与PRV病原变异有关。

