间充质干细胞对慢性间质性肾炎大鼠肾小管上皮细胞表型的影响
李维,杨园园,姜红
(中国医科大学附属第一医院儿科,沈阳 110001)
慢性间质性肾炎是一组以肾小管萎缩、基膜增厚、间质纤维化和不同程度细胞浸润为主要表现的疾病[1],引起间质性肾炎的原因很多,含马兜铃酸的中草药导致的慢性肾小管间质性肾炎统称为慢性马兜铃酸肾病 (chronic aristolochic acid nephropathy,CAAN) 。CAAN的主要特点为慢性肾功能衰竭,病理上表现为寡细胞性肾间质纤维化。目前尚未明确其具体的发病机制,亦无特效治疗方法,因此多数患者病情持续进展至终末期肾衰竭。研究[2-5]表明,间充质干细胞 (mesenchymal stem cells,MSCs) 可以跨胚层分化为中胚层及外胚层组织,并可以通过旁分泌的免疫调节作用对组织细胞损伤进行修复。本研究通过观察肾小管上皮细胞的标志蛋白细胞角蛋白18 (cytokeratin18,CK18) 在MSCs移植前后蛋白及mRNA表达的变化,从细胞因子水平阐述CAAN大鼠肾小管上皮-间充质转化 (epithelial-mesenchymal transition,EMT) 机制,进而探讨慢性间质性肾炎肾间质纤维化的可能机制及治疗方法。
1 材料与方法
1.1 材料
Wistar大鼠40只,由中国医科大学动物部提供,许可证号:SCXK (辽) 2002-000。其中雌性30只,雄性10只,体质量 (200±5) g,7周龄。关木通水煎剂按文献[6]方法配置,4 ℃冰箱保存备用。
主要试剂:小鼠抗大鼠CK18单克隆抗体 (工作浓度1∶100) 、SABC即用型试剂盒 (武汉博士德公司);TRIzolTMReagent (美国Invitrogen公司);Bradford蛋白分析试剂盒 (美国Bio-Rad公司);PCR引物 (联星生物工程有限公司);半定量逆转录PCR (RT-PCR)试剂盒 (大连宝生物公司) 。
1.2 研究方法
1.2.1 细胞培养与鉴定:吸入性麻醉雄性供体Wistar大鼠,切取股骨和胫骨,去除骨两端,DMEM培养液冲洗骨髓腔至股骨呈白色,收集10只供体大鼠的骨髓细胞,200目钢筛过滤成单细胞悬液,离心并收集沉淀细胞,具体细胞培养鉴定方法同文献[7]。
1.2.2 分组及干预措施:将30只雌性Wistar大鼠随机分为对照组、治疗组、非治疗组。治疗组和非治疗组大鼠予以关木通水煎剂灌胃,制作CAAN模型。对照组大鼠予以饮用水灌胃。第12周末,治疗组大鼠尾静脉输入MSCs 2×107/mL;非治疗组和对照组大鼠尾静脉输入等量生理盐水。于干预第8周末处死大鼠,并留取血、尿、肾组织标本待检。
1.2.3 CK18免疫组化染色:按免疫组化试剂盒常规程序操作,并依次加一抗 (小鼠抗大鼠CK18单克隆抗体) 、二抗 (IgG即用型SABC试剂盒) 及PBS缓冲液(作为阴性对照) 。
1.2.4 RT-PCR:引物设计,β-actin上游引物5’-CCA GGATAGAGCCACCAAT-3’,下游5’-GCCAACCGTG AAAAGATG-3’,扩增片段长度为700 bp;CK18上游引物5’-GGACCTCAGCAAGATCATGGC-3’,下游引物5’-CCACGACCTTACGGGTAGTTG-3’,扩 增片段长度为437 bp。RNA提取、逆转录合成cDNA、PCR反应、电泳等按试剂盒说明书操作。
1.2.5 Western blotting:RIPA细胞裂解缓冲液提取肾组织总蛋白,按常规方法进行。
1.3 统计学分析
采用SPSS 12.0软件进行统计分析,数据以表示,采用单因素方差分析比较组间差异,P< 0.05为差异有统计学意义。
2 结果
2.1 一般状态观察
非治疗组:随时间延长大鼠状态变差,进食及活动减少,毛色秽暗,体质量增长缓慢,后期出现负增长。治疗组:大鼠一般状态明显好于非治疗组,且与干预第4周比较,活动和进食增加,体质量增加,毛色恢复光泽,大便成形。对照组:大鼠进食及活动正常,毛色光泽,排成形便,体质量稳定增加。
2.2 组织切片病理学检测
非治疗组:肾小管在光镜下出现明显扩张萎缩、间质纤维化面积明显增大。治疗组:肾小管形态结构较非治疗组明显改善,与干预第4周比较,随治疗时间延长间质纤维化有进一步改善。对照组:肾小管结构完整,形态规则,无间质纤维化。
2.3 免疫组化结果
CK18阳性表达主要位于肾小管上皮细胞膜,呈黄褐色。染色结果 (图1) 显示,对照组大鼠的肾小管上皮细胞中CK18呈强阳性表达,IOD 值为38.27±2.39。非治疗组CK18表达明显减少,与干预第4周比较进一步下降,尤其在严重萎缩的肾小管和大面积间质纤维化区域甚至完全缺乏,IOD 值为7.59±1.81,与对照组比较有统计学差异 (P< 0.01) 。治疗组中与干预第4周比较,随时间延长CK18阳性表达进一步增多,IOD 值为25.01±3.85,CK18阳性表达明显高于非治疗组 (P< 0.01) ,但仍低于对照组(P< 0.01) 。
2.4 RT-PCR检测结果
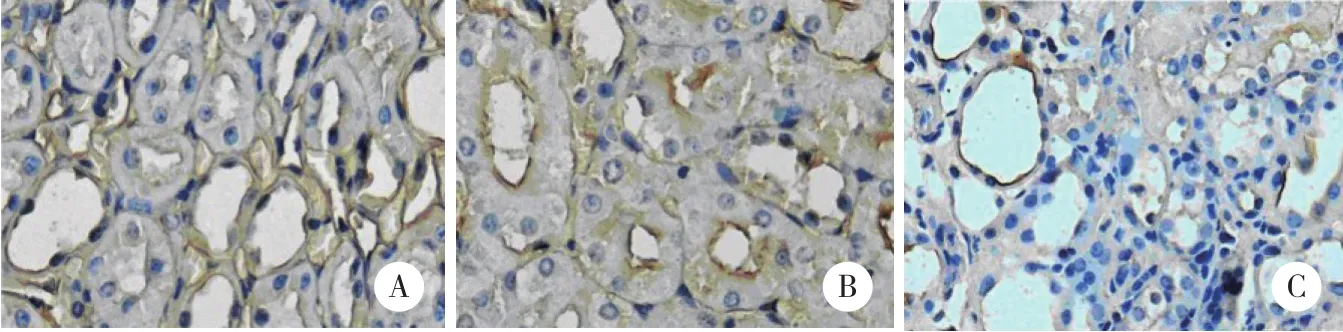
图1 大鼠肾脏CK18免疫组化染色 ×400Fig.1 Immunohistochemical staining of CK18 in rat kidneys ×400
对照组肾组织中CK18mRNA呈高表达。非治疗组CK18mRNA表达量明显低于治疗组及对照组,电泳灰度值下降。治疗组条带灰度值增高,表达量较非治疗组明显提高,且与干预第4周比较,随时间延长CK18mRNA表达量进一步增加,但仍低于对照组。见图2。
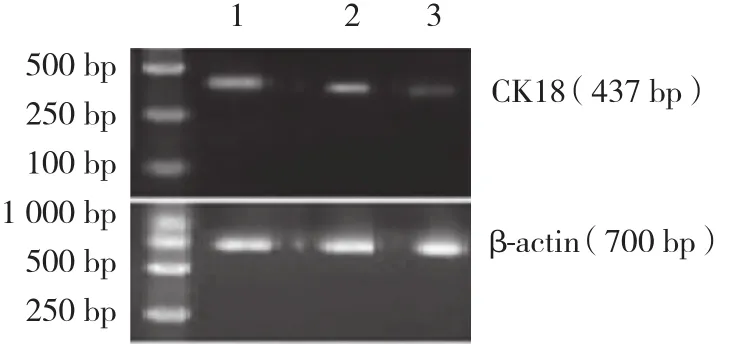
图2 大鼠肾组织CK18 mRNA RT-PCR检测结果Fig.2 RT-PCR of CK18 mRNA in rat kidneys
2.5 Western blotting结果
对照组:CK18蛋白在肾组织中高表达。非治疗组:CK18蛋白呈弱表达,条带灰度值变小,与对照组及治疗组比较表达强度明显降低。治疗组:CK蛋白表达量与非治疗组比较明显增加,仍低于对照组。见图3。
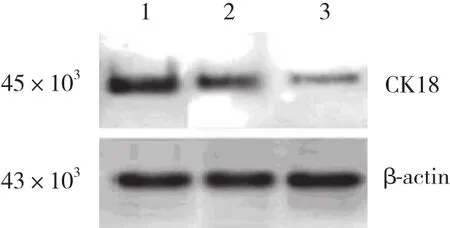
图3 大鼠肾组织CK18蛋白Western blotting检测结果Fig.3 Western blotting of CK18 protein in rat kidneys
3 讨论
慢性间质性肾炎肾小管间质区病变较肾小球或血管损害明显,肾小管不同程度扩张,间质中有不同程度的炎症细胞浸润和纤维化。国外统计显示,慢性间质性肾炎是导致终末期肾病的主要原因,占21.6 %[8]。由于此病临床表现缺乏特异性,诊断往往很不及时,因此明确间质性肾炎的发病机制、逆转间质纤维化是降低肾衰发病率的关键。引起肾间质损害的机制涉及免疫损伤、感染、中毒、代谢紊乱、尿流机械梗阻和遗传因素等方面,其中导致间质性肾炎的药物包括两性霉素B、止痛剂、非类固醇类抗炎药、顺铂、马兜铃类中药等。关木通等中草药因含有马兜铃酸可引起CAAN,导致肾脏间质损伤,进而引起慢性间质性肾炎,肾间质纤维化是最典型的特征之一[9]。本研究观察到同样的病理改变,光镜下可以看到随着病程的延长,非治疗组肾小管间质损害逐渐加重,第4周纤维化非常明显,至第8周损害进一步加重,出现大片状肾间质纤维化,肾小管极度萎缩。
研究[10]表明,肌成纤维细胞合成的细胞外基质过度堆积是组织、器官纤维化的主要原因,因此明确引起肌成纤维细胞分化的因素对预防或逆转纤维化过程尤为重要,而肌成纤维细胞的重要来源之一是肾小管上皮细胞转分化。目前CAAN肾间质纤维化机制仍不十分清楚,患者病情多进行性恶化,如何降低转分化是控制肾纤维化的关键。研究表明,不同来源的MSCs已经成为促进肾脏再生的重要研究方向。相关文献[11]表明,MSCs通过独立的分化途径,在修复肾损伤、改善肾功能和结构方面具有治疗潜力。MSCs可以跨系跨胚层分化并具有免疫调节作用,利用这一特性,国内外许多研究发现MSCs可以向肾脏细胞分化,改善肾功能,其可能通过多种机制对组织损伤进行修复和再生,包括细胞-细胞接触、介质分泌、外泌体的产生,甚至可以形成产生营养因子 (包括mRNA和miRNA) 和线粒体的膜纳米管去修复受损细胞。其分泌生物活性因子,增强血管生成,抑制炎症和调节免疫系统。在器官损伤中,MSCs可以抑制纤维化、增补局部干细胞并刺激它们的存活、增殖和分化[12-14]。
本研究通过关木通水煎剂灌胃制作CAAN大鼠模型,并给予CAAN大鼠MSCs干预治疗,通过观察肾小管上皮细胞正常细胞表型表达的变化,寻找CAAN肾纤维化的机制。本研究发现,非治疗组肾小管上皮细胞表型标志物CK18的表达量明显下降,且随病程进展下降更显著,而治疗组CK18阳性表达较非治疗组明显增多 (P< 0.01) 。各种上皮细胞中均有CK18的表达,CK18也是肾小管上皮细胞正常表型的标志蛋白,其本质是一种非水溶性纤维性多肽,在萎缩或纤维化的肾小管其表达消失。有文献[15]报道,在不同的肾病模型中肾小管上皮细胞CK18的表达存在不同程度的缺失,且同时出现平滑肌肌动蛋白的表达,提示有EMT,而对照组肾小管上皮细胞100%表达CK18。由于出现EMT,上皮细胞可产生细胞外基质,进而可直接参与肾间质纤维化的进程。本研究显示,CAAN大鼠肾脏肾小管上皮细胞表面标志蛋白CK18表达下降,而平滑肌肌动蛋白表达增多,进一步证明CAAN存在EMT。本研究中,CK18的表达量在治疗组明显增加,且大鼠肾功能好转,一般状态得到改善,随时间延长大鼠活动逐渐增多,食欲增加,说明MSCs可能通过调节转分化相关细胞因子CK18的表达降低EMT,进而改善肾间质纤维化,延缓肾衰竭,对CAAN有改善作用。
CAAN是导致间质性肾炎、肾纤维化的常见原因,尽管在大多数国家已经禁止使用含有马兜铃酸的产品,但CAAN病例在世界各地仍时有报道。此外,由于传统的草药配方中广泛存在马兜铃酸以及对这种疾病的意识薄弱,CAAN的发病率可能被严重低估[16]。目前尚无有效治疗方法,疾病逐渐进展,最终发展为肾衰竭,需透析或移植替代治疗,给家庭和社会带来沉重的负担。本研究初步证明了MSCs移植对CAAN治疗的可行性及有效性,通过MSCs的干预调节可改善肾纤维化,为慢性间质性肾炎的治疗提供了一个新的机制和方法。

