数字PCR检测cfDNA中KRAS突变的灵敏度研究
罗宇文 ,李瑶 ,景奉香
1.复旦大学生命科学学院,上海 200438;2苏州溯源精微生物科技有限公司,江苏苏州 215300;3.中国科学院上海微系统与信息技术研究所,上海 200042
1999年B.Vogelstein[1]在检测KRAS突变时提出了数字PCR概念。2011年数字PCR仪器问世,但是国内鲜有对数字PCR液态活检灵敏度的量化评价研究[2-4]。
21世纪初,美国临床和实验室标准院发表了EP-17A文件—确定检测下限(Limit of Detection,LOD)与定量下限(Limit of Quantification,LOQ)的方法。同时,国际标准化组织也颁布了论述LOD的文件—ISO 11 843。但业界缺乏对于LOD重要性的认知导致的,现有的标准也忽略了现代仪器的特点而且往往只适用于正态分布[5]。该研究于2017年1月基于Bio-Rad公司的QX200微滴式数字 PCR(Droplet Digital PCR,ddPCR)系统量化评价了数字PCR对cfDNA中肠癌相关KRAS突变检测的灵敏度,并比较了计算方式间差异。为数字PCR标准化提供了方法依据,为数字PCR应用于肿瘤液态活检提供了理论依据。
1 材料与方法
1.1 标准品
质粒标准品由实验室构建并克隆,选择KRAS基因12和13号外显子上7个突变型和野生型基因作为备选基因, 突变型包括:G12C、G12V、G12D、G12R、G12S、G12A、G13D。
1.2 样品处理
20名平均年龄45岁健康人对照血浆标本均来自于郑州大学附属医院。血浆按照临床常规方法采集血液,在采集分离当天提取cfDNA。
1.3 微滴式数字PCR方法建立
ddPCR引物探针设计原理为TAQ-MAN探针法。扩增子为7种常见KRAS突变基因型与野生型KRAS,所有突变型和野生型使用通用上下游引物并分别针对每种突变型设计FAM标记的Taqman探针,同时对于KRAS野生型设计HEX标记的Taqman探针,以FAM与HEX的拷贝数读值比例体现突变基因含量。每个反应体系中加入2 μL反应模板。
将每个配制好的PCR反应体系通过QX200?Droplet Generator(Bio-Rad)制备为20 000个反应微滴并于普通PCR仪上进行扩增。PCR反应结束后将96孔板放入QX200TMDroplet Reader(Bio-Rad)中同时检测FAM和HEX的荧光信号。仪器会自动分析每个样品的每个微滴中荧光信号,获得靶序列在PCR反应体系中的拷贝数浓度(单位:copies/μL)及突变浓度。
1.4 方法学论证
1.4.1 检测性能分析 通过梯度混合不同比例的突变型质粒标准品分别使用ddPCR进行3重复检测,并同时检测野生型质粒标准品与空白对照,所有标准品质粒在反应体系中的终浓度为1×105拷贝。以野生型质粒及空白对照检测结果的假阳性程度判定检测方法的特异性,以梯度混合突变型质粒的稳定检出范围(变异系数CV≤25%、决定系数R2≥0.98)定义LOQ。
G12C和G12D基因型梯度混合突变型质粒的梯度依次为:100%、10%、1%、0.1%、0.01%; G12V、G12R、G12S、G12A、G13D基因型梯度混合突变型质粒的梯度依次为:1%、0.2%、0.1%、0.04%、0.01%。
1.4.2 LOD计算 如果以ISO 11843及EP-17A的分析方式来讨论ddPCR的LOD,则默认其检测结果服从正态分布,由于在抽样量足够大的情况下,泊松分布的极限是正态分布,所以该研究中尝试了正态分布相关的LOD算法:
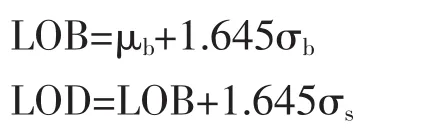
其中μb为阴性对照测得均值,σb为阴性对照测得标准差,σs为低浓度阳性样本测得标准差,LOB为空白本底检测限(Limit of Blank)。
对于ddPCR更为科学的方式是通过泊松分布的置信区间计算LOD。首先LOB需要通过假阳性率(False Positive Rate,FPR)计算,这里的FPR定义为平均每个反应中出现的假阳性微滴数,计算公式为:
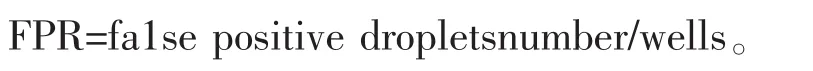
以FPR的泊松分布正向95%置信区间分位数作为LOB,同时以LOB作为LOD的负方向95%置信区间分位数来推测LOD的数学期望。其估计方法最常见为查阅泊松分布概率密度函数表,在Milbury等的研究中则采用了泊松分布样本量较大时的正态分布近似计算法[6]如表1所示。
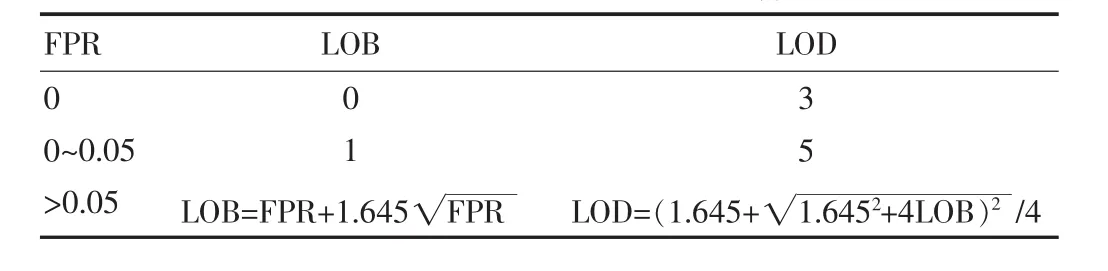
表1 泊松分布的正态近似LOD计算方法
2 结果
2.1 ddPCR检测线性
图1所示为G12C与G12D的理论/测得值线性图,图 2 所示为 G12V、G12R、G12S、G12A、G13D 的理论/测得值线性图。所有突变型各样品都检出阳性,0.1%及以上浓度的CV都小于25%。野生型质粒和空白对照检测结果都没有出现假阳性,所有突变基因型线性方程的R2都大于0.98。

图1 G12C与G12D线性图,横轴为理论值,纵轴为测得值

图2 G12V、G12R、G12S、G12A、G13D 的线性图,横轴为理论值,纵轴为测得值
2.2 健康人样本的ddPCR检测及LOD值
该研究中比较了3种ddPCR理论LOD值判定法:第1种是依据正态分布计算LOD(LOD判定法1),其低浓度样本误差来自0.01%及0.04%质粒标准品的ddPCR检测数据。第2及第3种都依据于ddPCR中阳性微滴符合泊松分布,区别是LOD判定法2采用表1中的计算法,而判定法3采用了查表法。具体判定结果见表2。

表2 3种不同方法判定的ddPCR KRAS突变检测法的LOD
3 讨论
在肿瘤突变基因的液态活检中,cfDNA由于含量极低所以对于检测方法的灵敏度及低浓度下定量精确度有较高要求。数字PCR应用于肿瘤突变基因液态活检国外已有报道,其定量检测数据优于qPCR[7-8]。但同类研究大多都还在使用标准品实验经验值判定灵敏度而没有使用量化的临床判定标准,所以该研究基于泊松分布的数学模型进行LOD、LOQ分析的意义重大。
ddPCR的LOD对应反应中拷贝数总量为3.48拷贝,由于目前所使用ddPCR设备的总微滴数上限为20 000个,对应可测得拷贝数上限为100 000拷贝,精确定量可达到20 000拷贝,故其灵敏度可以达到0.017%~0.003%。而同类qPCR或ARMS-PCR的灵敏度则一般为0.1%左右。
以该次实验结果可判断,微滴式数字PCR具有超过现有常见PCR方法的灵敏度和定量精准度,其LOD可以以泊松分布量化计算。同时,该研究中LOD判定法3在临床血浆cfDNA液态活检应用中,数字PCR测得值可以与中国人理论突变水平对应,验证了其可靠性。综上所述,数字PCR适合用与液态活检等高灵敏度需求的应用。
综上所述,该研究量化评估了数字PCR在对于血浆cfDNA中KRAS突变检测实验中的灵敏度,研究中确立的LOD算法有足够的统计学依据与实验证据支持,可以推广到多种基于数字PCR检测实验的灵敏度判定中。同时,该研究中基于临床样本判定的LOD可以使用大量临床样本进行验证,并结合患者确诊情况和用药情况建立ROC曲线、确定科学的Cut Off值,为临床应用奠定基础。

