大豆球蛋白碱性肽对黑曲霉的抑制效果和机理的研究
郝曼,李迎秋
(齐鲁工业大学 食品科学与工程学院,济南 250353)
大豆球蛋白碱性肽是从大豆球蛋白中分离提取的一种碱性多肽,属于阳离子肽,其分子量将近20 kDa,通过1个二硫键与大豆球蛋白酸性肽链接[1]。有研究报道GBP对一些革兰氏阴性和革兰氏阳性细菌具有抑菌性[2]。GBP的抑菌机理可能是由于GBP具有阳离子和疏水性,GBP能够作用于细菌细胞膜,从而抑制细菌的生长。Li等[3]研究表明GBP破坏了细菌细胞膜磷脂双层结构,增大了细胞膜的渗透性,使大肠杆菌细胞中蛋白质和离子泄露,导致细胞死亡。GBP可以改善巴氏杀菌奶和冷冻猪肉的感官特性,减少细菌总数(TPC),从而延长保质期[4]。目前,关于GBP的抗真菌特性的研究较少,尤其是对黑曲霉的抑菌特性研究更少,黑曲霉是导致食物腐败变质的主要污染菌之一,本文研究了GBP对黑曲霉的抑菌特性,以期望其能够作为一种天然的防腐剂应用于食品的保鲜。通过牛津杯实验、孢子萌发率的测定和生长曲线的测定研究了GBP对黑曲霉的抑菌效果。通过pH和离子泄露的测定研究了GBP对黑曲霉的抑菌机理。
1 材料与方法
1.1 材料与试剂
琼脂、过氯酸、氯化钾、硝酸/葡萄糖:杭州昊天生物技术有限公司;黑曲霉:从变质鲜湿面条中分离提纯得到;GBP:由实验室富集所得。
1.2 主要仪器与设备
压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;移液枪 蓝宇科技试剂公司;霉菌培养箱 上海一恒科学仪器有限公司;光学显微镜、pH酸度计 东莞市创瑞检测设备有限公司;DHZ-C型大容量恒温振荡器 普瑞特机械有限公司;SW-CJ-2F双面净化工作台 苏净集团安泰公司;原子吸收光谱仪 美国PerkinElmer公司;AL204电子天平 梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 抑菌效果测试
参考Wang等[5]的方法,采用牛津杯法测定抑菌圈直径。吸取100 μL孢子悬浮液(1×105孢子/mL),将其注入无菌培养皿中凝固的察氏培养基表面,无菌涂布棒涂布均匀。取3个牛津杯放置于培养皿中,牛津杯呈正三角形,分别吸取150 mL同浓度的GBP溶液注入其中2个牛津杯中,再吸取150 mL无菌蒸馏水注入第3个牛津杯中作为对照,不同培养皿牛津杯中注入GBP的浓度分别为0.4,0.8,1.2,1.6,2.0,2.4 mg/mL,将所有培养皿放置于霉菌培养箱中,28 ℃培养3天,测量抑菌圈直径。
1.3.2 霉菌孢子萌发率的测定
采用Tian等[6]的方法研究不同GBP对黑曲霉孢子萌发的影响。将GBP加入到含有察氏液体培养基和1 mL 0.1%(V/V)吐温溶液的玻璃试管中,使GBP最终浓度分别为0,0.2,0.4,0.8,1.6,3.2 mg/mL。将100 μL孢子悬浮液(1×105孢子/mL)接种到上述试管中,从试管中分别吸取10 μL溶液注入凹玻片,盖上盖玻片,放置在恒温培养箱中于28 ℃条件下培养20 h,每个GBP浓度做3个平行,以孢子长出芽管、菌丝作为孢子萌发的标志。观察孢子萌发的情况,计算孢子萌发率。
采用Tian的方法研究GBP对黑曲霉孢子生长动力的影响。将GBP加入到含有察氏液体培养基和1 mL 0.1%(V/V)吐温溶液的玻璃试管中,使GBP最终浓度分别为0.4,0.8,1.6 mg/mL。将孢子悬浮液接种到上述试管中,每个试管中分别加入100 μL黑曲霉孢子悬浮液(1×105孢子/mL),并置于摇床中于28 ℃,100 r/min条件下震荡培养10,20,30,40,50,60 h,将其在6000 r/min、常温条件下离心5 min。去掉上清液,将沉淀物悬浮在0.1%吐温-80溶液中。吸取10 μL的孢子悬浮液加入凹玻片,盖上盖玻片,然后置于光学显微镜下观察孢子萌发情况,计算孢子萌发率。
1.3.3 霉菌生长曲线的测定
参照Wu等[7]的方法通过测定霉菌生长曲线来研究GBP对黑曲霉菌丝生长的影响。取数支试管加入一定量的察氏液体培养基,向试管中接入100 μL黑曲霉孢子悬浮液(1×105孢子/mL),然后放置在恒温震荡培养箱中于28 ℃,150 r/min条件下震荡培养48 h。向霉菌培养液试管中添加一定量的察氏液体培养基,然后向其中部分试管中加入GBP,使GBP的最终浓度为1.6 mg/mL作为实验组,其他霉菌培养液试管不加GBP作为对照组。将试管放置在恒温震荡培养箱中于28 ℃,150 r/min条件下震荡培养。在特定的时间将实验组和对照组的试管从恒温震荡培养箱中移出,在4 ℃冰箱中保存一段时间后,将菌液于8000×g条件下离心25 min,去掉上清液,沉淀物放在循环烘箱中于105 ℃条件下干燥4 h,然后称重。
1.3.4 细胞外溶液pH测定
参照Tian等[8]的方法探索细胞外溶液酸化情况,以研究GBP对黑曲霉的抑菌机理,将适量的孢子悬浮液(1×107孢子/mL)注入盛有察氏液体培养基的锥形瓶中,放置于霉菌培养箱中于28 ℃条件下培养48 h。过滤得到菌丝并使用去离子水洗涤2次。称取菌丝1.0 g,于40 mL 50 mmol/L KCl溶液中悬浮,然后饥饿处理18 h(4 ℃条件下)。将GBP溶液分别注入菌丝悬浮液中,使其中GBP的最终浓度为0,0.2,0.4,0.8,1.6,3.2 mg/mL。将经GBP处理的菌丝悬浮液于室温条件下静置10 min,然后加入20 mL 10%葡萄糖溶液,诱导菌丝细胞外溶液酸化。加入葡萄糖溶液后分别在0,30,60,90,120,150 min时用pH酸度计测定菌丝细胞外溶液的pH值。
1.3.5 钙、钾离子泄露的测定
参考Wu等的方法测定黑曲霉菌丝细胞外溶液的离子浓度,以研究GBP对黑曲霉细胞膜通透性的影响。吸取100 μL黑曲菌孢子悬浮液(105孢子/mL)接种于含有察氏液体培养基的锥形瓶中,放置在恒温振荡培养箱中培养48 h(28 ℃,150 r/min),将菌液离心10 min(28 ℃,10000×g),得到菌丝,然后将菌丝用50 mmol/L的3-(N-吗啉基)丙磺酸缓冲液洗涤2次后重悬于50 mmol/L的3-(N-吗啉基)丙磺酸缓冲液(含1%葡萄糖)中,分成等份试样6份。将6份悬浮液加入2种不同浓度的GBP溶液,使菌丝悬浮液中GBP的最终浓度为0,1.6 mg/mL,于摇床中 28 ℃培养。在30,60,90,120,150 min时分别吸取3 mL样品于消化瓶中,加入硝酸和过氯酸(比例4∶1)的混合酸5 mL,用电热炉小火加热,待消化瓶中剩余液体1 mL左右时,继续注入混合酸5 mL并小火加热,如此反复操作,直至消化瓶中呈现透明状液体后停止加热。将消化液中液体稀释至25 mL,使用原子吸收光谱仪测量稀释液的钙、钾离子浓度。
2 结果与讨论
2.1 GBP对黑曲霉的抑制效果

图1 经GBP处理后的黑曲霉抑菌圈图Fig.1 The photos of inhibition zones of A. niger treated with different GBP concentration
通过测定抑菌圈直径大小来评价GBP对黑曲霉的抑制效果,抑菌圈越大,其抑制作用越显著。由图1可知,对照组中牛津杯周围无抑菌圈出现,而经0.4,0.8,1.6 mg/mL GBP处理的出现抑菌圈,且随着GBP浓度的增大,抑菌圈越明显。
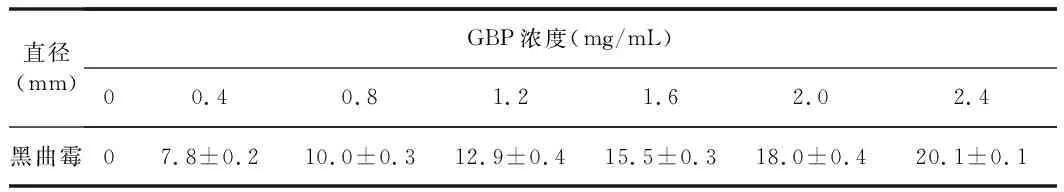
表1 黑曲霉抑菌圈直径大小Table 1 The inhibition zones' diameters with different GBP concentration against A. niger
由表1可知,GBP溶液浓度越大,抑菌圈直径越大。当GBP溶液浓度从0增大到2.4 mg/mL时,黑曲霉培养基的抑菌圈直径分别从0增大到20.1 mm。以上结果表明GBP对黑曲霉具有较强的抑制作用,一定的浓度范围内,抑制作用随GBP浓度的增大而增强。
2.2 GBP对霉菌孢子萌发的影响
GBP对黑曲霉孢子萌发的影响见图2和图3。

图2 不同浓度GBP对黑曲霉孢子萌发的影响Fig.2 The effects of different concentration of GBP on spore germination of A. niger
由图2可知,GBP能够抑制黑曲霉孢子的萌发。未经GBP处理的黑曲霉孢子萌发率为100%,而经不同浓度(0,0.2,0.4,0.8,1.6,3.2 mg/mL)GBP处理的黑曲霉孢子萌发率明显低于100%,且随着GBP浓度的增大而降低。当GBP浓度为1.6,3.2 mg/mL时,孢子萌发率分别为41%和26%,抑菌效果较为显著。以上结果说明,GBP能抑制黑曲霉孢子的萌发,且浓度越大,抑制效果越显著。

图3 经GBP处理后的黑曲霉生长动力图Fig.3 The growth kinetics of the inhibition of A. niger treated with GBP
由图3可知,在0~60 h内,经不同浓度(0.4,0.8,1.6 mg/mL)GBP处理的黑曲霉孢子萌发受到不同程度的抑制,且随着GBP处理时间的延长和GBP浓度的增大,黑曲霉孢子萌发率降低。处理10 h时,1.6 mg/mL的GBP对黑曲霉孢子萌发的抑制率已经达到50%;处理60 h时,抑制率达到100%。以上数据说明,GBP能抑制黑曲霉孢子的萌发,且浓度越大,处理时间越长,抑制效果越显著。
2.3 GBP对霉菌菌丝生长的影响
GBP对黑曲霉菌丝生长的影响见图4。

图4 经GBP处理后的黑曲霉生长曲线图Fig.4 The growth curve of A. niger treated with different concentration of GBP
黑曲霉的生长期分为3个阶段:停滞期(0~35 h),对数生长期(35~65 h),稳定期(65 h以后)。在50 h之内,经0,0.16 mg/mL GBP处理的菌丝体干重变化呈现相同的趋势。经过短暂的对数生长期后,GBP处理的菌丝体干重急剧下降,而对照组中菌丝体干重则呈现增大的趋势。65 h以后经0,0.16 mg/mL GBP处理的菌丝体干重变化逐渐趋于稳定,以上数据表明,GBP能够抑制黑曲霉菌丝的生长。
2.4 GBP对霉菌细胞外pH的影响

图5 GBP对黑曲霉细胞外pH的影响Fig.5 The effects of GBP on the extracellular pH of A. niger
由图5可知,对照组随着时间的延长,黑曲霉细胞外溶液的pH值从5.7降低到4.09,下降趋势较为明显;而经GBP处理的黑曲霉菌丝细胞外溶液的pH值随着时间的延长下降趋势则比较平缓,尤其是经浓度为1.6,3.2 mg/mL GBP处理的细胞外溶液的pH值下降趋势最为平缓。当处理时间相同时,GBP浓度越大,pH值越大。以上结果说明,GBP破坏了菌体通过细胞膜上质子泵将细胞内质子转移到细胞外的功能,从而阻止了葡萄糖诱导的黑曲霉细胞外溶液的酸化,进而导致了黑曲霉菌丝细胞的死亡。GBP浓度越大,阻止细胞外溶液酸化的能力越强。
2.5 GBP对黑曲霉钙、钾离子释放的影响
GBP对细胞膜功能的影响已通过对黑曲霉细胞外溶液pH的测定来评价。在本实验中,通过对钙、钾离子泄露的测定进一步评价GBP对黑曲霉细胞膜的影响。GBP对黑曲霉钙、钾离子泄露的影响结果见图6。

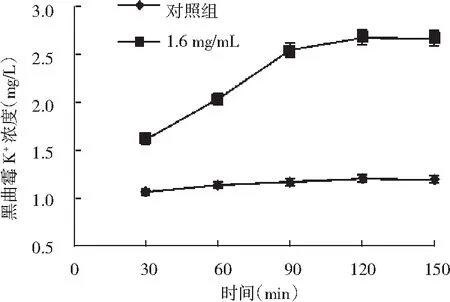
图6 GBP对黑曲霉菌丝细胞内Ca2+、K+泄露的影响Fig.6 The effects of GBP on leakage of Ca2+, K+ in mycelial cell of A. niger
对照组中黑曲霉菌悬液中的Ca2+、K+浓度升高比较缓慢,150 min后分别达到2.13,1.19 mg/L。经1.6 mg/mL GBP处理的黑曲霉菌悬液中Ca2+、K+离子浓度都显著高于对照组,且随着时间增大而增大,在150 min后分别达到8.72,2.66 mg/L。因此,GBP可以破坏黑曲霉细胞膜,使其通透性增大,导致Ca2+、K+离子的泄露。
3 结论
本文研究了GBP对黑曲霉的抑制效果和抑菌机理。实验结果表明GBP对黑曲霉具有较显著的抑制效果。经GBP处理的牛津杯周围出现明显的抑菌圈,且黑曲霉抑菌圈直径随着GBP浓度的增大而增大;GBP有效抑制了黑曲霉孢子的萌发和菌丝的生长。GBP通过阻止由葡萄糖诱导的菌丝细胞外溶液的酸化抑制霉菌的生长;GBP也能够增大黑曲霉菌丝体细胞膜的通透性,使细胞内Ca2+、K+金属离子泄露,导致细胞死亡。因此,GBP可以作为一种天然的防腐剂应用于食品保鲜。

