半胱胺盐酸盐对冬毛期雄性水貂毛皮品质、血清生化和激素指标及肝脏相关基因表达的影响
孙伟丽 樊燕燕 张 婷 王 卓 李恒伟 李光玉*
(1.中国农业科学院特产研究所,吉林省特种经济动物分子生物学国家重点实验室,长春 130112;2.牧原食品科技股份有限公司,洛阳 420106;3.山东亚康检测技术有限公司,潍坊 261101)
半胱胺盐酸盐(cysteamine hydrochloride,CSH)作为一种功能性饲料添加剂,具有多种生物学作用,主要表现在通过调节内分泌功能、耗竭生长抑素(SS)来促进动物生长[1],这在鸡、猪等畜禽及水产动物生产上已得到证实。CSH作为一种SS抑制剂的出现,在畜禽生产上被广泛应用,主要在于其可以通过神经内分泌途径来调控畜禽的生长。CSH主要通过抑制机体外周组织和中枢神经组织的SS免疫活性和生物活性发挥作用,从而相对提高机体生长激素(GH)含量,促进动物生长,是一种高效的SS抑制剂。有研究表明,CSH可以降低垂体催乳素含量,抑制多巴胺β羟化酶活性[2-4]。多巴胺β羟化酶可以催化多巴胺生成去甲肾上腺素,其活性的抑制导致多巴胺在下丘脑大量蓄积,从而促进GH的合成和分泌,进而促进动物生长。CSH可以引起动物机体组织(胰腺、消化道和中枢神经组织等)和血清中SS免疫活性的迅速丧失,且在胰腺组织中,CSH在抑制胰岛细胞中SS免疫活性的同时,可禁止胰岛细胞分泌SS[5-8];Mcleod等[9]研究发现,CSH可以提高机体胰岛素、胰岛素样生长因子-Ⅰ(IGF-Ⅰ)、三碘甲腺原氨酸(T3)、甲状腺素(T4)的分泌。这些激素是促进机体生长发育,参与机体同化作用的重要激素,对动物生长具有一定的促进作用。
影响毛皮动物产毛品质的一个关键因素是饲料营养,营养调控技术是改善毛皮动物皮张质量、提高养殖效益的关键技术。王忠艳[10]研究发现,在饲粮中每隔5 d添加70 mg/kg BW的CSH可以提高银狐平均日增重和饲料转化率,同时对繁殖期银狐产仔率也有一定的改善作用。白世平等[11]研究发现,饲粮添加CSH可以提高育成期雄性水貂的平均日增重和整个生长期的血清GH、T3、T4和IGF-Ⅰ含量,对毛皮品质也有一定的改善作用。黄卉[12]研究发现,在干粉饲粮中添加20 mg/kg的CSH可以提高貉平均日增重、营养物质消化率、饲料转化率和毛皮品质,同时提高血清中总蛋白(TP)、胆固醇(CHO)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)和甘油三酯(TG)含量。徐银学等[13]研究发现,饲粮添加5 mg/d的CSH对海狸鼠有一定的促生长作用,同时可以提高血清GH和IGF-Ⅰ含量。
CSH对毛皮动物有一定的促生长作用,但是作用机理还有待进一步探讨。根据以上背景,结合水貂的生理特点及CSH的作用机理开展本试验,旨在研究饲粮中添加CSH对冬毛期雄性水貂毛皮品质、血清生化和激素指标及肝脏相关基因表达的影响,以期为CSH在水貂生产上的应用提供理论依据。
1 材料与方法
1.1 试验材料
试验所用CSH为β-CD-CSH,由上海华扩达生化科技有限公司提供,是以β-环糊精与CSH等营养活性物质,采用超分子技术、仿生物膜技术和维持生理稳态技术,经特殊工艺生产的生理代谢调控添加剂,具有一定的稳定性,CSH有效成分含量≥30%。
1.2 试验设计
试验在中国农业科学院特产研究所毛皮动物试验基地进行。试验采用双因子试验设计,影响因素为CSH的添加水平和添加方式。选取160日龄体重[(2.13±0.10) kg]相近的健康雄性水貂56只,随机分为7组,每组8个重复,每个重复1只。预试期7 d,正试期51 d。
1.3 试验饲粮与饲养管理
基础饲粮为参照NRC[14](1982)中有关的水貂营养需要量,并结合本课题组多年来试验结果设计的冬毛期饲粮。基础饲粮组成及营养水平见表1。各组分别饲喂在基础饲粮基础中添加0(Ⅰ组,对照组)、60(Ⅱ组)、90(Ⅲ组)、120(Ⅳ组)、60(Ⅴ组)、90(Ⅵ组)、120 mg/kg(Ⅶ组)CSH的试验饲粮;其中,Ⅱ、Ⅲ、Ⅳ组添加方式为连续添加,Ⅴ、Ⅵ、Ⅶ组添加方式为间隔添加(连续添加1周,间隔1周)。试验动物单笼饲养,由专人进行饲养管理,每日08:00和15:00各饲喂1次,自由采食并保证充足饮水。观察试验动物健康状况并做好记录。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供 The premix provided the following per kg of the diet: VA 10 000 IU,VD32 000 IU,VE 100 IU,VB16 mg,VB210 mg,VB66 mg,VB120.1 mg,VK31 mg,VC 400 mg,烟酸 nicotinic acid 30 mg,D-泛酸D-pantothenic acid 40 mg,生物素 biotin 0.2 mg,叶酸 folic acid 1 mg,胆碱 choline 400 mg,Fe 82 mg,Cu 20 mg,Mn 120 mg,Zn 50 mg,I 0.5 mg,Se 0.2 mg,Co 0.3 mg。2)代谢能为计算值,其他为实测值。ME was a calculated value, while the others were measured values.
1.4 样品采集与指标测试
1.4.1 毛皮品质指标测定
饲养试验结束后,采用皮下注射氯化琥珀胆碱的方法对动物实施安乐死后,取皮后上煊板由鼻尖到尾根测定皮长,并用精密刻度尺测量背中部皮肤的针毛长度、绒毛长度。
1.4.2 血清生化和激素指标测定
饲养试验结束后,每组挑选6只健康水貂,屠宰前每只水貂心脏采血5 mL,装入促凝采血管,迅速带回实验室,4 000 r/min离心10 min,分离血清于1.5 mL EP离心管中,-20 ℃冷冻保存备用。血清生化指标[TP、白蛋白(ALB)、球蛋白(GLO)、尿素氮(UN)、TG、CHO含量] 采用全自动生化分析仪(Selectra E,荷兰)测定,严格按照试剂盒要求进行操作,试剂盒购自中生北控生物科技股份有限公司。血清激素指标[GH、SS、生长激素受体(GHR)、IGF-Ⅰ、胰岛素样生长因子-I受体(IGF-ⅠR)、T3、T4含量]采用酶联免疫吸附测定(ELISA)试剂盒进行测定,严格按照试剂盒要求进行操作,试剂盒购自南京中生北控生物科技股份有限公司。
1.4.3 肝脏相关基因表达量测定
饲养试验结束后,对试验动物实施安乐死。解剖取肝脏5~10 g,放入RNase-free冻存管中,现场置入液氮保存,隔天转入-80 ℃冷藏。准备试剂如下:RNase-free、DNase-free Water、氯仿、异丙醇、无水乙醇,Trizol、反转录试剂盒、PCR试剂盒、DNA Marker DL500、pMDTM18-T Vector、琼脂糖凝胶DNA回收试剂盒、荧光定量PCR反应试剂盒。采用Trizol法提取水貂肝脏总RNA,参照TaKaRa的反转录试剂盒,采用两步法进行,第1步去除基因组DNA,第2步反转录。β-肌动蛋白(β-actin)引物参照张海华[15]设计;根据GenBank中水貂IGF-Ⅰ序列(登录号:FJ_472818.1)、胰岛素样生长因子-1受体(IGF-ⅠR)序列(登录号:XM_004759809.1)和生长激素受体(GHR)序列(登录号:XM_004737948.2)利用Primer 5.0设计特异性引物;引物由华大基因合成,PCR引物序列见表2。基因的表达量用2-ΔΔCT法计算。

表2 PCR引物序列
1.5 统计分析
数据采用统计软件SAS 9.1进行双因素方差分析(two-way ANOVA),差异显著性采用Duncan氏法进行多重比较,再采用GLM程序对数据进行多因子统计分析,数据以平均值±标准差表示。P>0.05为差异不显著,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 CSH对冬毛期雄性水貂毛皮品质的影响
由表4可知,饲粮中添加CSH显著影响了水貂皮长、针毛长度和绒毛长度(P<0.05)。水貂皮长随着CSH添加水平的提高而增大,Ⅵ和Ⅶ组显著高于对照组(P<0.05);针毛长度、绒毛长度分别以Ⅶ和Ⅵ组最高,分别极显著(P<0.01)和显著(P<0.05)高于对照组。CSH添加方式极显著影响了水貂针毛长度(P<0.01),间隔添加组极显著高于连续添加组(P<0.01)。CSH添加水平显著影响了水貂针毛长度(P<0.05),90 mg/kg添加组显著高于60和120 mg/kg添加组(P<0.05)。CSH添加方式和添加水平对水貂针毛长度、绒毛长度有显著或极显著交互作用(P<0.05或P<0.01)。
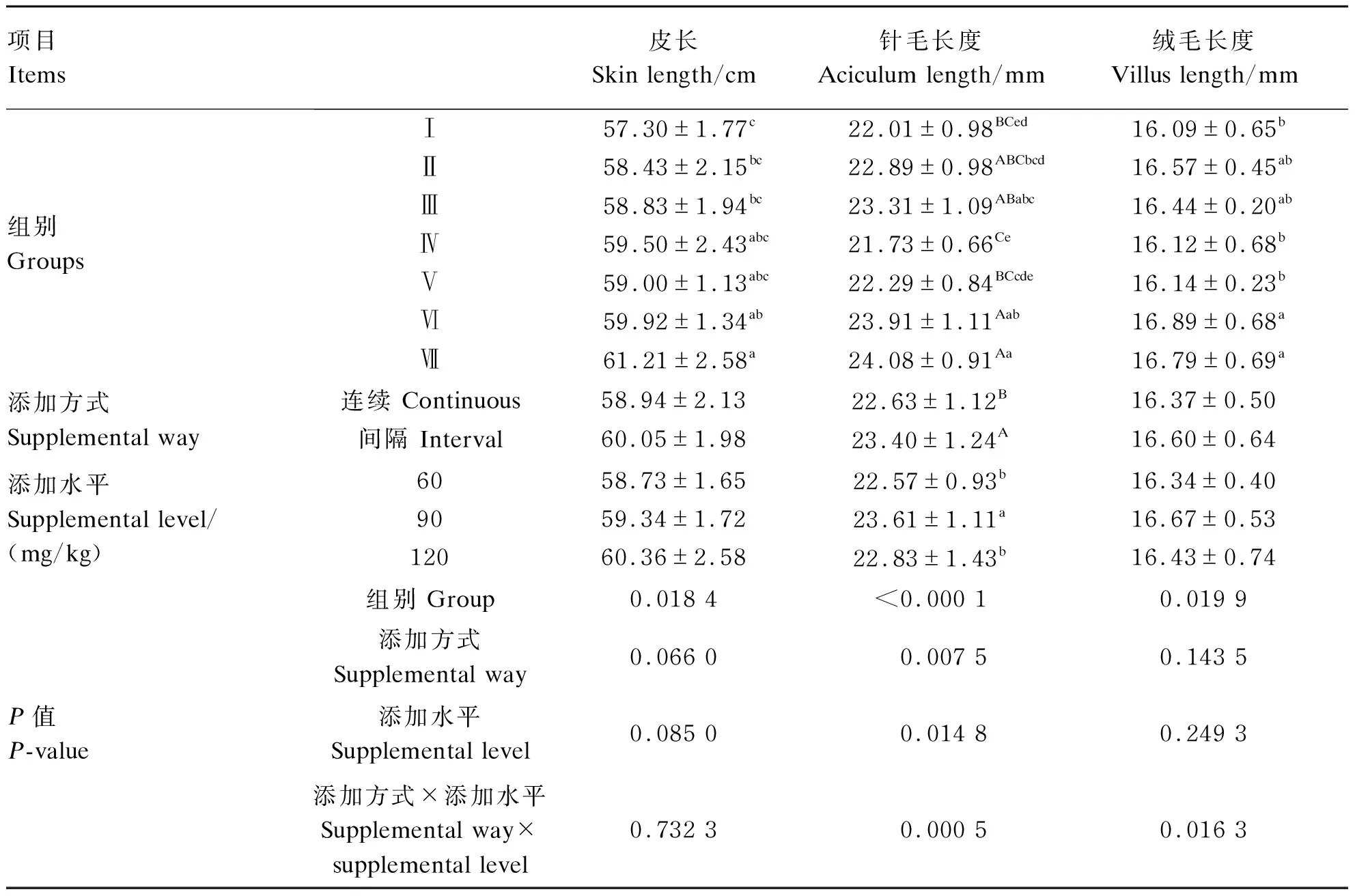
表3 CSH对冬毛期雄性水貂毛皮品质的影响
同一项目同列数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。In the same item and column, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 CSH对冬毛期雄性水貂血清生化指标的影响
由表5可知,饲粮中添加CSH显著影响了水貂血清UN、TG含量(P<0.05)。其中,Ⅲ、Ⅴ、Ⅵ、Ⅶ组水貂血清UN含量极显著低于对照组(P<0.01),Ⅱ组显著低于对照组(P<0.05);Ⅱ、Ⅲ、Ⅵ组血清TG含量极显著低于对照组、Ⅳ组(P<0.01),Ⅴ、Ⅶ组显著低于对照组(P<0.05)。CSH添加方式极显著影响了水貂血清UN含量(P<0.01),间隔添加组血清UN含量极显著低于连续添加组(P<0.01)。CSH添加水平显著或极显著影响了水貂血清UN和TG含量(P<0.05或P<0.01),90 mg/kg添加组血清UN含量显著低于60和120 mg/kg添加组(P<0.05),90 mg/kg添加组血清TG含量极显著低于120 mg/kg添加组(P<0.01)。CSH添加方式和添加水平对水貂血清TG含量有显著交互作用(P<0.05)。
2.3 CSH对冬毛期雄性水貂血清激素指标的影响
由表6可知,饲粮中添加CSH显著或极显著影响了水貂血清GH、SS、GHR、IGF-Ⅰ含量(P<0.05或P<0.01)。其中,水貂血清GH含量随着CSH添加水平的升高先升高后降低,Ⅵ组显著高于对照组、Ⅳ组(P<0.05);Ⅱ、Ⅲ、Ⅵ组血清SS含量显著低于Ⅰ、Ⅳ组(P<0.05);Ⅱ、Ⅳ、Ⅶ组血清GHR含量显著高于对照组(P<0.05),Ⅲ、Ⅴ、Ⅵ组极显著高于对照组(P<0.01);Ⅱ、Ⅲ、Ⅴ、Ⅵ、Ⅶ组血清IGF-Ⅰ含量显著高于Ⅳ组(P<0.05)。CSH添加方式对水貂血清激素含量无显著影响(P>0.05)。CSH添加水平显著影响了水貂血清SS含量(P<0.05),90 mg/kg添加组显著低于120 mg/kg添加组。CSH添加方式和添加水平对水貂血清激素含量无显著交互作用(P>0.05)。

表4 CSH对冬毛期雄性水貂血清生化指标的影响

表5 CSH对冬毛期雄性水貂血清激素指标的影响

续表5项目Items生长激素GH生长抑素SS生长激素受体GHR胰岛素样生长因子-ⅠIGF-Ⅰ 胰岛素样生长因子-Ⅰ受体IGF-ⅠR三碘甲腺原氨酸T3甲状腺素T4添加方式Supplemental way连续Continuous0.97±0.0838.45±6.854.88±0.6778.38±9.096.64±0.69 0.65±0.15 21.40±3.68间隔Interval1.03±0.1138.38±4.135.01±0.6983.53±5.487.22±0.960.69±0.1021.65±3.45添加水平Supplemental level/(mg/kg)601.01±0.1438.34±6.00ab4.96±0.8583.45±8.927.20±1.170.69±0.1421.98±3.81901.06±0.0834.89±2.42b5.27±0.2184.05±3.167.08±0.360.67±0.1121.13±3.451200.96±0.0441.18±5.07a4.71±0.6777.26±7.336.67±0.860.66±0.1321.46±3.48P值P-value组别 Group0.017 60.012 10.006 10.033 70.325 60.924 20.941 8添加方式Supplemental way0.119 10.649 70.733 20.120 40.104 20.455 20.873 8添加水平Supplemental level0.102 60.017 70.187 90.065 00.500 50.949 30.750 4添加方式×添加水平 Supplemental way×supplemental level0.894 60.317 50.996 80.351 80.947 90.653 70.652 6
2.4 CSH对冬毛期雄性水貂肝脏IGF-Ⅰ、IGF-ⅠR和GHR基因表达量的影响
由表7可知,饲粮中添加CSH显著或极显著影响了水貂肝脏IGF-Ⅰ、IGF-ⅠR和GHR基因表达量(P<0.05或P<0.01)。其中,以Ⅵ组水貂肝脏IGF-Ⅰ、IGF-ⅠR和GHR基因表达量最高,Ⅵ组肝脏IGF-Ⅰ基因表达量显著高于Ⅰ、Ⅱ、Ⅳ、Ⅴ组(P<0.05),与其他各组差异不显著(P>0.05);Ⅵ组肝脏IGF-ⅠR基因表达量显著高于Ⅱ、Ⅳ、Ⅴ组(P<0.05),与其他各组差异不显著(P>0.05);Ⅳ、Ⅴ组肝脏GHR基因表达量显著高于对照组(P<0.05),Ⅱ、Ⅲ、Ⅵ、Ⅶ组肝脏GHR基因表达量极显著高于对照组(P<0.01)。CSH添加方式极显著影响了水貂肝脏IGF-ⅠR基因表达量(P<0.01),间隔添加组肝脏IGF-ⅠR基因表达量极显著高于连续添加组(P<0.01)。CSH添加水平显著或极显著影响了水貂肝脏IGF-Ⅰ、IGF-ⅠR基因表达量(P<0.05或P<0.01),随着CSH添加水平的提高,肝脏IGF-Ⅰ、IGF-ⅠR基因表达量先升高后降低,90 mg/kg添加组肝脏IGF-Ⅰ和IGF-ⅠR基因表达量显著或极显著高于60和120 mg/kg添加组(P<0.05或P<0.01)。CSH添加水平和添加方式对水貂肝脏IGF-Ⅰ、IGF-ⅠR和GHR基因表达量无显著交互作用(P>0.05)。
3 讨 论
3.1 CSH对冬毛期水貂毛皮品质的影响
冬毛期水貂以毛皮生长发育为主,度过了骨骼快速生长期,主要是肌肉的生长和脂肪的沉积,毛皮品质是评价冬毛期水貂生产性能的直接指标,本试验对冬毛期末水貂皮长、针毛长度和绒毛长度做了检测,结果发现, CSH添加组水貂皮长、针毛长度和绒毛长度均有所增加,以Ⅵ、Ⅶ组添加效果最好,间隔添加组针毛长度较连续添加组提高了3.4%;不同添加水平之间以90 mg/kg添加组最佳;CSH对水貂毛皮品质有一定的改善作用。黄继卓等[16]研究发现,饲粮中添加CSH提高了东北细毛羊生产性能,降低了料重比,其中羊毛长度较对照组提高了9.1%,细度提高了6.2%,弹力也有所提高,且随着CSH添加水平的升高先增加后降低。徐军等[17]研究发现,饲粮中间隔添加CSH使辽宁绒山羊绒和毛的自然长度分别提高了32.2%和34.8%,毛细度提高了6.56%,绒细度降低了6.22%。白世平等[11]研究发现,饲粮连续添加CSH提高了冬毛期雄性水貂皮长和皮重,皮重提高了23%。综上所述,饲粮中添加CSH可以改善动物毛皮品质,这可能与CSH分子内部的活性巯基有关。影响毛皮质量的因素很多,硫的供给成为毛角蛋白合成的限制性因素,无论有机硫或无机硫对毛皮品质都有一定的促进作用[18]。CSH不仅为机体提供硫元素,还参与机体内分泌调节,改善营养物质分配,综合作用可能提高水貂生产性能,具体机制有待进一步研究。

表6 CSH对冬毛期雄性水貂肝脏IGF-Ⅰ、IGF-ⅠR和GHR基因表达量的影响
3.2 CSH对冬毛期水貂血清生化和激素指标的影响
蛋白质是血液中固体成分最多的一类物质,具有运输营养物质和调节被运输物质生理功能、调节机体免疫力等作用,对其含量的分析有助于了解机体营养状况和免疫机能[19]。本试验中,CSH添加组水貂血清含量显著高于对照组,饲粮中添加CSH对血清ALB和GLO含量无显著影响,间隔添加组血清TP和GLO含量高于连续添加组。UN是反映机体蛋白质分解的重要指标,哺乳动物氮排泄的主要形式,与氮的利用率呈负相关[20]。本试验中,CSH添加组血清UN含量低于对照组,说明CSH提高了冬毛期水貂氮沉积,这与氮代谢研究结果一致[21]。冬毛期水貂体重已达到成熟,处于维持体重阶段,但毛皮发育尤其针毛和绒毛的生长处于活跃阶段,且蛋白质是影响毛皮生长的主要因素。血清含量的升高有助于提高机体营养物质运转,促进蛋白质沉积,提高机体免疫力,进而促进毛皮的生长。
饲粮中添加CSH显著降低了冬毛期雄性水貂血清TG含量,且随着CSH添加水平的增加先降低后升高,血清CHO含量无显著变化。肝脏是血清TG合成的主要来源,高脂血症是脂肪病变的主要致病因素之一[22]。本试验中,饲粮中添加CSH降低了水貂血清TG含量,说明其对肝脏有一定的保护作用。冬毛期水貂以毛皮生长和越冬脂肪沉积为主,动物从饲粮中获取的脂肪多沉积到皮下脂肪组织中,CSH添加组血清TG含量的降低说明其减少脂肪组织中的脂肪动员,相应促进脂肪沉积。血清生化指标反映整个动物机体的代谢状况,受多种因素的影响,CSH对动物机体的影响主要基于其对内分泌的调节,进而引起相关的生理变化,所以血清蛋白质和血脂含量的改变可能与CSH改变激素分泌状况有关,具体原因还有待进一步分析。
本试验结果表明,饲粮中添加CSH提高了冬毛期雄性水貂血清GH、GHR和IGF-Ⅰ含量,降低了血清SS含量,间隔添加组显著提高了血清GH含量,降低了血清SS含量,以90 mg/kg添加水平最佳。这说明饲粮中添加CSH对冬毛期水貂促生长类激素的分泌依然有一定的促进作用,尤其对IGF-Ⅰ的分泌影响较大。SS具有抑制GH、IGF-Ⅰ、促甲状腺素及相关激素分泌的生理作用,同时对胃肠消化酶的分泌及活性也有一定抑制作用,进而抑制动物的生长发育[23-25]。动物的毛囊发育受多种生长因子的调控,IGF-Ⅰ对毛囊发育有着十分重要的意义[26]。饲粮中添加CSH提高了血清IGF-Ⅰ含量,说明饲粮中添加CSH可以促进水貂冬毛期水貂毛皮的生长发育。
3.3 CSH对冬毛期雄性水貂肝脏IGF-Ⅰ、IGF-ⅠR和GHR基因表达量的影响
动物的生长受GH-胰岛素样生长因子(IGFs)生长轴的调控,主要包括垂体释放的GH以及靶器官如肝脏分泌的IGFs。本试验研究了CSH对水貂生长轴相关基因表达量的影响,结果显示,饲粮中添加CSH提高了水貂肝脏IGF-Ⅰ、IGF-ⅠR和GHR基因表达量,间隔添加效果均优于连续添加,且随着CSH添加水平的增加先升高后降低。Li等[27]研究表明,饲粮连续添加CSH提高了石斑鱼垂体GH和肝脏GHR的基因表达量,且随着CSH添加水平的增加先升高后降低。马细兰等[28]研究发现,给尼罗罗非鱼腹腔注射100 μg/g的CSH,垂体GH基因表达量显著升高,同时肝脏GHR和IGF-Ⅰ基因表达量也显著上升。任道平等[29]研究报道,饲粮中添加CSH提高了东北细毛羊肝脏、肌肉和皮肤中IGF-Ⅰ基因表达量,随着CSH添加水平的升高有所降低。综上所述,饲粮中添加CSH可以提高生长轴相关基因的表达量,但当CSH添加水平达到一定程度时,相关基因表达量有所下降,这表明CSH在生产中具有一定的剂量依赖性。饲粮中添加CSH对冬毛期水貂毛皮品质有所改善,血清促生长类激素含量也有所升高,这与本试验关于生长轴基因表达量的结果相呼应。综合说明,饲粮中添加CSH通过调节机体内分泌系统,提高生长轴相关基因表达量,进而改善动物的毛皮生产性能,但作用中有一定的剂量-时间依赖效应。
本试验结果表明,间隔添加的效果优于连续添加,连续添加CSH能引起动物胃溃疡。CSH促生长的机理主要是抑制SS的分泌,然而SS对于应激和CSH等引起的胃损伤有明显的保护作用,应激和CSH性溃疡的特征是胃酸和胃蛋白酶分泌增加[30-32]。
4 结 论
① 饲粮中添加CSH能够提高冬毛期雄性水貂的毛皮品质,降低血清UN含量,提高促生长类激素含量。
② 综合各项指标,在本试验条件下,冬毛期雄性水貂饲粮中CSH的适宜添加水平为90 mg/kg,适宜添加方式为间隔添加。

