奥美拉唑及乌司他丁联合大剂量奥曲肽治疗重症急性胰腺炎临床评价
刘敏星,陆士奇,陈国林,吴 云
(苏州大学附属第一医院急诊科,江苏 苏州 215000)
重症急性胰腺炎(SAP)为临床常见急腹症,占急性胰腺炎(AP)的5% ~10%,具有起病急、发展快、病死率高等特点,多由胆源性疾病、饮酒过度、高脂血症、胰腺肿瘤及免疫系统病变引起,病情进展与多器官功能衰竭和全身炎性反应综合征(SIRS)密切相关[1-3]。近年来,AP的死亡率和并发症发生率均明显下降,但SAP则不然[4]。目前,临床多采用联合用药治疗SAP,疗效良好。奥美拉唑能保护胰腺细胞,减轻胰腺炎症状[5];奥曲肽具有抑制胰腺分泌,阻碍炎性递质释放与细胞因子生成,促进胃肠道及胰腺功能的恢复的作用[6];乌司他丁能抑制多种胰酶的生物活性,降低体内炎性因子水平,促进胃肠功能恢复[7]。本研究中采用奥美拉唑、乌司他丁联合大剂量奥曲肽治疗SAP,临床疗效较好,现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合2013年亚特兰大修订版AP分类的SAP诊断标准,有脏器功能障碍,且持续性器官功能衰竭>48 h[8];急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分不小于8分,Balthazar CT分级不小于Ⅱ级[1];腹部影像学检查显示胰腺有特征性改变;病程≤72h;年龄18~65岁;患者自愿参加本试验,并签署知情同意书;本研究经医院医学伦理委员会批准后实施。
排除标准:严重心、肝、肾、肺等器官疾病;有明显的外科手术指征;恶性肿瘤或其他全身性炎症疾病;近期准备妊娠,妊娠期或哺乳期;对本研究中拟用药物过敏。
病例选择与分组:选取医院2015年8月至2017年11月收治的SAP患者83例,按随机数字表法分为对照组(41例)和联用组(42例)。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
1.2 方法
两组患者均给予常规治疗,实行风险评估以协助分诊,并予重症监护、禁食、补充体液、纠正水电解质紊乱、镇痛、吸氧、营养支持、胃肠减压及预防性使用抗生素等。对照组患者在常规治疗基础上将注射用奥美拉唑钠(重庆华森制药有限公司,国药准字H20163061,规格为每支40 mg)40 mg溶于0.9%氯化钠注射液100 mL持续静脉滴注20 min以上,40 mg/d,以及醋酸奥曲肽注射液(商品名依普比善,北京四环制药有限公司,国药准字 H20040406,规格为每支 1 mL ∶0.3 mg)0.6 mg 溶于0.9%氯化钠注射液50 mL,采用静脉微量泵以25 μg/h的速率持续泵入,连续用药7 d。联用组患者在常规治疗基础上给予注射用奥美拉唑钠(厂家、规格、用法同对照组);乌司他丁注射液(商品名天普洛安,广东天普生化医药股份有限公司,国药准字H20040506,规格为每支2 mL∶10万U)50万U,溶于0.9%氯化钠注射液500 mL静脉滴注,2次/日;醋酸奥曲肽注射液(厂家、规格同对照组),1.2 mg溶解于 0.9% 氯化钠注射液 50 mL,以50 μg/h的速率经静脉微量泵持续泵入,每日1次,用药4 d,再以0.6 mg溶于0.9%氯化钠注射液50 mL,以25 μg/h的速率经静脉微量泵持续泵入,每日1次,用药3 d。
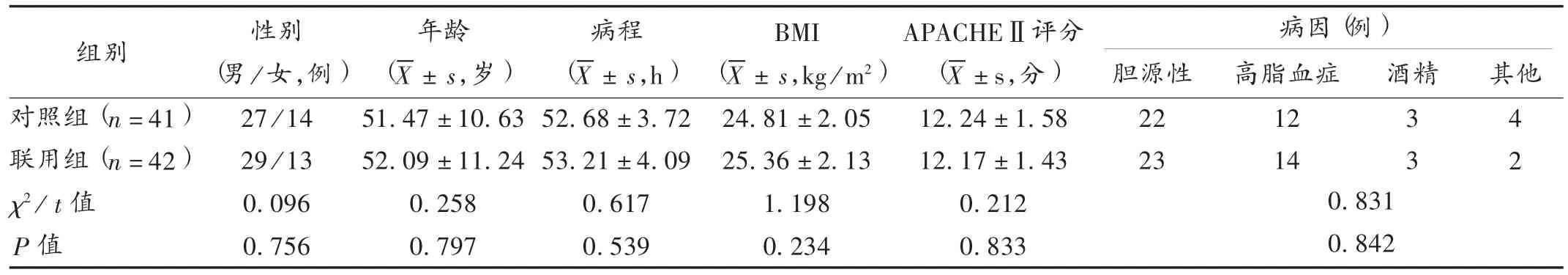
表1 两组患者一般资料比较
1.3 观察指标与疗效判定标准
观察指标:常规生化指标,包括血清淀粉酶(AMY)、尿淀粉酶(UAMY)、白细胞计数(WBC)、前白蛋白(PA)及白蛋白(ALB)水平;血清炎性因子,包括肿瘤坏死因子 -α(TNF-α)、超敏 C 反应蛋白(hs-CRP)、白细胞介素 6(IL-6)、白细胞介素 1β(IL-1β)及白细胞介素10(IL-10)水平;血清生物标志物,包括中期因子(MK)、中性粒细胞明胶酶相关载脂蛋白(NGAL)、髓过氧化物酶(MPO)、可溶性髓样细胞触发受体 -1(sTRAM-1)及和肽素(copeptin)水平;APACHEⅡ评分、改良Marshall评分、CT严重度指数(CTSI)评分、全身炎性反应综合征(SIRS)评分及床旁严重度指数(BISAP)评分;临床症状,如腹痛、腹胀、体温异常、恶心呕吐及首次排便的改善情况。
疗效判定[9]:显效,临床症状体征全部消失,血尿淀粉酶、血常规等生化指标均恢复正常;有效,临床症状体征有所改善,血尿淀粉酶、血常规等生化指标均明显降低;无效,临床症状体征未见改善或甚至恶化,血尿淀粉酶、血常规等生化指标无显著降低。总有效=显效+有效。
1.4 统计学处理
2 结果
结果见表2至表8。两组患者治疗期间发生的不良反应均能自行缓解,未影响治疗,均无严重不良反应发生。

表2 两组患者临床疗效比较[例(%)]
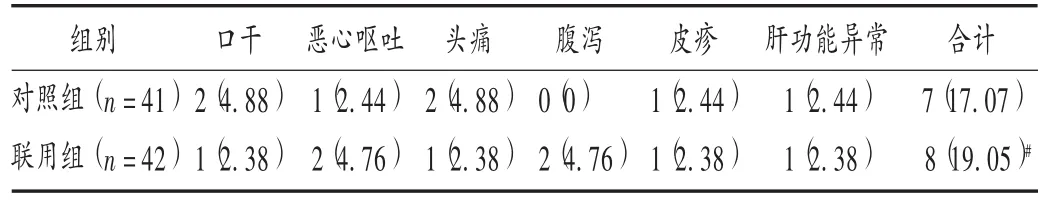
表3 两组患者不良反应发生情况比较[例(%)]
表4 两组患者治疗前后常规生化指标水平比较(±s)

表4 两组患者治疗前后常规生化指标水平比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。表5至表7同。
组别对照组(n=41)联用组(n=42)时间治疗前治疗后治疗前治疗后AMY(U /L)927.62 ± 103.58 232.57 ± 42.63*931.21 ± 107.43 142.43 ± 35.17*#UAMY(U /L)3 176.84 ± 481.26 1 247.38 ± 195.18*3 214.52 ± 503.79 735.73 ± 146.53*#WBC (×109/L)18.63 ± 2.79 9.37 ± 1.30*18.77 ± 2.64 6.82 ± 1.15*#PA(mg /L)159.64 ± 12.35 248.82 ± 17.40*161.47 ± 14.21 294.56 ± 20.73*#ALB (g/L)27.28 ± 3.45 32.63 ± 4.14*28.35 ± 3.62 36.68 ± 4.78*#
表5 两组患者治疗前后血清炎性因子水平比较(±s)

表5 两组患者治疗前后血清炎性因子水平比较(±s)
组别对照组(n=41)联用组(n=42)时间治疗前治疗后治疗前治疗后TNF- α(ng /L)93.52 ± 12.43 67.09 ± 10.54*95.81 ± 14.26 51.27 ± 9.68*#IL-10 (ng/L)47.69 ± 7.13 73.28 ± 9.46*46.85 ± 7.28 84.51 ± 10.27*#hs-CRP (mg/L)101.37 ± 12.59 47.96 ± 8.23*103.18 ± 11.94 28.34 ± 6.72*#IL-6 (ng/L)119.45 ± 16.27 58.29 ± 9.59*122.18 ± 15.84 37.64 ± 8.04*#IL-1β (ng/L)41.74 ± 5.81 24.85 ± 3.97*42.35 ± 5.69 17.43 ± 3.32*#
表6 两组患者治疗前后的血清生物标志物水平比较(±s)
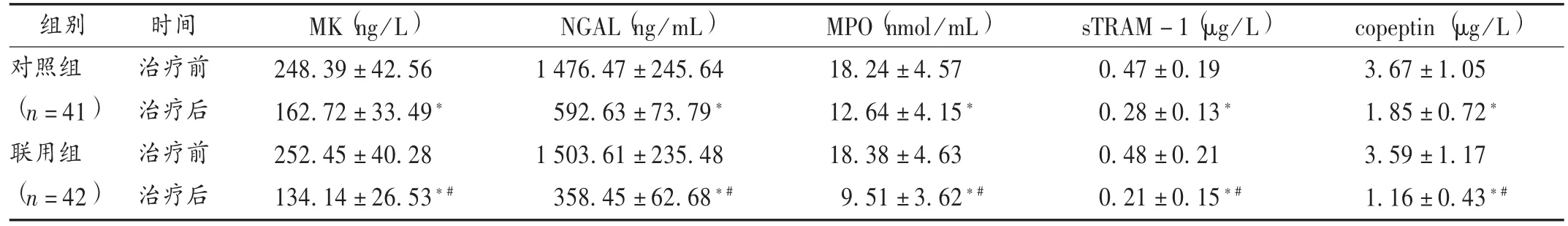
表6 两组患者治疗前后的血清生物标志物水平比较(±s)
组别对照组(n=41)联用组(n=42)时间治疗前治疗后治疗前治疗后MK(ng/L)248.39 ± 42.56 162.72 ± 33.49*252.45 ± 40.28 134.14 ± 26.53*#NGAL(ng /mL)1 476.47 ±245.64 592.63 ±73.79*1 503.61 ±235.48 358.45 ±62.68*#MPO(nmol/mL)18.24 ±4.57 12.64 ±4.15*18.38 ±4.63 9.51 ±3.62*#sTRAM-1(μg/L)0.47 ± 0.19 0.28 ± 0.13*0.48 ± 0.21 0.21 ± 0.15*#copeptin (μg/L)3.67 ± 1.05 1.85 ± 0.72*3.59 ± 1.17 1.16 ± 0.43*#
表7 两组患者各项评分比较(±s,分)
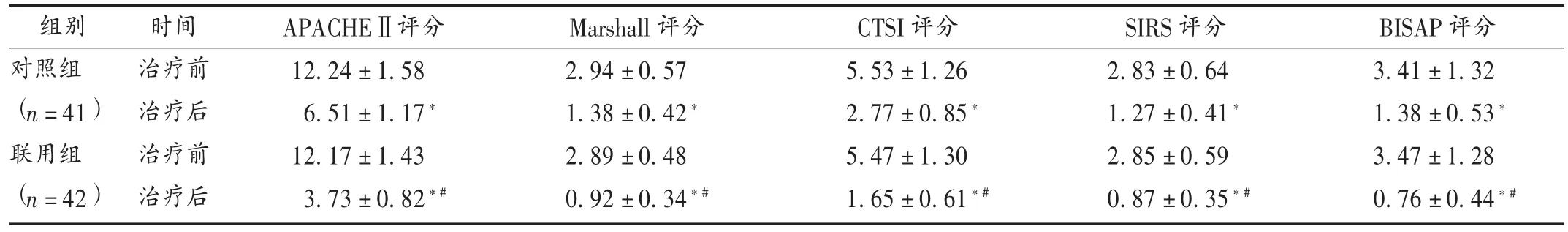
表7 两组患者各项评分比较(±s,分)
组别对照组(n=41)联用组(n=42)时间治疗前治疗后治疗前治疗后APACHEⅡ评分12.24 ±1.58 6.51 ±1.17*12.17 ±1.43 3.73 ±0.82*#Marshall评分2.94 ± 0.57 1.38 ± 0.42*2.89 ± 0.48 0.92 ± 0.34*#CTSI评分5.53 ± 1.26 2.77 ± 0.85*5.47 ± 1.30 1.65 ± 0.61*#SIRS评分2.83 ± 0.64 1.27 ± 0.41*2.85 ± 0.59 0.87 ± 0.35*#BISAP评分3.41 ±1.32 1.38 ±0.53*3.47 ±1.28 0.76 ±0.44*#
表8 两组患者临床症状体征改善时间比较(±s,d)

表8 两组患者临床症状体征改善时间比较(±s,d)
注:与对照组比较,#P <0.05。
组别对照组(n=41)联用组(n=42)首次排便3.73 ± 0.64 2.15 ±0.39#腹痛4.78 ± 0.59 3.25 ±0.54#腹胀5.42 ± 0.87 4.06 ±0.58#体温异常5.61 ± 0.92 2.83 ±0.49#恶心呕吐3.78 ±0.53 2.59 ± 0.46#
3 讨论
AP的重要病因有胆结石、酒精、肥胖及糖尿病等[10]。随着我国人民生活水平的提高及饮食结构的调整,AP发病率不断增加,而SAP的发病率也随之增加,且SAP并发症发生率及死亡率均较高。
奥美拉唑是质子泵抑制剂,具有良好的抑酸作用,能通过与H+,K+-ATP酶特异性结合来抑制其活性,继而有效抑制胰液分泌,从而减轻炎性反应与胰腺组织的坏死,治疗SAP的疗效与安全性均良好[11]。奥曲肽是生长抑素类似物,可有效抑制胰液的分泌和降低胰管内压等作用,是目前临床治疗SAP的常用药物。乌司他丁作为蛋白酶抑制剂,可广泛抑制与SAP病情进展有关的胰蛋白酶、弹性蛋白酶、磷脂酶A等的释放和活性,改善胰腺微循环,从而减少并发症的发生[12]。
Li等[13]研究发现,MK是AP临床研究的有用指标,且MK浓度与AP严重程度呈正相关。黄星等[14]研究发现,AP患者体内NGAL参与AP的发生、发展,激活NF-κB通路、促进炎性反应等机制。刘迎迎等[15]研究发现,血清MPO水平与血清细胞因子水平和AP的严重程度呈正相关。林波等[16]研究发现,AP患者体内sTREM-1的浓度变化与AP的病情严重程度有关,能预测AP的病情变化。Sang等[17]研究发现,体内和肽素水平的增加与SAP的严重程度密切相关,可成为SAP评价局部并发症、器官功能衰竭和死亡率新的预后指标。
本研究结果显示,联用组总有效率显著高于对照组(P<0.05);联用组患者治疗后的常规生化指标、血清炎性因子和血清生物标志物水平均显著优于对照组(P<0.05),表明联用组治疗方案可显著改善患者体内的相关生化指标水平;联用组患者治疗后的APACHEⅡ,Marshall,CTSI,SIRS,BISAP 等评分显著低于对照组,腹痛、腹胀、体温异常、恶心呕吐改善时间及首次排便时间显著短于对照组(P<0.05),表明联用组治疗方案能显著改善患者的症状与预后;两组患者治疗期间均无严重的肝、肾功能损害等不良反应发生,轻微不良反应的发生率亦无显著差异(P<0.05)。
综上所述,奥美拉唑、乌司他丁联合大剂量奥曲肽治疗SAP,能显著提高临床疗效,显著改善SAP患者的临床症状及体征,调节相关血清炎性因子及生物标志物水平,且安全性较好,具有一定的临床应用价值。

