银杏叶提取物对放射性损伤耳蜗毛细胞株HEI-OC1增殖、凋亡及Survivin、Bax表达的影响
马 敬,郭金宝,钱俊勇,仇继兵
(江苏省常州市第三人民医院,江苏 常州 213001)
放射性治疗所致听力神经损伤是头颈部肿瘤放射性治疗后最常见的不良反应之一[1],其发病率高,且目前临床尚无特效治疗药,严重影响患者生活质量。银杏叶提取物(EGB)主要有效成分为银杏萜内酯类化合物和银杏黄酮类[2],因其具有生物利用度高、毒性弱、治疗多靶点、疗效显著、代谢完全等优点,现已广泛应用于恶性肿瘤的预防及治疗方面[3]。研究表明,EGB可明显减轻鼻咽癌患者放射性治疗期间内耳损伤程度,推测EGB具有防护放射线对中耳损伤的作用,但其作用机制尚未阐明[4]。目前,国内外尚少见EGB对放射性损伤耳蜗毛细胞株HEI-OC1影响的研究。基于此,本研究探讨了EGB761对放射性损伤耳蜗毛细胞株HEI-OC1增殖、凋亡及细胞存活素(Survivin)、Bcl-2家族前凋亡蛋白(Bax)表达的影响,旨在为EGB应用于临床放射性听力神经损伤治疗提供一定理论参考。
1 实验资料
1.1材料
1.1.1细胞株 耳蜗毛细胞株HEI-OC1,由美国豪斯耳研究所提供。
1.1.2主要试剂与仪器 EGB761,购于德国威玛舒培博士药厂,生产批号1710711;高糖DMEM培养基,购于杭州吉诺生物医药技术有限公司;胎牛血清,购自杭州四季青公司;二甲基亚砜(DMSO)、噻唑蓝(MTT),购于美国Sigma公司;细胞周期及凋亡检测试剂盒,购于碧云天生物研究所;琼脂糖,购于法国Biowest公司;Trizol、反转录试剂盒、SYBR PrimeScript RT-PCR Kit,购于日本TaKaRa公司;CO2培养箱,购于美国Thermo Fisher公司;FACSCalibur流式细胞仪,购于美国BD公司;紫外分光光度计,购于美国Beckman公司;qRT-PCR仪ABI7700,购于美国ABI公司。
1.2方法
1.2.1细胞培养 将耳蜗毛细胞株HEI-OC1细胞接种于含体积百分数10%胎牛血清高糖DMEM培养基中,置于10% CO2培养箱中33 ℃传代培养,整个过程中均未添加任何抗生素,以免影响耳蜗毛细胞株HEI-OC1细胞生物学特性。
1.2.2细胞照射与分组处理 取对数生长期HEI-OC1细胞进行试验研究,分别设置正常对照组、放射性损伤组及10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干预组。除正常对照组为正常未经照射处理细胞,其他各组对数生长期细胞均进行照射处理,放射源VARIAN 2300EX直线加速器6 MV X线,100 cm源皮距,照射剂量率4 Gy/min,照射剂量20 Gy。干预组分别加入含有相应浓度EGB761的培养基,正常对照组、放射性损伤组给予等体积DMSO作为对照。
1.2.3HEI-OC1细胞增殖能力检测 采用MTT实验检测HEI-OC1细胞增殖能力,消化计数,调整细胞浓度,按1.0×105个/mL接种于96孔板,分别于24 h、48 h、72 h、96 h加入20 μL浓度为5 g/L的MTT,继续孵育4 h,离心去上清,每孔加入200 μL DMSO终止反应,震荡10 min后,采用酶联免疫分析仪,于波长570 nm处测定样本吸光度,以时间为横坐标,吸光度为纵坐标,绘制生长曲线。
1.2.4HEI-OC1细胞凋亡率检测 采用胰酶消化制成HEI-OC1细胞悬浮液,离心并收集细胞,采用PBS洗涤液洗涤HEI-OC1细胞,利用流式细胞仪(FCM),按照标准程序检测HEI-OC1细胞凋亡率,具体操作严格按照仪器及试剂盒使用说明书进行。
1.2.5Survivin、Bax表达水平检测 收集各组细胞,经PBS液洗涤后,采用Trizol法分别提取HEI-OC1细胞总RNA,所提RNA无DNA、蛋白质残留,纯度较高。利用反转录试剂盒进行反转录操作,所得cDNA用以作为qRT-PCR反应模板。qRT-PCR反应选用SYBR PrimeScript RT-PCR Kit定量扩增体系,反应总体积10 μL:cDNA 0.8 μL,SYBR Primix Ex Taq 5 μL,引物1.2 μL,RNase H2O 1.8 μL。反应条件为:94 ℃预变性5 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 60 s,扩增30个循环。以β-action为内参,每个样品设置3个复孔,结果采用2-ΔΔCT方法处理,其中ΔΔCT=(CT目的基因-CTβ-action)观察组-(CT目的基因-CTβ-action)对照组。引物见表1。

表1 qRT-PCR 扩增引物序列

2 结 果
2.1各组HEI-OC1细胞增殖比较 与正常对照组比较,放射性损伤组HEI-OC1细胞增殖能力明显下降(P<0.05);与放射性损伤组比较,10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干预组HEI-OC1细胞增殖能力明显上升(P均<0.05),且呈一定剂量依赖性。见图1。
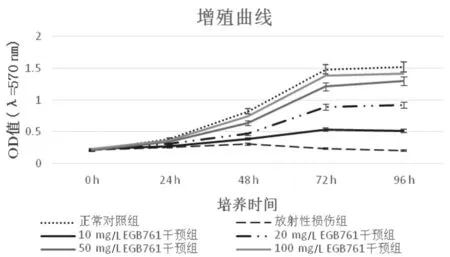
图1 各组HEI-OC1细胞增殖能力比较
2.2各组HEI-OC1细胞凋亡率比较 正常对照组、放射性损伤组以及10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干预组HEI-OC1细胞凋亡率分别为(2.62±0.23)%,(9.06±0.37)%,(7.45±0.32)%,(5.29±0.28)%,(4.17±0.33)%和(2.93±0.24)%。与正常对照组比较,放射性损伤组HEI-OC1细胞凋亡率明显增加(P<0.05);与放射性损伤组比较,10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干预组HEI-OC1细胞凋亡率均明显降低(P均<0.05),且呈一定剂量依赖性。
2.3各组HEI-OC1细胞中Survivin、Bax表达水平比较 与正常对照组比较,放射性损伤组HEI-OC1细胞中Survivin表达水平明显下降(P<0.05),Bax表达水平明显升高(P<0.05);与放射性损伤组比较,10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干预组HEI-OC1细胞中Survivin表达水平明显升高(P均<0.05),Bax表达水平明显下降(P均<0.05),且呈一定剂量依赖性。见图2及图3。
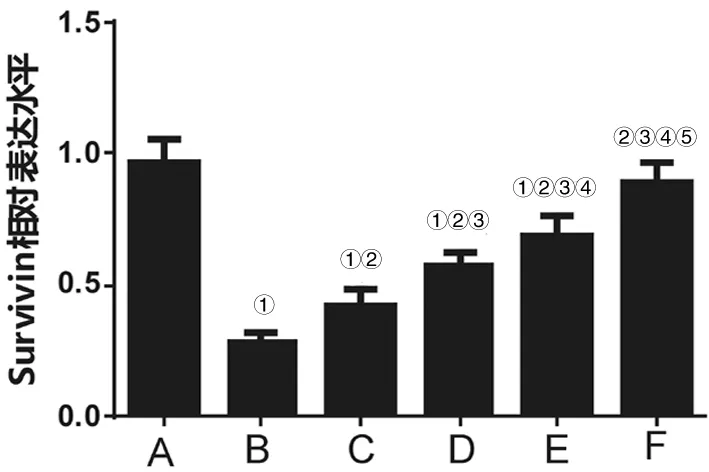
注:A、B、C、D、E、F分别代表正常对照组、放射性损伤组和10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干预组;①与A组比较,P<0.05;②与B组比较,P<0.05;③与C组比较,P<0.05;④与D组比较,P<0.05;⑤与E组比较,P<0.05。
图2 各组HEI-OC1细胞中Survivin表达水平比较
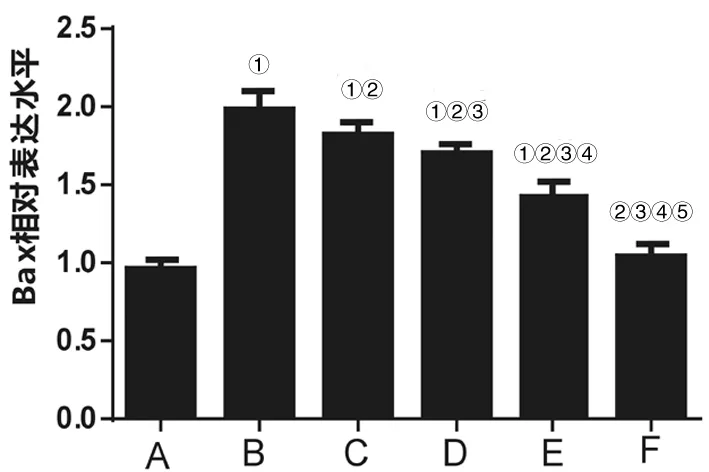
注:A、B、C、D、E、F分别代表正常对照组、放射性损伤组和10 mg/L、20 mg/L、50 mg/L、100 mg/L EGB761干预组;①与A组比较,P<0.05;②与B比较,P<0.05;③与C组比较,P<0.05;④与D组比较,P<0.05;⑤与E组比较,P<0.05。
图3 各组HEI-OC1细胞中Bax表达水平比较
3 讨 论
放射性治疗是临床上治疗头颈部肿瘤的常用手段,尤其是鼻咽癌患者,放射性治疗是其根治性治疗的唯一手段[5]。放射物理学技术及放射生物学等技术的不断发展,使得头颈部肿瘤患者生存率有了明显提高,但在鼻咽癌放射治疗过程中,耳部各个部分几乎全部暴露于放射视野内,导致耳道炎、慢性化脓性中耳炎、分泌性中耳炎、颞骨坏死等多种耳部并发症发生[6-8]。因此,放射性治疗后肿瘤患者生存质量受到广泛关注,在放疗过程中如何防护放射线对耳部正常部位损伤,是目前临床亟待解决的关键性问题。
近年来,中药以其安全性高、治疗多靶点、毒性小的优点在抗癌临床上得到了广泛应用[9],发掘新的有效中药活性成分是目前疾病治疗的潜在策略。EGB761是目前我国临床上使用最为广泛的中药材提取物之一,其主要有效成分为银杏萜内酯类化合物和银杏黄酮类[10],国内外学者对其化学成分及其药理作用进行广泛研究,证实其具有抗炎、保护缺血损伤、调血脂、扩张血管、抗肿瘤以及拮抗血小板活化因子等重要药理作用[11-13],在临床心脑血管、肿瘤等多种疾病治疗方面疗效确切。施雨露等[14]研究结果显示,EGB可明显降低X射线照射小鼠骨髓细胞染色体畸变率,发挥抗辐射作用。姜梁等[15]研究结果表明,EGB可通过扩张耳部血管,中和及清除机体自由基,减少脂质过氧化作用,从而减少豚鼠中耳早期放射性损伤,且EGB不良反应少,性质稳定,推荐临床鼻咽癌等头颈部肿瘤患者放疗时使用。基于此,本研究探讨了EGB761对放射性损伤耳蜗毛细胞株HEI-OC1增殖、凋亡及Survivin、Bax表达的影响,旨在为EGB应用于临床放射性听力神经损伤治疗提供更为可靠的理论参考依据。
本研究MTT实验结果显示,与正常对照组比较,放射性损伤组HEI-OC1细胞增殖能力明显下降;与放射性损伤组比较,EGB761干预组HEI-OC1细胞增殖能力明显上升,且呈一定剂量依赖性。说明20 Gy照射剂量明显降低HEI-OC1细胞增殖能力,经不同剂量EGB761干预后HEI-OC1细胞增殖能力明显上升,提示EGB761可明显逆转照射所致HEI-OC1细胞增殖能力下降,发挥防辐射作用。FCM实验结果显示,与正常对照组比较,放射性损伤组HEI-OC1细胞凋亡率明显增加;与放射性损伤组比较,EGB761干预组HEI-OC1细胞凋亡率明显降低。提示EGB761可逆转辐射损伤所致HEI-OC1细胞凋亡,提高HEI-OC1细胞存活率。宋媛媛等[16]研究结果显示,EGB可明显拮抗辐射所致大鼠骨髓间充质干细胞存活率降低,减少细胞凋亡,进而减轻大鼠骨髓间充质干细胞辐射损伤,支持本研究观点。Survivin是近年来新发现的凋亡抑制基因[17],在细胞周期中可呈现周期依赖性表达,可在G2/M周期明显高表达,抑制细胞下游执行细胞凋亡相关基因Caspase-3及Caspase-7活化[18],从而有利于细胞增殖及分化。Bax为凋亡活化基因[19-20],是Bcl-2凋亡调节基因家族重要成员之一,可与Bcl-2基因共同调节线粒体凋亡过程[21-22]。qRT-PCR结果显示,与正常对照组比较,放射性损伤组HEI-OC1细胞中Survivin水平明显下降,Bax水平明显升高,经EGB761干预HEI-OC1细胞中Survivin水平明显升高,Bax水平明显下降,推测EGB761可通过上调Survivin基因表达,从而促进Survivin对Caspase-3活化,促进细胞增殖,另一方面下调Bax基因的表达,进一步抑制HEI-OC1细胞凋亡,从而发挥逆转HEI-OC1细胞放射性损伤作用。
综上所述,EGB761可明显促进HEI-OC1细胞增殖,抑制HEI-OC1细胞凋亡,推测其作用机制可能为上调凋亡抑制基因Survivin表达及下调凋亡促进基因Bax表达。本研究仍存在研究指标较少等不足之处,仅在细胞增殖及凋亡方面进行了实验研究,EGB761在逆转放射性损伤领域的临床应用价值,仍需进一步实验及临床研究充分验证。

