碱土金属碳酸盐催化乙醇胺-CO2反应机理研究
周云龙 崔立峰 史焕聪


摘要:
利用碱土金属碳酸盐(CaCO3)进行非均相催化乙醇胺(MEA)-CO2吸收试验。催化剂质量为0.0~25.0 g,吸收剂浓度分别为1.0,3.0 和5.0 M(mol/L)。在试验基础上,运用图解法开发MEA溶液吸收CO2动力学模型,验证催化剂的有效性。运用积分法处理试验数据,并对数据进行线性回归分析,得到适用于0,1,2级反应速率方程。经验证,在胺转化率XA<0.80时,MEA-CO2反应符合1级反应速率方程。通过简要评估CaCO3的催化效果,发现其可将2级非催化反应速率常数kZ提高至原来的1.1~1.8倍。因此,CaCO3是一种能够有效促进MEA-CO2相互作用的催化剂。
关键词:
反应动力学; 催化CO2吸收; 图解法; 非均相催化剂; 反应级数
中图分类号: X 511 文献标志码: A
Research on Reaction Mechanism of Alkaline Earth Metal
Carbonates Catalyzed Monoethanolamine-CO2
ZHOU Yunlong, CUI Lifeng, SHI Huancong
(School of Environment and Architecture, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:
Heterogeneous catalytic Monoethanolamine(MEA)-CO2 absorption was catalyzed by alkaline earth metal carbonates(CaCO3).The qualities of catalyst are from 0.0 to 25.0 g,and the absorbent concentrations are 1.0,3.0 and 5.0 M(mol/L),respectively.On the basis of experiments,the kinetic model for MEA solvents absorbing CO2 was developed by graphical method to verify the effectiveness of catalyst.The rate equations suitable for the 0,1,and 2 order reactions were obtained by using integral method to process data and subsequently linear regression analyzing.Its verified that the MEA-CO2 reaction coincides with the first-order reaction rate equation at XA<0.80.By briefly evaluating the catalytic effect of CaCO3,its found that the second-order non-catalytic rate constant kZ can be raised to 1.1-1.8 times as high as before.Therefore,CaCO3 is an effective catalyst for promoting the MEA-CO2 interaction.
Keywords:
reaction kinetics; catalytic CO2 absorption; graphical method; heterogeneous catalyst; reaction order
化学吸收法捕获CO2是燃料燃烧后尾气碳捕获的重要途径,其中以胺溶液吸收法最为常用。因而,进行胺-CO2溶液的反应动力学研究具有很大的意义[1-2]。自1968年以来,研究人员对胺-CO2的反应动力学进行了广泛的研究,包括动力学反应机理、动力学模型和动力学行为。
目前,关于动力学的研究方法有图解法[3]、基于反应机理的简化法[4-5]和综合数值模拟法[6-9]。通过图解法确定反应级数相对容易[4];基于反应机理的简化法着重于通过固有基本步骤,对主反应动力学进行研究[5];综合数值模拟法[7-9]由于包含所有反应的编程和模拟、化学平衡和传质模型,可以提供详细的數据库,因而得到的结果也最为准确。由于反应机理的简化法和综合数值模拟法涉及的反应过程较为复杂,且试验条件有限,因而本文选用图解法进行乙醇胺(MEA)-CO2动力学研究,确定MEA-CO2-H2O体系的反应级数,所验证的反应级数仅用于非均相催化MEA-CO2体系,可作为进一步分析动力学模型的研究基础。
1 试验装置与方法
以碱土金属的碳酸盐(CaCO3)作为催化剂,来提高MEA溶液对CO2的吸收效果。关于CaCO3已被证实能够有效催化加速MEA溶液对CO2的吸收。试验装置如图1所示,具体方法如下:
(1) 以MEA溶液为吸收剂,进行催化吸收试验;
(2) 以图解法为基础,用积分法确定反应级数;
(3) 分析曲线的斜率,确定反应速率方程r和催化反应速率常数KB。
图1 MEA-CO2吸收反应装置
Fig.1 Experimental apparatus for MEA-CO2
通过17组无偏差样本分析试验,最终确定MEA-CO2-H2O体系反应级数。试验中,MEA溶液浓度范围:1.0~5.0 M(mol/L);催化剂质量范围:0.0~25.0 g;CO2负载率范围:0.00~0.40(单位:mol/mol,可省略),即转化率0.00~0.80。实际试验中,MEA溶液浓度分别为1.0,3.0和5.0 M,所选用固体催化剂CaCO3的质量分别为5.0,10.0,15.0,20.0和25.0 g。试验中采用的吸收剂浓度及催化剂质量梯度依据Zwitterion机理(两性离子机理)和Termolecular机理(三分子机理)而设[10-11],因此对于更高浓度的MEA溶液(浓度>5.0 M,即负载率>0.40或转化率>0.80)没有进行相关试验。为了规避每组试验误差,统一规定胺转化率XA≤0.80。
试验结果表明:在催化剂作用下,MEA溶液吸收CO2达到饱和所需时间与非催化吸收过程相比,降低12%~30%。可见,CaCO3在去除烟气中的CO2工艺中具有很大的应用价值。
2 图解法动力学模型理论分析
2.1 OH-和固体碱
在碱土金属碳酸盐催化MEA 吸收CO2的研究中,两性离子机理和三分子机理均适用于MEA-CO2相互作用的过程[11-16]。对于MEA溶液而言,两性离子机理适用于MEA的拟一级反应[2],而三分子机理则更适用于高负载率的情况[10]。基于这两种机理,通过简化模型[7,9-10]得到了相关反应速率方程和反应速率常数[8,10]:
rCO2-R1R2NH=
kZ2,R1R2NH[R1R2NH][CO2]1+kZ-1kZ2,R1R2NH[R1R2NH]+kOH-[OH-]+kH2O[H2O]≈
kZ2,R1R2NH[R1R2NH][CO2]
(1)
kZ2,MEA=4.4×1011exp-5 400T
(2)
rCO2-R1R2NH=(kTR1R2NH[R1R2NH]+kOH-[OH-]+
kH2O[H2O])[R1R2NH][CO2]
(3)
kTMEA=4.6×109exp-4 412T
(4)
式中:r为反应速率方程;kZ2为两性离子机理下有机胺的二级反应速率常数;kT为三分子机理下有机胺的反应速率常数;kOH-为OH-的水解常数;kH2O为H2O的水解常数;[R1R2NH][OH-][H2O][CO2]为物质浓度。
通过两性离子机理可知,碱土金属碳酸盐可以作为Lewis碱,提供大量的OH-[7-9]。在OH-的催化作用下,促进氨基甲酸盐的形成。Lewis碱作用见表1。通过研究分析CaCO3的催化作用,验证了非均相催化氨基甲酸盐的形成这一概念[15]。
表1 氨基甲酸盐生成和分解的不同催化过程
Tab.1 Different catalytic process of carbamate
formation and breakdown
另外,Caplow等[12]的研究指出,OH-可以起到催化作用,进而促进氨基甲酸盐的形成。这一想法已通过利用15~20种伯胺和仲胺进行试验而得以证实。
r=kapp[CO2]=rZCO2-R1R2NH+r′OH-=
rZCO2-R1R2NH+k′OH-[OH-]
(5)
r=kamine[R2NH][CO2]+
k′amine[R2NH][OH-][CO2]
(6)
式中:r为反应速率方程;kapp为反应速率常数;k′OH-为OH-的水解常数;kamine和k′amine为胺反应速率常数;[R2NH][OH-][CO2]为物质浓度。
式(5)是非催化条件下的反应速率方程,而式(6)是OH-催化作用下的反应速率方程。与非均相条件相比,均相条件下MEA-CO2的相互作用也存在碱催化途径[8]。溶液中存在的OH-能促进CO2氨解[8]。式(5)中k′OH-[OH-]可以同時影响k′OH-和kapp;式(6)与1980年以后的研究结果相比虽然不是很准确,但仍可以反映出OH-的潜在作用[8]。CO2氨解转化为氨基甲酸盐(R2NCO2)和碳酸氢盐(HCO-3)两种产物,HCO-3在强碱性条件下转化为碳酸根(CO2-3),而游离的OH-或R2NH则会与HCO-3发生反应。氨基甲酸盐/碳酸氢盐的比例为[8]:
carbamate(bi)carbonate=kamine[amine]+k′amine[amine][OH-]kOH-[OH-]
(7)
OH-催化反应方程为:
r(bi)carbonate=CO2kOH-[OH-]HCO-3
(8)
r=kamine[R2NH][CO2];
kamine=k1k2k-1K+k2
(9)
式中:r为反应速率方程;kOH-为OH-的水解常数;kamine和k′amine为胺反应速率常数;k1,k2,k-1为反应速率常数;K为平衡常数;[R2NH][OH-][amine][CO2]为物质浓度。
两性离子机理中的控速步骤(RDS)由式(9)中k2和k-1·K的相对大小决定。式(9)中,对于MEA而言,氨基甲酸盐形成速率快,且其RDS中k-1·K>k2。因此,复合物解离产生氨基甲酸盐和H3O+的速度比CO2的损失速度更快。对于其他胺类,反应相对较慢,且k-1·K>k2。因此,质子在两性离子上发生分离和附着时,两性离子分离出CO2的速率要比分离出质子的速率要快[13]。由此可见,不同胺类RDS也不一致。
当催化剂以固体形式存在时,k′OH-[OH-]同样适用。相较于溶液中痕量液体碱中OH-自身的催化作用,固体碱可以显著提高这一催化作用。因此,使用固体碱作为催化剂,比利用溶液自身所含的OH-更有优势,主要体现在3个方面:(1) 在MEA-CO2-H2O体系中,气-液平衡条件下,OH-浓度可忽略不计,且起到的均相催化作用也相对较弱,而固体碱量足够且可控;(2) OH-很难从溶液中去除,但固体碱可以容易地过滤去除;(3) 不同类型和质量的固体碱可置于CO2吸收塔中的填料塔内,且其作为非均相催化剂在胺洗过程中能够加速胺溶液吸收CO2。
2.2 基于积分法验证反应级数
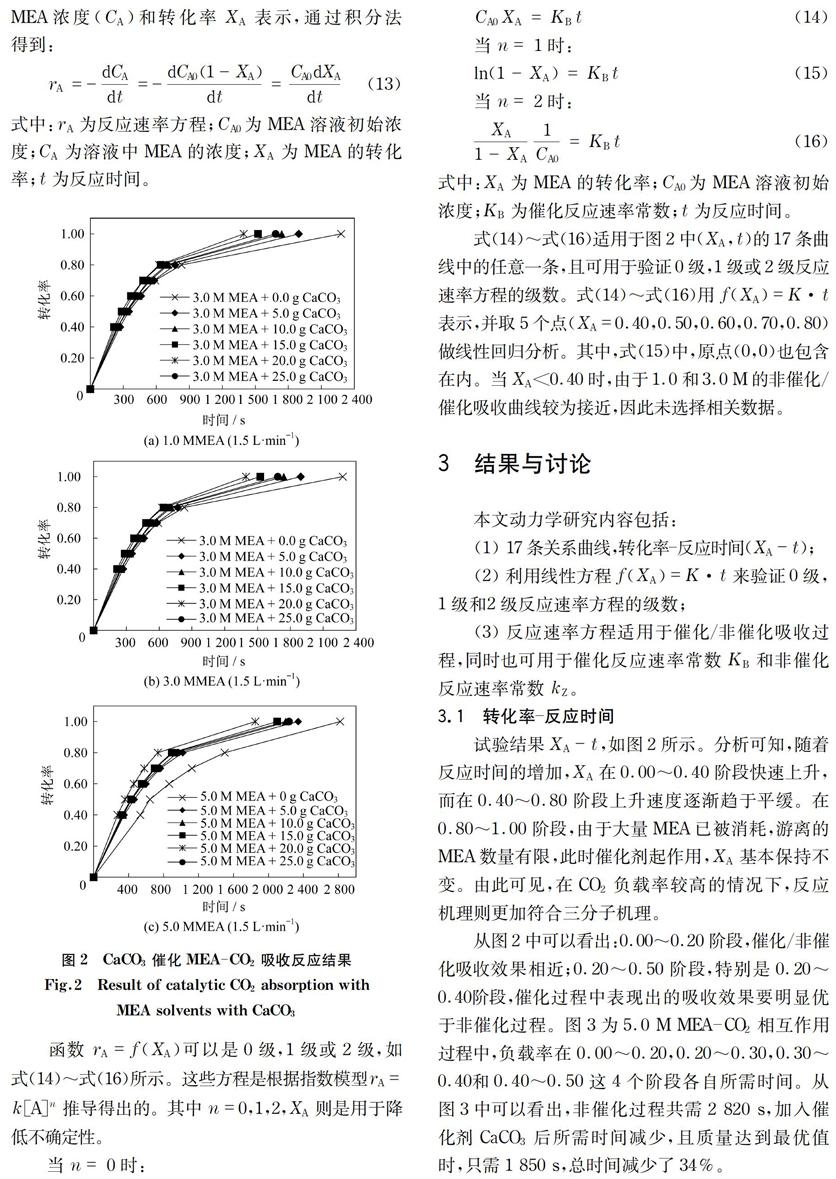
积分法作为图解法的一部分,可用来验证反应级数,同时这也是化学反应工程的基础[17-19]。通过完成17组试验,并对(XA,t)进行分类,绘制出关于转化率-反应时间(即XA-t)的曲线图。图2是关于CaCO3催化MEA-CO2吸收反应的曲线图。
胺-CO2体系中,相关反应物及生成物的浓度计算公式:
XA=1-2α
(10)
[A]=CA0(1-2α)=CA0(1-XA)
(11)
[C]=CA0α=CA0XA2
(12)
式中:[A]为溶液中MEA的浓度;[C]为生成物氨基甲酸盐的浓度;CA0为MEA溶液初始浓度;XA为MEA的转化率;α为CO2的负载率。
式(10)在CO2负载率为0.00~0.45时准确,即转化率XA<0.90。当XA>0.90时,MEA-CO2的化学计量比不再是1∶2[7]。CO2吸收过程可用MEA浓度(CA)和转化率XA表示,通过积分法得到:
rA=-dCAdt=-dCA0(1-XA)dt=CA0dXAdt
(13)
式中:rA为反应速率方程;CA0为MEA溶液初始浓度;CA为溶液中MEA的浓度;XA为MEA的转化率;t为反应时间。
图2 CaCO3催化MEA-CO2吸收反应结果
Fig.2 Result of catalytic CO2 absorption with
MEA solvents with CaCO3
函数rA=f(XA)可以是0级,1级或2级,如式(14)~式(16)所示。这些方程是根据指数模型rA=k[A]n推导得出的。其中n=0,1,2,XA则是用于降低不确定性。
当n= 0时:
CA0XA=KBt
(14)
当n= 1时:
ln(1-XA)=KBt
(15)
当n= 2时:
XA1-XA1CA0=KBt
(16)
式中:XA为MEA的转化率;CA0为MEA溶液初始浓度;KB为催化反应速率常数;t为反应时间。
式(14)~式(16)适用于图2中(XA,t)的17条曲线中的任意一条,且可用于验证0级,1级或2级反应速率方程的级数。式(14)~式(16)用f(XA)=K·t表示,并取5个点(XA=0.40,0.50,0.60,0.70,0.80)做线性回归分析。其中,式(15)中,原点(0,0)也包含在内。当XA<0.40时,由于1.0和3.0 M的非催化/催化吸收曲线较为接近,因此未选择相关数据。
3 结果与讨论
本文动力学研究内容包括:
(1) 17条关系曲线,转化率-反应时间(XA-t);
(2) 利用线性方程f(XA)=K·t来验证0级,1级和2级反应速率方程的级数;
(3) 反应速率方程适用于催化/非催化吸收过程,同时也可用于催化反应速率常数KB和非催化反应速率常数kZ。
3.1 转化率-反应时间
试验结果XA-t,如图2所示。分析可知,随着反应时间的增加,XA在0.00~0.40阶段快速上升,而在0.40~0.80阶段上升速度逐渐趋于平缓。在0.80~1.00阶段,由于大量MEA已被消耗,游离的MEA数量有限,此时催化剂起作用,XA基本保持不变。由此可见,在CO2负载率較高的情况下,反应机理则更加符合三分子机理。
从图2中可以看出:0.00~0.20阶段,催化/非催化吸收效果相近;0.20~0.50阶段,特别是0.20~0.40阶段,催化过程中表现出的吸收效果要明显优于非催化过程。图3为5.0 M MEA-CO2相互作用过程中,负载率在0.00~0.20,0.20~0.30,0.30~0.40和0.40~0.50这4个阶段各自所需时间。从图3中可以看出,非催化过程共需2 820 s,加入催化剂CaCO3后所需时间减少,且质量达到最优值时,只需1 850 s,总时间减少了34%。
图3 CaCO3作用下MEA-CO2相互作用
不同阶段所需时间
Fig.3 Time distributions of MEA-CO2 interactions with
various mass of CaCO3
图3表明,固体催化剂在工业应用中具有很大的潜在价值。吸收过程可以随着传质过程增强而加快,尤其是在MEA-CO2相互作用过程中,使用CaCO3作为催化剂时,其效果表现得最为明显。另外,使用优化质量后的CaCO3填充CO2吸收塔中的填料柱,柱的高度可以减少20%~30%,进而减少装置运行成本。
3.2 反应速率级数验证结果
积分模型采用式(14)~式(16)以及图2中的试验数据(XA,t)。由于试验是研究催化剂条件下的动力学模型,因此关于f(XA)=K·t的曲线不包括不含催化剂的3条基线,以及2条25.0 g CaCO3的曲线,故只有12条曲线用于验证反应级数,见表2及图4。在12条曲线内,对于分析结果采取严格的标准,只有R2>0.980的线性方程为合适的反应速率模型,而R2<0.980的方程数量都不得超过2个(≤2),否则整个系列试验视为失败。分析CaCO3的试验结果,可以发现符合要求的反应速率方程有10个(共12个),因此式(14)~式(16)适用。
3.3 催化反应速率方程及反应速率系数
(1) 催化反应速率方程
总反应速率方程rA(r)由曲线CA-t的斜率(k[CO2])和式(17)组合而来[13]。试验中,由于CO2流量恒定,即[CO2]为定值,因此反应速率取决于[CA]。因此若能准确测出斜率和[CO2],则可以计算出反应速率常数kZ。实际中,由于曲线的斜率是基于具体的微分方程(17)得到的,而其中由于-dCA/dt配有各种模拟方程,带来了许多不确定性;其次,基于有限的试验条件,气-液交互界面处的CO2浓度难以测定。因此,基于斜率和[CO2]得到的试验结果也就难以确定。所以,微分法在这一分析过程中不适用。
rA=-dCAdt=k[CO2][CA]
(17)
式中:rA为反应速率方程;CA为发生反应后MEA溶液浓度;t为反应时间;k为平衡常数;[CO2]为物质浓度。
表2 关于f(XA)-K·t的拟合曲线(R2≥0.980)
Tab.2 Fitted curve for f(XA)-K·t(R2≥0.980)
由于催化和非催化MEA-CO2相互作用过程中,具有相同的反应级数和相似的反应速率方程,因此引入另外一种分析方法。对于非催化CO2吸收过程,MEA-CO2的1阶反应速率方程基于两性离子机理,反应速率大小取决于NC[8]。整体反应速率方程可表示为:
r=k[CO2]=rZCO2-R1R2NH+r′OH-=
rZCO2-R1R2NH+k′OH-[OH-][8]
(18)
结合式(1)和式(5)可得:
kapp=
kZ2,R1R2NH[R1R2NH]1+kZ-1kZ2,R1R2NH[R1R2NH]+kOH-[OH-]+kH2O[H2O]=
kZ2,R1R2NH[R1R2NH]
(19)
由于在MEA-CO2作用过程中,存在[OH-],且[CO2]为定值,kZ-1∑kb[B]1,因此非催化反应速率方程可简化为[3]:
rZCO2-R1R2NH=kapp[CO2]=kZ2,R1R2NH·
[R1R2NH][CO2]
(20)
式中:r为反应速率方程;k,kZ-1为反应速率常数;kb为碱式解离平衡常数;kZ2为两性离子机理下的不同物质的反应速率常数;kapp为反应速率常数;kOH-,k′OH-为OH-的水解常数;kH2O为H2O的水解常数;[B]为溶液中碱浓度;[R1R2NH][OH-][H2O][CO2]为物质浓度。
图4 5M MEA-CO2拟一级反应速率方程
Fig.4 Pseudo-first-order reaction
rate equation for MEA-CO2
对于催化吸收过程而言,k′OH-[OH-]仍然存在。由于催化MEA-CO2反应速率方程级数已经确定为1级,因此方程(20)可进一步简化,得到方程(21):
r=rBCO2-R1R2NH+k′OH-[OH-]=
kapp[CO2]+k′OH-[OH-]
(21)
rBCO2-R1R2NH=kapp[CO2]=
KB[R1R2NH][CO2]
(22)
[OH-]与[MEA]相比,可忽略不计,所以k′OH-[OH-]也可忽略不计,因此式(18),(20)~(22)的简化是合理的。对比式(20)和(22),两者非常相似,MEA(0.00~0.40)的反应级数为1,此时MEA-CO2作用过程为1阶反应速率方程。
(2) 反应速率常数
对比式(20)和(22),其主要差别在于k2和KB。二阶反应速率常数k2是胺-CO2相互作用动力学分析中最重要的参数[11]。常用伯胺和仲胺的k2值大小顺序为:k2,PZk2,DETA>k2,AEEAk2,MEAk2,AMP≈k2,DEA>k2,MDEA[14]。对于MEA,如果采用两性离子机理,则k2用kZ表示。在过去几十年,大量研究表明速率常数表示为kZ[11,19]。通过对比图4(a),(b),(c)中所有曲线,可以看到:不同浓度的MEA溶液,不同质量的CaCO3,均会导致KB的数值有所不同,但都大于kZ,为kZ的1.1~1.8倍,最大可达2.0倍。
3.4 动力学分析结果
由于非均相催化过程中,涉及固-液-气三相的相互作用,因而其动力学分析过程很复杂。目前,关于催化氨基甲酸盐形成机理还在研究中,而通过反应机理的简化模型所得到的动力学结果是成熟的。虽然图解法不足以从分子水平上揭示催化剂表面发生的反应,但其能够验证反应级数、反应速率方程以及反应速率常数。经验证,本文所研究的反应级数适用于MEA的拟一级反应。通过简要评估CaCO3的催化效果,发现其可将二级反应速率常数k2提高为原来的1.1~1.8倍,其中使用最优量的CaCO3可提升反应速率常数到2.0倍。因此,CaCO3(>98%)是促进胺洗过程中CO2吸收的最佳工业催化剂。
另外,关于催化反应速率方程(22)与非催化反应速率方程(20),两者相似,均适用于MEA-CO2-H2O体系。通过对比分析催化与非催化氨基甲酸盐形成过程,则能够对非均相催化机理进行研究。
4 结 论
(1) 以碱土金属的碳酸盐(CaCO3)作为非均相催化剂,运用图解法研究非均相催化MEA-CO2相互作用过程中的动力学过程。在0级,1级和2级之间,确定MEA-CO2-H2O体系符合拟1级反应方程。
(2) 在MEA-CO2体系中,催化反应速率方程为r=KB[MEA][CO2]+k′OH[OH-][CO2],非催化反应速率方程为r=kZ[MEA][CO2]+k′OH[OH-][CO2]。因而,研究催化吸收的動力学过程相对较为简单。催化与非催化反应过程的主要区别则在于KB代表催化反应速率常数,kZ(即两性离子机理下的k2)则代表非催化2级反应速率常数。
(3) 根据斜率,可以发现催化反应速率常数KB要大于非催化反应速率常数kZ,并且KB与催化剂的质量有关,因而是可调节的。在不同浓度的MEA溶液,以及不同质量的CaCO3条件下,KB的数值有所不同,但均大于kZ,其大小为kZ的1.1~1.8倍。在加入最优量的CaCO3后,KB达到kZ的2.0倍。
參考文献:
[1] DANCKWERTS P V.The reaction of CO2 with ethanola-mines[J].Chemical Engineering Science,1979,34:443-446.
[2] XIAO S N,LIU H L,GAO H X.Kinetics and mechanism study of homogeneous reaction of CO2 and blends of diethanolamine and monoethanolamine using the stopped-flow technique[J].Chemical Engineering Journal,2017,316:592-600.
[3] ALVAREZ-FUSTER C,MIDOUX N,LAURENT A,et al.Chemical kinetics of the reaction of carbon dioxide with amines in pseudo m-nth order conditions in aqueous and organic Solutions[J].Chemical Engineering Science,1981,35:1717.
[4] SILVA E F D,SVENDEN H F.Ab Initio Study of the Reaction of Carbamate Formation from CO2 and Alkanolamines[J].Industrial & Engineering Chemical Research,2004,43:3413.
[5] XIE H B,ZHOU Y,ZHANG Y,et al.Reaction mechanism of monoethanolamine with CO2 in aqueous solution from molecular modeling[J].Journal of Physical Chemistry A,2010,114:11844.
[6] ASTARITA G,SAVAGE D W,BISIO A.Gas Treating with chemical solvents[M].NY USA:John Wiley,1983.
[7] HAGEWIESCHE D P,ASHOUR S S,AL-GHAWAS H A,et al.Absorption of carbon dioxide into aqueous blends of monoethanolamine and N-methyldiethanolamine[J].Chemical Engineering Science,1995,50:1071.
[8] RINKER E B,ASHOUR S S,SANDALL O C.Kinetics and Modeling of Carbon Dioxide Absorption into Aqueous Solutions of Diethanolamine[J].Industrial & Engineering Chemical Research,1995,35:1107.
[9] RINKER E B,ASHOUR S S,SANDALL O C.Kinetics and Modeling of Carbon Dioxide Absorption into Aqueous Solutions of Piperazine[J].Chemical Engineering Science,1995,50:755.
[10] ASTARITA G,SAVAGE D W,BISIO A.Gas Treating with chemical solvents[M].NY USA:John Wiley,1983.
[11] ABOUDHEIR A,TONTIWACHWUTHIKUL P,CHAKMA A,IDEM R.Kinetics of the reactive absorption of carbon dioxide in high CO2-loaded,concentrated aqueous monoethanolamine solutions[J].Chemical Engineering Science,2003,58:5195.
[12] CAPLOW M.Kinetics of carbamate formation and breakdown[J].Journal of the American Chemical Society,1968,90:6795-6803.
[13] BLAUWHOFF P M M,VERSTEEG G F,VAN SWAAIJ W P M.A study on the reaction between CO2 and alkanolamines in aqueous solutions[J].Chemical Engineering Science,1983,38:1411.
[14] VAIDYA P D,KENIG E Y.Termolecular Kinetic Model for CO2-Alkanolamine Reactions:An Overview[J].Chemical Engineering & Technology,2010,33:1577.
[15] IDEM R,SHI H,GELOWITZ D,et al.Catalytic method and apparatus for separating a gaseous component from an incoming gas stream:US,120138 A1[P].2011-03-29.
[16] SEMA T,NAAMI A,LIANG Z,et al.Part 5b:Solvent chemistry:reaction kinetics of CO2 absorption into reactive amine solutions[J].Carbon Management,2012,3(2):201-220.
[17] LEVENSPIEL O.Chemical Reactor Engineering[M].Danvers,MA:John Wiley & sons,1999.
[18] VERSTEEG G F,VAN SWAAIJ W P M.On the kinetics between CO2 and alkanolamines both in aqueous and non-aqueous solutions-I:Primary and secondary amines[J].Chemical Engineering Science,1988,43:573.
[19] LIANG Z,RONGWONG W,LIU H,et al.Recent progress and new developments in post-combustion carbon-capture technology with amine based solvents[J].International Journal of Greenhouse Gas Control,2015,40:26-54.

