壳寡糖的制备及其在医学和农业生产中的应用
原旭冰, 刘洪涛, 杜昱光
1.中国科学院过程工程研究所, 全军生物药制造与剂型工程重点实验室; 生化工程国家重点实验室, 北京 100190;2.中国科学院大学, 北京 100049
甲壳素(C8H13O5N),又称几丁质,是N-乙酰葡萄糖胺的长链聚合物。主要存在于真菌的细胞壁和节肢动物外骨骼中,如甲壳类动物螃蟹和虾等,是地球上除纤维素以外第二丰富的天然资源[1]。将甲壳素以酶促转化或化学方法进行解聚和脱乙酰化加工,可得到一系列衍生物,包括壳聚糖和壳寡糖等,这些衍生物已被证明具有重要的生物学意义[2]。其中,如图1所示,壳寡糖是一种由2~10个氨基葡萄糖通过β-1,4糖苷键连接的低聚糖。与壳聚糖相比,壳寡糖的分子量低、水溶性好且易被人体吸收,具有更广泛的应用前景[3]。目前已有研究表明,壳寡糖具有抗真菌[4]、免疫调节[5]和抑制肿瘤生长[6]等生理活性,且壳寡糖作为药物载体在医学领域也具有潜在的应用前景[7]。本文旨在总结壳寡糖的制备及其在医学和农业生产等领域的应用和作用机制,探索壳寡糖的研究价值和未来的发展方向。
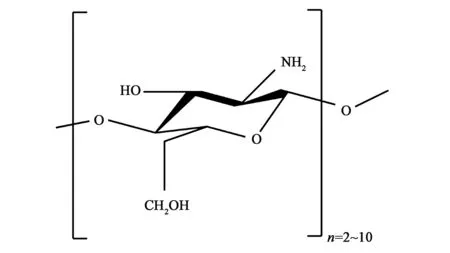
图1 壳寡糖结构式Fig.1 Structural formula of chitosan oligosaccharide.
1 壳寡糖的制备和表征
1.1 壳寡糖的制备方法
通过化学或酶降解等不同的方法,可断开糖苷键,从而制备得到不同聚合度的壳寡糖。目前,可用于水解壳聚糖化学制备壳寡糖的试剂有酸(如盐酸、亚硝酸和磷酸)和氧化还原剂(如过氧化氢、臭氧和过硫酸盐)等。其中盐酸最为常用,催化条件为在80 ℃下用35%盐酸处理1~2 h,酸浓度、处理时间和温度等对制备得到的壳寡糖分子量和脱乙酰度等物理特性具有较大影响[8]。化学降解尤其是酸降解在工业上应用广泛,其操作简单,条件可控且成本较低,但是壳聚糖酸水解得到的产物成分复杂,在分离纯化和质量控制方面存在较大难度。此外,化学试剂的使用存在污染环境、易产生有毒副产物以及产率较低等弊端。因此,采用酶进行精准切割制备壳寡糖的方法逐渐受到重视。酶法降解特异性高、安全无毒、无废水产生、易于控制且无需除盐,对产物的化学结构和生物活性影响较小。除了蛋白酶、纤维素酶等非专一性酶具有水解作用外,部分微生物来源的壳聚糖酶同样具有较高的产率和降解效率,例如源自芽孢杆菌的GH8(糖苷水解酶)家族的壳聚糖酶[9]等,其在大肠杆菌菌株BL21(DE3)中表达水平可高达500 mg/L,且1 g酶可水解约100 kg壳聚糖。但是,酶降解同样存在成本较高、实用性差等缺点,使得其难以工业化应用。因此,寻找低成本的壳聚糖酶或将化学法及酶法相结合来进行壳寡糖的制备将是未来的一个研究重点。
1.2 壳寡糖的分离纯化及结构表征
无论化学方法还是酶降解制备得到的壳寡糖,均为不同聚合度及脱乙酰度的混合物,需要进一步的分离纯化和表征。目前,已报道的壳寡糖分离纯化方法有超滤[10]、离子交换[11]、凝胶过滤、金属亲和[12]及分子排阻色谱[13]等。现已取得了一定突破,但耗时较长且在制备高纯度壳寡糖时仍然存在一定挑战,一般将多种方法组合以达到分离纯化的目的。纯化后的壳寡糖,通常采用核磁共振和质谱等方法对其结构进行表征[14]。核磁共振可在较短时间内对壳寡糖的N-乙酰化模式进行表征,而质谱则揭示其聚合度。
2 壳寡糖在医学中的应用
2.1 壳寡糖的抗癌作用及机制
已有研究表明,壳寡糖具有一定的抗癌活性,可对肿瘤细胞的生长、转移及侵袭等进行抑制,对癌症的预防和治疗具有积极意义。体外实验已经证明壳寡糖可诱导多种癌细胞死亡,如前列腺癌[15]、膀胱癌[16]、肝癌[6]、宫颈癌[17]和结肠直肠癌[18]等。壳寡糖对癌细胞生长的抑制机制与其物理性质密切相关,脱乙酰度和电荷量的增加或聚合度和分子量的降低都会造成体外抗癌活性的增加[15, 17]。在肝癌模型中,壳寡糖处理可显著抑制人肝细胞癌(HepG2)细胞的增殖,降低细胞周期中合成期(S期)的百分比,降低DNA的合成速率。分析细胞周期相关基因的表达,结果表明p21上调,而PCNA、细胞周期蛋白A和cdk-2下调。体内实验也证明,壳寡糖可抑制严重联合免疫缺陷(severe combined immunodeficiency, SCID)小鼠中HepG2异种移植物的肿瘤生长[6]。另外,壳寡糖也可通过增加奎宁还原酶(quinine reductase,QR)和谷胱甘肽-S-转移酶(glutathione s-transferase,GST)的活性和谷胱甘肽(GSH)水平,抑制体外鸟氨酸脱羧酶(orinithine decarboxylase,ODC)的活性和环氧合酶-2(COX-2)的表达,进而抑制ODC的多胺产生量,后者对于稳定新合成DNA和癌细胞增殖具有重要作用,最终对结肠癌发挥化学预防作用[18]。
癌细胞转移被认为是癌症患者死亡的主要原因,有研究发现壳寡糖对高转移性特点的人胃癌细胞具有一定抗转移活性[19]。实验结果表明,壳寡糖以剂量依赖性方式显著抑制SGC-7901细胞的增殖和转移,而CD147/MMP-2途径可能是其抗转移作用的关键机制。壳寡糖处理可降低分化簇147(CD147)的表达,从而减少基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)的表达。也有研究表明壳寡糖(0.1~5 mg/mL)预处理可显著抑制促炎细胞因子IFN-γ、IL-1α和TNF-α介导的人结肠直肠腺癌HT-29细胞的NO产生、iNOS表达和侵袭性[20]。综上,壳寡糖可通过抑制肿瘤细胞的生长、转移和侵袭发挥其抗癌活性。
2.2 壳寡糖的抗炎和免疫调节作用及机制
炎症是身体各组织在病原体、受损细胞或其他刺激下的保护性反应,可消除细胞损伤,对机体进行修复。但过度的炎症反应则会导致某些疾病的发生,包括自身免疫型疾病、心血管疾病、动脉粥样硬化及肠炎等[21]。体内实验表明,口服给药壳寡糖可通过抑制炎性细胞中的髓过氧化物酶、核因子(NF-κB)、环加氧酶(COX-2)和诱导型一氧化氮合酶(iNOS)的活化从而抑制结肠粘膜中的炎症,改善小鼠结肠长度和组织损伤的缩短。另外,促炎细胞因子(肿瘤坏死因子TNF-α和白细胞介素IL-6)的血清水平也被降低,小鼠存活时间被延长[22]。在体外实验中,壳寡糖同样可以通过抑制JNK1/2和IκB降解,阻止NF-κB转录至细胞核,进而抑制脂多糖诱导的巨噬细胞炎症,降低促炎因子的表达分泌[23]。综上,壳寡糖在体内和体外均具有一定的抗炎活性。
壳寡糖同样对免疫细胞具有一定的刺激增强作用。研究表明壳寡糖在体内和体外均可增强巨噬细胞的吞噬活性[24],其机制可能与烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶、诱导型一氧化氮合酶(iNOS)、白细胞介素IL-1和肿瘤坏死因子-α(TNF-α)基因表达的上调有关。总之,壳寡糖可增强机体的免疫调节能力,但在炎症反应过度的情况下,又可对其有所抑制。
2.3 壳寡糖的抗微生物作用及机制
壳寡糖是一种很好的天然抗菌剂,对于各种食物病原微生物、植物病原菌、动物病原菌和病毒的生长均有一定抑制作用[25]。壳寡糖的抗微生物活性与其分子量、pH、脱乙酰度和化学修饰等密切相关。有研究表明,分子量越高其抑菌作用越好[26],且较低的pH和较高的聚合度更利于其抗菌活性[27]。针对革兰氏阳性菌,带正电荷的壳寡糖可与细胞壁上带负电荷的蛋白多糖相互作用,导致细菌的变形和渗漏并最终诱导其死亡。针对革兰氏阴性菌,壳寡糖可结合细菌壁脂多糖上带负电荷的O-抗原,导致营养物质流动和细菌死亡的阻塞。壳寡糖进入胞内后也可通过抑制DNA转录等发挥其抑菌作用[28]。另外,壳寡糖对于酿酒酵母、黑曲霉和念珠菌等真菌的生长同样具有抑制作用,且抗真菌活性随着分子量的下降和质子化氨基与官能团的掩蔽增加而降低[29]。
2.4 壳寡糖在脂肪生成及代谢中的作用及机制
超重和肥胖通常与高脂肪和高热量食物的摄入有关,且相关的生活方式会造成一系列疾病,包括心血管疾病、动脉粥样硬化和结肠癌等[30]。目前壳寡糖已被证明具有抑制脂肪分化、减少脂肪积累等作用。研究表明,壳寡糖可通过表观遗传机制抑制脂肪细胞分化[31]。在3T3-L1脂肪细胞诱导分化的第4天,瘦素基因LEP的转录水平和蛋白质水平均被明显抑制,且明显阻断LEP启动子近端区域中‘CpG’岛的去甲基化,从而操控瘦素基因表达。壳寡糖的抗脂肪形成作用的机制也涉及过氧化物酶体增殖物激活受体γ(PPAR-γ)的下调,其在刺激脂肪细胞分化中起重要作用。在高脂饮食诱导的肥胖大鼠体内模型中,壳寡糖可显著降低小鼠体重,血清总胆固醇(CHO)和低密度脂蛋白胆固醇(LDL-C)表达水平显著抑制,且白色脂肪组织中PPARγ的mRNA表达水平明显降低,进而抑制脂肪分化,改善血脂异常[32]。在ob/ob肥胖小鼠模型中,壳寡糖可通过脂联素的上调抑制脂肪细胞的分化和生成,且脂肪组织特异性TNF-α和IL-6分泌因子显著下调[33]。因而,壳寡糖可通过抑制脂肪的分化和积累,改善血脂平衡,进而对肥胖等疾病具有一定积极作用。
2.5 壳寡糖在糖代谢中的作用及机制
糖尿病是以糖、脂代谢紊乱为主要特征的人类第三大代谢疾病,可分为以胰岛素分泌不足为主要特点的1型糖尿病和以胰岛素抵抗为主要特点的2型糖尿病,其并发症所致死亡人数仅次于心血管疾病和癌症[34]。而壳寡糖在调节糖脂代谢方面已有一定报道,如图2(彩图见图版一)所示,壳寡糖进入肠道后,一部分直接抑制肠道糖类物质的吸收,吸附脂类物质,减少脂肪的吸收,另一部分经小肠吸收进入血液影响其他器官,改善肝脏的代谢平衡,减少胰岛的氧化损伤,同时调节大脑的反馈信息,产生饱腹感,另外,壳寡糖能够促进肌肉和脂肪对胰岛素的敏感性[3]。
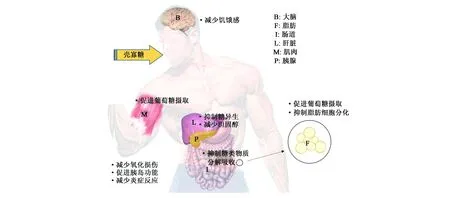
图2 壳寡糖改善糖、脂代谢的分子作用机制Fig.2 Molecular mechanism of the improvement on glycolipid metabolism by chitosan oligosaccharide.(彩图见图版一)
体内研究表明,当糖尿病大鼠用0.3%的壳寡糖治疗4周后,其血糖水平从583 mg/dL降低至430 mg/dL,具有显著统计学差异[35]。胰腺中的β胰岛细胞可分泌胰岛素,其数量很大程度上决定了胰岛素的分泌。而胰岛素不仅可以促进肝糖原和肌糖原的合成,促进肌肉和脂肪组织细胞对葡萄糖的吸收,同时也可以抑制糖异生。而有研究证明,壳寡糖对于胰腺及胰岛β细胞具有保护作用。壳寡糖的给药可显著上调糖尿病鼠胰腺中超氧化物歧化酶活性的降低,并且可有效降低丙二醛的含量(P<0.05)。而高剂量壳寡糖更可使胰腺/体重比恢复到与对照水平接近的数值。胰腺的组织切片表明,糖尿病模型中胰腺的萎缩以及胰岛β细胞的破坏,都在壳寡糖给药下有明显恢复,甚至比糖尿病药物二甲双胍的作用更为明显[36]。
另外,壳寡糖也可增加组织的糖摄取,调节糖代谢。糖代谢主要发生在肝、肌肉及白色脂肪组织中,并且受到胰岛素信号通路中各受体的调控。如葡萄糖转运蛋白GLUT4等,若其含量升高,则有助于组织对糖的摄取和吸收。研究表明,壳寡糖处理8周后肌肉和脂肪组织中的GLUT-4 mRNA表达显著升高[36]。在细胞模型中,壳寡糖也明显作用于3T3-L1脂肪细胞,可增加基础状态下及胰岛素刺激下葡萄糖的摄取量,而且用不同浓度的壳寡糖去刺激细胞,其受体GLUT4有显著升高[37]。
壳寡糖对于糖尿病的肠道菌群也具有调节作用。体内实验表明,壳寡糖可显著增加糖尿病小鼠中的有益菌(如Akk菌),其与肥胖、糖尿病、炎症和代谢紊乱呈负相关。而糖尿病小鼠中的一些有害菌如螺杆菌则被显著抑制,是许多慢性病发生发展中的一个重要致病因子[38]。
综上,壳寡糖处理糖尿病小鼠,不仅可以平衡其肠道菌群,保护胰腺以及胰岛细胞,也可以增加组织的糖摄取,进而实现降低血糖、缓解糖尿病症状的目的。
2.6 壳寡糖在神经中的作用及机制
阿尔兹海默症是一种神经退行性疾病,其形成机制学说包括β-淀粉样蛋白(Aβ)积聚、乙酰胆碱(ACh)缺乏、炎性反应和氧化应激增加等[39]。壳寡糖已被证实对神经具有一定的保护作用,研究表明口服200 mg/kg、400 mg/kg或800 mg/kg剂量的壳寡糖可有效减少Aβ 1-42诱导的大鼠学习障碍和记忆缺陷,该剂量也可改善神经细胞凋亡。 实验发现壳寡糖的神经保护作用与其抑制氧化应激和神经炎症反应密切相关,丙二醛、8-羟基-2′-脱氧鸟苷的水平降低,谷胱甘肽过氧化物酶和超氧化物歧化酶活性水平增加。壳寡糖也可通过抑制促炎细胞因子(白细胞介素-1β和肿瘤坏死因子-α)的释放来抑制炎症反应并减少炎症损害[40]。乙酰胆碱酯酶(AChE)抑制剂广泛应用于阿尔茨海默氏症临床实验,其可通过抑制乙酰胆碱的水解来激活中枢胆碱系统并减轻认知缺陷。而90%脱乙酰度、分子量为1~5 kDa的壳寡糖对PC12细胞系中Aβ 25-35诱导的AChE蛋白表达水平和AChE活性有较高的抑制活性[41]。另外,也有研究表明,壳寡糖可通过铜离子的吸附、抗神经炎症、抗氧化活性以及抑制Aβ裂解酶等其他生物学活性发挥神经保护、改善阿尔兹海默症等作用[42]。
2.7 壳寡糖的修饰接枝和在医药材料中的应用
近年来,由于壳寡糖良好的生物特性及天然无毒害等物理特性,已在生物医药领域引起重视。将壳寡糖引入各类型的纳米粒子或进行修饰接枝,可对药物递送体系的胶体稳定性和体内血液循环加以改善[43]。有研究开发出一种稳定的壳寡糖亚铁磁性氧化铁纳米立方体(Chito-FIONs)作为癌症高温的有效热纳米二极管,其由多个30 nm大小的FION组成,且被壳聚糖聚合物壳包封。磁引导的Chito-FIONs通过半胱天冬酶介导的细胞凋亡成功根除了靶癌细胞,且在动物肿瘤模型上显示出优异的抗肿瘤效力而没有任何严重的毒性[44]。另外,也有研究设计出一种由叶酸缀合的壳寡糖,自组装得到的磁埃洛石纳米管(FA-COS/MHNT),是针对癌症药物喜树碱(camptothecin,CPT)的多任务药物递送系统。除了磁性靶向,该纳米复合材料与叶酸复合物反应,进而选择性地靶向癌细胞过度表达叶酸受体。同时,由于叶酸的部分介导和壳寡糖的存在,使得细胞摄取量增加,因而纳米载体对靶向癌细胞具有特异性。MTT测定显示,载有CPT的纳米载体表现出对结肠癌细胞更强的细胞生长抑制作用[45]。此外,用脱氧胆酸(deoxycholic acid, DOCA)对高纯度的壳寡糖进行化学修饰。由于其两亲特性,在水性环境中可形成自聚集的纳米颗粒,并显示出具有高水平基因转染效率的基因载体的巨大潜力,被认为是有效的非病毒基因载体的潜在候选物[46]。
3 壳寡糖在农业生产中的应用
3.1 壳寡糖在植物种植中的作用及机制
目前,壳寡糖在植物种植领域已被证明具有促进植物生长、诱导抗病性产生及改善农产品品质等多种活性。壳寡糖是天然的植物免疫调节剂,可诱导植物产生抗病性,被广泛应用于农业以改善植物的防御反应,包括番茄、小麦、草莓、油菜和烟草等[47]。研究表明,收获前施用50 mg/L 壳寡糖对于提高草莓的质量和抗氧化能力具有积极作用,其果实硬度、粘度、木质素、糖、蛋白质、总可溶性固形物和可滴定酸度含量增加,且草莓的花青素、总酚、类黄酮、维生素C含量和DPPH(2,2-二苯基-1-苦基肼)清除活性明显增高[48]。在接种诱导烟草花叶病毒(tobacco mosaic virus,TMV)前以同样浓度的壳寡糖预处理拟南芥1天,可激活水杨酸信号转导途径在拟南芥中诱导TMV抗性的产生[49]。壳寡糖也可作为提高麦芽质量的诱导剂增强大麦萌发。在浸泡水中补充壳寡糖后,所得麦芽中水解酶(α-/β-淀粉酶、蛋白酶和β-葡聚糖酶)和抗氧化酶(超氧化物歧化酶和过氧化氢酶)的活性以剂量依赖性方式增加,且麦芽糖质量,包括游离α-氨基氮含量、Kolbach指数、麦芽提取物含量、糖化力、麦芽汁粘度和葡萄糖、麦芽糖和麦芽三糖的比例等都得到显著改善[50]。
3.2 壳寡糖在动物养殖中的作用及机制
在动物养殖中,壳寡糖在兽药以及饲料添加剂等方面都有所应用。生物兽药方面,壳寡糖主要发挥其抗菌及降血脂作用,壳寡糖能够抑制金黄色葡萄球菌、致病性大肠杆菌、放线杆菌等动物养殖中的病原菌[51],也可通过其降血脂作用对动物的病症进行治疗[43]。
在饲料添加剂应用方面,壳寡糖可明显改善牲畜的生物性能。已有研究表明,在日粮中添加壳寡糖可改善仔猪的生产性能,且与壳寡糖分子量和脱乙酰度密切相关。日粮中补充90%脱乙酰度和802 kDa分子量的壳寡糖,断奶仔猪的体重增长(BWG)、平均日增重(ADG)和平均日采食量(ADFI)显著增强,生长性能明显提高,且粗蛋白和粗脂肪的回肠消化率也得到提高,吸收能力有所增强,表明壳寡糖可改善采食量并促进营养物质的消化和吸收[52]。在肉鸡日粮中添加壳寡糖同样对其生长和质量有所改善,其增重、采食量明显提高,且28 g/kg的壳寡糖日粮补充下红细胞和高密度脂蛋白胆固醇浓度均显著提高,14 g/kg的壳寡糖日粮补充下肉鸡的甘油三酯浓度显著降低。随着壳寡糖浓度增加,肉鸡肝脏重量增加,腹部脂肪减少,肉黄度下降(P<0.05)。总之,壳寡糖可提高肉鸡的性能和胸肉质量,同时增加血液中的红细胞和高密度脂蛋白胆固醇浓度,诱导腹部脂肪减少并改善肉质[53]。壳寡糖作为新型饲料添加剂已在2004年获得了农业部批准[54]。
4 展望
本文总结了壳寡糖的制备和表征方法及其在医学和农业生产等领域的应用进展。壳寡糖具有低分子量、高溶解力以及强吸收力等物理特性,以及抗癌、抗炎、免疫调节、抗微生物、改善血脂和糖代谢、神经保护等生理特性,使其在肥胖、糖尿病、阿尔兹海默症等疾病方面具有广泛的应用前景。但是,同样存在一定的问题需要在未来进一步的研究和解决:首先,壳寡糖的分子量和脱乙酰度对其生理活性影响较大,而目前的制备方法无法保证每批次制备的壳寡糖物理性能完全一致,分离纯化和结构表征步骤也较为繁琐,暂时没有公认的优势明显的方法及标准。其次,壳寡糖的保存条件也需进一步的探索。壳寡糖的固液存储方式、贮存温度及时间,均涉及到是否降解、会否染菌等问题,并进一步影响其物理和生理特性。第三,壳寡糖由于其独特的优势被广泛研究应用,但是壳寡糖仍是混合物,且结构影响较大,不同的结构可能会得到完全相反的效果,因此对于单一组分的壳寡糖的研究是非常迫切且必要的。另外,目前尚缺乏壳寡糖对于人类的长期安全性研究。总之,壳寡糖作为一种功能寡糖,具有较好的应用前景,但是仍需科研人员及产业化工作者的不断探索与努力!

