基于斑马鱼毒理基因组学的化学品测试技术研究进展
王志浩,彭颖,王萍萍,夏普,张效伟,2,*
1. 污染控制与资源化研究国家重点实验室,南京大学环境学院,南京 210023 2. 江苏省环境保护化学品安全与健康风险研究重点实验室,南京 210023
由于人类活动的需求,市场上使用的化学品已逾10万种,大部分(80%以上)现有化学品的环境安全信息是缺失的,且每年新化学品进入市场的速度远大于传统化学品风险评价的速度[1-2]。依赖传统的毒性测试(如利用大鼠、小鼠、兔子等模式动物进行测试)因为测试通量低、耗时长、成本高以及动物伦理问题[3],已经不能满足化学品毒性测试的需求[4]。发展快速、高效、低成本的化学品毒性预测技术已成为新的毒性测试思路[4-5]。另一方面,每年大约有3亿吨化合物随着工业、农业、生活用水和地表径流汇入环境水体,导致水体的污染严重。同时,除水体的急性毒性外,大量化学污染物长期低浓度存在于环境水体中,因此,低浓度复合污染持续暴露对人类和生态环境健康产生的风险也逐渐引起人们的重视。如何识别和评价复合污染水体的生物效应和毒性是研究的难点[6]。
目前,复合污染水体的环境监测与风险评估主要依赖于化学分析手段。尽管随着分析仪器的发展,利用高通量靶向分析与非靶向分析的技术手段可以检测出复杂环境样品中的上百种(甚至上千种)化学污染物,但是化学分析检测出的化学物质并不能解释复合污染的毒性,而且,环境中仍然存在现有分析手段无法检测的未知化合物[7]。组学技术可以检测生物体在基因组水平上生物学通路(biological pathway)的响应与改变,且致毒通路可以用来预测化学品潜在的毒性终点,为化学品优先性筛选及毒性预估提供指导[8]。基于生物效应为导向的分析(effect directed analysis, EDA)评估策略将体外生物测试方法应用于环境水体复合污染的生物效应监测和关键毒害物质的鉴定研究中,能够有效检测环境样品的特定生物毒性效应[9]。然而,现今较为完善的以细胞为基础的高通量体外筛选毒性测试只涉及较少的生物学通路,不能体现出生物个体水平的响应,限制了对潜在有害结局的预测和评估[10-11]。因此,需要开发一套新的毒性测试,能够对环境水体的毒性及其有害结局进行评估和预测。
斑马鱼作为一种较为完善的模式脊椎动物,大量应用于基因研究、发育研究及生态毒理学研究等科研领域[12],本文主要综述了斑马鱼胚胎毒性测试、行为分析及组学技术进展及其集成技术在化学品毒性筛选评估管理与水环境复合污染毒性监测中的应用,并对斑马鱼毒理基因组学测试技术在水环境管理中的应用前景进行展望。
1 斑马鱼胚胎测试(Zebrafish Embryo Testing Techniques)
相比传统毒性测试,斑马鱼胚胎毒性测试具有以下优点:1)斑马鱼胚胎具有体外受精、体积小、透明易观察、发育快以及实验成本低等优点[13];2)与标准成鱼急性毒性测试之间有很好的相关性,可以替代成鱼急性毒性试验[14];3)可以反映众多的生物学通路和毒性终点,如内分泌干扰、心脏毒性及神经肌肉异常等[15];4)斑马鱼基因组与人类基因组相似度高,其与发育相关的信号通路保守性强,为斑马鱼毒性测试的物种间毒性外推提供了基础[16];5)在1%二甲亚砜(dimethyl sulfoxide, DMSO)暴露条件下,斑马鱼胚胎的正常发育不会受到显著影响,为疏水性化学品的毒性测试提供条件[17]。目前,斑马鱼胚胎测试已成为化学品毒性评价中常用的替代测试方法,可以快速高效准确获取化学品毒性信息[18],并为复合污染水体的生态风险评价提供更多毒性数据[15]。
斑马鱼胚胎测试方法已被普遍应用在化学品毒性评估方面,如经济合作与发展组织(OECD)提出化学品急性及慢性毒性测试导则TG 212, TG 236。最近又有大量研究开发了更为高效的斑马鱼胚胎毒性测试体系,如自动化斑马鱼胚胎绒毛膜去除及自动化多孔板胚胎放置技术,提高了斑马鱼胚胎暴露效率[19];基于384孔板的高内涵测试对(fli1:egfp)转基因鱼进行自动化捕捉获取体长、心率、心血管速率等毒性指标数据,并且定量表征神经系统相关的自主尾部收缩活性,实现机器自动化观测斑马鱼毒性终点,大大提高了测试效率[20]。但是,通过斑马鱼胚胎发育毒性测试(zebrafish embryo developmental toxicity test, ZEDT)得到的毒性终点指标主要为个体水平上的致死致畸等(如图1表格)[20-24],这些毒性终点的出现通常要求化学品暴露浓度很高,有时化学品浓度不能达到致毒浓度,且该方法并不能有效识别更敏感毒性效应终点,导致化学品毒性预测及环境风险评价过程中存在误差。
斑马鱼行为分析(zebrafish photo motor response, ZPMR)是利用斑马鱼胚胎或幼鱼的行为改变反映环境胁迫对斑马鱼胚胎发育影响的技术[25-26]。基于斑马鱼胚胎与幼鱼行为分析技术能有效识别敏感的毒性测试终点,如运动活跃程度的改变等,有效表征化学品对神经功能的干扰[27-28]。研究显示,低浓度暴露条件下斑马鱼的行为改变与高浓度暴露所引起的斑马鱼胚胎的畸形和死亡具有显著相关性,该测试技术极大地提高了斑马鱼胚胎毒性测试的灵敏度[22,24,29]。有研究利用96 hpf斑马鱼行为分析毒性终点与斑马鱼成鱼急性毒性建立毒性外推模型,准确利用行为分析的结果预测神经毒性化学品的成鱼急性毒性LC50(半数致死浓度),而这些化学品在以往斑马鱼胚胎发育毒性测试中一般毒性较弱,行为分析毒性指标的纳入将大大提高斑马鱼胚胎测试体系的准确性[30]。由于斑马鱼行为分析测试的灵敏度较高,已有研究将该测试技术应用在复合污染环境水体的毒性评估中[31]。然而,行为分析仍是在个体水平上对化学品进行区分,无法对化学品的分子作用类型及毒性潜力大小进行系统评估。

图1 斑马鱼发育毒性测试及行为分析流程图Fig. 1 Zebrafish embryo developmental toxicity test

生物毒性(Biological Toxicity)斑马鱼胚胎发育毒性测试(Zebrafish EDT)斑马鱼行为分析(Zebrafish PMR)斑马鱼胚胎转录组测试(Zebrafish Transcriptome)致死 (Mortality)√○○发育毒性 (Developmental Toxicity)√○○神经毒性 (Neurotoxicity)×√○生殖毒性 (Reproductive Toxicity)××○遗传毒性 (Genotoxicity)××○
注:√表示可以直接获得该毒性终点;×表示不能获得该毒性终点;○表示可以通过预测得到该毒性终点。
Note: √ Can get the endpoint by this method; × Can’t get the endpoint by this method; ○ Can predict the endpoint by this method; EDT stands for Embryo Developmental Toxicity Test; PMR stands for Photo Motor Response.
基于斑马鱼胚胎的毒性测试存在局限性,主要包括:1)斑马鱼并非中国本土物种,其对化学物质毒性的敏感性可能与本土生物有一定差异;2)斑马鱼胚胎正常培养孵化温度为(28±2) ℃,因此不适用于低温水体的原位分析;3)不同品系斑马鱼存在毒性敏感差异等。此外,斑马鱼胚胎测试在测试通量和毒性终点上但还存在以下不足:1)测试所用的毒性终点不全面,无法对化学品的生殖毒性及遗传毒性进行评估(表1);2)该测试方法只是在个体水平上对测试化学物质导致的胚胎的死亡、畸形等毒性终点进行评价,并不能揭示化学品毒性作用机制。
2 组学技术(Omics Techniques)
毒理基因组学(Toxicogenomics)是一种利用“组学”技术(如转录组、蛋白组、代谢组等),研究化合物作用于机体引起的基因组水平变化,并利用基因变化评价和预测化合物毒性的新兴学科[32]。与以表型为测试终点的传统毒性测试不同,毒理基因组学检测基因水平的毒性终点,具有更高的敏感性和特异性[32-34]。其中,转录组技术(如微阵列芯片、转录组测序技术等)能够检测全基因组的转录表达谱,反映最早期的生物分子响应,被广泛应用于化合物生物标志物的鉴定及致毒机理的解释[35-37]。而且,由于蛋白质及代谢物的丰度会影响蛋白质组及代谢组的检出,其分辨率和应用范围现今还不及转录组技术[38]。目前,毒理基因组学在环境污染物风险评价中的应用还十分有限,主要难题包括:1)根据基因水平变化预测表型毒性;2)对污染物的毒性进行定量评价;3)缺乏标准化的毒理基因学测试方法及分析流程;4)测试成本高昂,难以实现大量样品的测试。
利用斑马鱼这一模式动物,可以将组学技术与传统毒性测试相结合,为基因表达变化与表型毒性终点建立关联提供有利的条件。斑马鱼转录组学已在化合物安全评价、作用机制研究、水生生态风险评估以及水体样品毒性评估等领域得到应用[39-40]。有研究利用斑马鱼胚胎转录组研究阻燃剂mITP (monosubstituted isopropylated triaryl phosphate, mITP)的分子致毒机制,发现mITP是潜在的芳香烃受体(AHR)配体,并通过抑制视磺酸受体的生成诱发斑马鱼胚胎的心脏毒性[41]。
斑马鱼转录组学与斑马鱼胚胎毒性测试联用后,可以将转录组学数据与表型毒性数据相关联,结合分子网络公共数据库,能够得到从分子响应到生物学过程,再到表型效应的网络图谱,从而为化学品致毒模式研究及环境风险评价提供新思路。有研究组利用斑马鱼胚胎研究了三氯乙烯(trichloroethylene, TCE)的毒性,主要对TCE暴露后,斑马鱼胚胎的血管生成、肌动蛋白、线粒体功能及转录组变化进行测试分析,结果表明转录组响应与生化指标的变化可以建立很好的关联,TCE具有心脏毒性,并利用FAK信号通路(focal adhesion kinase signaling pathway)等生物学通路解析了TCE的毒性作用机制[42]。另外,有研究组综合了斑马鱼胚胎毒性测试、转录组、q-PCR及转基因鱼系形态学观察几种测试方法,对污水处理厂出水的毒性进行了测试;同时,研究对水样毒性的分子机制及生物标志物进行了分析,并结合有害结局路径(adverse outcome pathway, AOP)框架对长期水样暴露可能显现出的斑马鱼形态毒性进行了预测,该研究为环境水体监测及风险评估方法的改进建立了基础[43]。
有害结局路径框架的提出将化学污染物的结构、致毒的分子启动事件和有害结局建立关联。因此,得到化学品或环境样品的敏感分子响应后,可结合AOP对样品最敏感毒性终点作出预测,这为化学品的毒性预测评估及环境复合污染监测提供了新的思路[44]。
组学研究可以根据剂量-效应关系对化学品毒性进行定量评价,预测毒性起始浓度(point of departure, POD)[45]。例如,研究表明,有些内分泌干扰物低浓度暴露后生物体内的基因变化是非单调的,这就表明其中存在新的分子机制[46]。另外,有研究表明利用斑马鱼胚胎进行多剂量实验可以有效识别出雄激素响应基因[47]。而且,以差异表达基因活性值为基础进行的生物学通路分析可以用于化学品的毒性诊断分析[48]。然而,面对大量的毒性测试,转录组测试成本高昂,缺乏标准数据分析方法,这些原因限制了转录组特别是基于多剂量基因组数据在危害识别中的应用[49-50]。因此,降低转录组成本及建立剂量效应模型的标准化生物信息学方法对组学技术在化学物质毒性测试中应用推广至关重要。
3 简化转录组测试(Reduced Transcriptome)
为了降低转录组测试成本,实现大批量化学品全剂量浓度的转录组测试,通过筛选关键基因对全基因组进行简化,组成关键基因集代表全转录组信息。其基本原理是关键基因可以作为生物体分子网络中共调控或共表达基因的替代物,来表征整个生物学通路网络的动态响应[51]。本课题组利用该原理对人类简化转录组(reduced human transcriptome, RHT)进行了试验研究,挑选了1 200个关键人类基因作为RHT基因集,进行剂量效应模型分析。结果表明,该技术可以利用经暴露后细胞的动态生物学响应来表征环境样品的潜在毒性效力,实现高效检测水体质量的目标,大大节省了实验成本[52]。
人类简化转录组技术存在细胞类型单一、无组织结构等问题,为弥补该缺陷,有效增多毒害物质评估中的生物学通路,课题组在此基础上用斑马鱼胚胎作为多细胞测试体系开展斑马鱼简化转录组(reduced zebrafish transcriptome, RZT)研究,形成了一套标准化的基于斑马鱼模型的化学品简化转录组测试与评价技术,其中包括毒性数据的获取、分析及呈现过程。该研究通过挑选斑马鱼简化基因集,结合Ion Ampliseq Technology测序形成斑马鱼简化转录组测序技术(RZT-Ampliseq),同时构建了RZT-Ampliseq与斑马鱼胚胎多剂量模型相结合的分析方法(RZT-Ampliseq-embyro)(如图2)[53]。
3.1 实验流程与方法
研究流程主要包括建立并验证RZT测试平台、建立生物信息学分析方法、将RZT应用于环境污染物的毒性评估三大部分:1)研究首先从斑马鱼生物学通路数据库(包括KEGG和Gene Ontology数据库)中,筛选得到1 000个斑马鱼的关键基因,并整合毒理学测试数据库相关基因,建立一个由1 637个斑马鱼基因组成的RZT基因集,而后考察RZT基因集的生物学通路覆盖度,并选取5个不同时期(24 hpf到成鱼)的斑马鱼全转录组数据(来自NCBI数据库),考察简化基因集对全转录组基因图谱的定性和定量表征能力,同时确立斑马鱼胚胎暴露及样品处理的实验操作;2)对双酚A(bisphenol A, BPA)(10~10E-5 μmol·L-1,10倍梯度稀释)及4种环境水样的有机污染物萃取液(10~6.4E-4富集系数,5倍梯度稀释)进行斑马鱼简化转录组测试,所得结果与已有的体外生物测试(invitrobioassays)及人类细胞的RHT测试结果进行比较;3)建立RZT生物信息学分析方法:利用剂量效应模型,计算各基因的效应浓度(effect concentration, EC),挑选EC <= LOEC(最低有效应浓度)的基因作为差异表达基因(differentially expressed genes, DEGs),将DEGs比对到生物学通路上,筛选出匹配到至少3个DEGs的通路,并根据其匹配基因EC值的平均值,作为该通路的效应浓度。
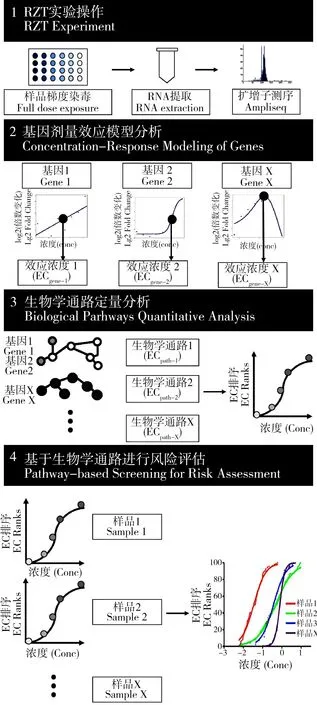
图2 斑马鱼简化转录组测试实验分析流程图[4]Fig. 2 Framework of reduced zebrafish transcriptome (RZT) experiment and data analysis[4]
3.2 结果分析
1)RZT平台验证:RZT基因集能覆盖95%的生物学通路;能够定性地模拟基于全转录组基因表达的聚类图谱,定量地表征接近(差别<1个数量级)基于全转录组基因表达的毒性起始浓度;RZT-ampliseq测试可以为斑马鱼mRNA多元测序分析提供一种高通量、低成本的技术平台。
2)剂量效应模型与生物学通路分析:利用剂量效应模型可以定量表征基因的效应浓度,进而用于生物学通路的定量表征,识别样品的潜在敏感生物学通路。
3)基于生物学通路的毒性评估:对样品的生物通路效应浓度进行排序,得到各个样品的生物学通路敏感性分布曲线,计算各样品的毒性潜力,识别潜在的高毒性样品(如图3)。
4)RZT、invitro测试以及RHT结果的比较:RZT的BPA测试结果与ToxCast 中的BPAinvitro测试相比,2种测试得到的生物学通路及其敏感性排序相似,但RZT测试的敏感性更高,得到的结果比invitro测试低3个数量级左右;使用RZT平台得到环境样品暴露后的敏感生物学通路结果与RHT结果一致(如图3)。在环境样品测试方面,RZT-ampliseq-embryo更全面、更敏感,且RZT可以检测出invitro测试(103种)无法检出的弱响应通路,如甲状腺和下丘脑相关响应等,但RZT对雌激素受体类通路检出敏感性较低,这一问题可通过调整胚胎样品收集时间(> 48 hpf)解决;RZT分析得到的富集通路能够与有害结局建立联系,表征样品可能导致的最主要的生物学终点。
综上,斑马鱼简化转录组技术的提出对毒理基因组学的发展有极大的促进作用,该技术从测试通量、成本、冗余去除等多方面弥补了全转录组的不足,使得高效、快速、经济获取大量化学品生物分子响应成为可能;结合斑马鱼胚胎全剂量模型,可以对暴露后响应基因及生物学通路做敏感性分析,从而得到生物体在该暴露条件下最敏感的毒性终点,有效避免了非单调响应基因信息缺失的问题;建立了一套较为完善的数据分析方案,为转录组数据处理提供了解决思路;与目前在筛选生物标志物研究中应用较广的invitro测试相比,RZT平台作为生物有机体测试系统可以覆盖更多的生物学通路,它不但覆盖了invitro测试的终点,还可以鉴别如发育、生殖相关的生物学通路。斑马鱼简化转录组技术将会对化学品筛选管理、化学品毒性预测、化学品优先控制及环境监测治理等领域产生重大影响。
4 斑马鱼简化转录组集成测试及其应用前景(Application Prospect of Reduced Zebrafish Transcriptome Aggregate Testing Method)
4.1 化学品测试、筛选、毒性预测与评估
斑马鱼胚胎毒性测试、行为分析及斑马鱼简化转录组同时应用构建为斑马鱼简化转录组集成测试技术。在化学品测试中,可利用斑马鱼简化转录组得到化学品暴露后生物体最敏感的生物学响应,将其与斑马鱼胚胎毒性测试、行为分析的表型效应等结果相结合,能够对化学品致毒机制进行解析,并建立化学品生物毒性数据库,进而实现对大量化学品的优先性筛选;另一方面,可以将毒理基因组学与传统毒理学检测方法结合,利用组学对化学品的整体毒性进行评估,确定其主要毒性后,再进行单独毒性的定量分析,这样能够为定量毒性检测提供毒性机理上的支持,从而增强风险评价的可靠性。此外,利用该技术得到的早期分子响应也可以为化学品毒性效应预测提供数据基础;由于斑马鱼转录组可以实现跨物种模型比对,因此可以利用该技术的转录组毒性信息进行毒性物种间外推。由于化学品毒性测试数据的缺乏,若将该高通量测试方法标准化,形成具有自主知识产权的化学品毒性测试技术体系和相关技术标准,形成的化学品毒性数据库可以为我国化学品安全管理提供技术支撑。
利用斑马鱼简化转录组集成测试技术可以高通量、低成本的获得化学物质对生物体多维毒性信息,并将体内试验终点与生物个体有害结局直接相关,基于现有生物学信号网络整合不同层级毒性信息完善AOP框架,为实现化学品的毒性预测提供条件(图4)。
4.2 复合污染毒性测试、评估与诊断
在环境监测方面,将斑马鱼简化转录组集成测试技术与AOP框架相结合,对复合污染进行毒性预测和评估。利用该方法可以得到环境样品暴露后分子水平响应的敏感性差异,并基于分子效应可以对不同环境样品的毒性潜力进行评估;而且,将初始分子响应与AOP结合可以找到环境样品最敏感的毒性效应终点,从而为后续建立不同水体环境监测与管理特异性指标体系提供方向。
与EDA常用的生物体外毒性测试手段相比,利用斑马鱼简化转录组集成测试能够反映生物的整体效应,不再局限于某种特定的效应终点,将其与EDA相结合,应用于环境水体复合污染的生物效应监测和关键毒害物质的鉴定研究中,为化学品优先管控提供指导。
此外,由于斑马鱼简化转录组集成测试平台灵敏度高,也适用于环境中低浓度暴露的风险评估,这就为水源水、饮用水等相对干净水体的风险评估提供了技术支撑,如对自来水厂出水或不同处理工艺段的水质评估提供测试手段。
5 结语(Conclusions)
由于目前化学品的多样性以及环境水体复合污染的复杂性,建立高效的生物测试是今后化学品与环境污染物毒性评估研究的必然趋势。随着技术的不断发展,越来越多的基于斑马鱼模型的毒性测试方法被开发应用,其在环境监测管理中的应用也逐渐普及。采用多种斑马鱼测试技术联用是今后斑马鱼毒理学模型的一个发展方向。斑马鱼简化转录组集成测试作为一种高效准确的集成测试方法,有广阔的应用前景。斑马鱼简化转录组集成测试,包括毒理基因组学、胚胎毒性测试、行为分析测试,与传统动物测试相比,不仅大大提高测试通量与效率,降低测试成本,并且从生物多层次(分子、细胞、组织、器官、个体)水平表征化学品毒性,揭示化学品毒性致毒机制信息,帮助构建分子水平到毒性效应终点联系,为基于“毒性通路”的预测毒理学应用于化学品毒害风险识别提供新机遇。另外,该测试技术可在环境风险评价中起到重要作用:一方面,可利用该集成测试技术建立毒性信息更为全面的化学品毒性数据库,将分子指标、个体指标及化学品结构信息相关联,为关键致毒化学品溯源及优控管理提供数据基础;另一方面,该集成测试技术可应用于复合污染的研究中,为样品中关键致毒物质筛查提供新的解决思路。

