Fenton氧化法去除废水中青霉素的降解规律及其动力学模型
奚世超,曹卫宇,徐大刚,袁 宸
(上海化工研究院有限公司,上海 200062)
青霉素属于β-内酰胺环类抗生素,是人类最广泛使用的一类抗菌药物。此类抗生素通过与细菌表面的青霉素结合蛋白结合干扰细胞壁的合成,从而产生抗菌作用,具有抗菌活性强、毒性低、价格低的优点。由于青霉素抑菌性能好,其废水在处理过程中可生化性能较差。若处理不当,青霉素进入环境中将产生严重危害[1]。因此,青霉素废水的处理应受到重视。
Fenton试剂由于氧化效率高、经济性好、操作简单等优点被广泛运用于难降解有机物的处理[2-4]。关于Fenton法处理各类废水废气的动力学研究已有较多报道[5-8],并且有大量试验研究证明,Fenton法运用于抗生素废水的处理是可行的。李魁晓等[9]采用Fenton法降解土霉素废水,在10 min内降解率可达100%。李再兴等[10]对青霉素和土霉素混合废水的二级处理出水进行深度处理,反应60 min后,COD去除率可达75%以上。Homem等[11]研究了Fenton法降解阿莫西林废水,采用正交试验设计,得到了最优的降解工艺条件。目前,Fenton法处理抗生素的研究更多倾向于研究工艺条件的优化,而对抗生素降解规律、反应动力学的研究较少。反应动力学是理论指导实践的重要参考依据,非常有必要对其进行研究。
1 材料与方法
1.1 主要试剂及仪器
青霉素钠(PGN)粉剂(纯度大于99%,华北制药集团嘉华化工有限公司)为工业级;甲醇、硫酸、氢氧化钠、FeSO4·7H2O、30%H2O2均为分析纯;试验用水为蒸馏水。
超高效液相色谱仪(UPLC H-Class,Waters)、恒温振荡器(SHA-B,常州国华电器有限公司)、pH计(FE20,Mettler Toledo)、液相质谱联用仪(TSQ Quantum Ultra,赛默飞)、COD测定仪(DR3900,哈希)
1.2 试验方法及原理
1.2.1 试验方法
取PGN粉剂配制一定浓度的青霉素溶液100 mL,用硫酸溶液调节pH值为3±0.1,加入一定量硫酸亚铁固体,恒温振荡一段时间,加入双氧水开始反应并计时,每隔一定时间取样。
1.2.2 分析方法
BOD5检测:采用现行标准《水质 五日生化需氧量(BOD5)的测定 稀释与接种法》(HJ 505—2009)进行测定。
青霉素检测:每次取样1 mL,加入到15 mL甲醇中,终止Fenton反应;将溶液过0.22 μm滤膜后,用超高效液相色谱仪测定,以峰面积对照标准曲线测出PGN的含量。
液相条件:色谱柱为Waters Atlantics T3液相色谱柱(150 mm×4.6 mm,5 μm);流动相为0.2%甲酸乙腈溶液-0.1%甲酸水溶液(V∶V=95∶5);洗脱方式为等度洗脱;检测波长为255 nm;流速为250 μL/min。
质谱条件:电喷雾电离(ESI),负离子扫描;喷雾电压为3.5 kV;锥孔电压为50 V;毛细管温度为325 ℃;扫描时间为0.1 s;壳气压为15 psi;辅助气压为5 psi;采用多反应监测模式(SRM)检测。
1.2.3 数据处理方法
试验获得的数据采用Excel处理并拟合方程;由Origin 9.0作图。
1.2.4 试验原理
前期预试验发现,Fenton试剂在pH=3的时候催化氧化青霉素的效果最好。在此前提条件下,进行Fenton反应的动力学研究。建立表观动力学方程如式(1)和式(2)。
(1)
(2)
其中:K—总反应速率常数;
k0—指前因子;
Ea—活化能,kJ/mol;
T—是反应温度,K;
R—普适常数,8.314 J/(mol·K);
t—反应时间,min;
[Fe2+]、[H2O2]、[PGN]—Fe2+、H2O2、PGN的浓度,mol/L;
α、β、γ—[Fe2+]、[H2O2]、[PGN]的反应级数。
研究过程中,采用初始浓度法[12]计算青霉素的反应速率。在不同时间取样测定PGN含量,获得多个数据点后以时间t为横坐标,[PGN]为纵坐标,拟合曲线(y=B1x4+B2x3+B3x2+B4x+A),求出t=0时刻的反应速率v0。
t=0时刻,PGN、Fe2+、H2O2的浓度分别为[PGN]0、[Fe2+]0、[H2O2]0,同时对式(1)两边取对数,如式(3):

(3)
由式(3)可知,固定其中两个变量的初始浓度,第三个变量的初始浓度的对数值与反应速率的对数值为一元线性关系,各个变量的反应级数即为对应的斜率值。
确定各个变量的反应级数后,改变不同的温度进行反应,可以通过计算来确定活化能Ea和指前因子k0。
2 结果与讨论
2.1 不同初始PGN浓度的影响
按照试验方法,对不同初始浓度的PGN溶液进行降解反应。试验条件:pH值为3±0.1,[Fe2+]=1 000 mg/L,T=30 ℃,[H2O2]=2 200 mg/L。试验数据由Origin 9.0作图,如图1所示。

图1 PGN浓度对PGN降解的影响Fig.1 Effect of PGN Concentration on PGN Degradation
由图1可知,在不改变反应温度、Fenton试剂投加量的前提下,随着PGN浓度增大,初始反应速率也增大。在试验条件范围内,反应速率与初始浓度成正比,当初始浓度从2 000 mg/L增加到4 000 mg/L时,反应速率由192 mg/(L·min)增大到258 mg/(L·min)。PGN浓度越高,越容易与氧化剂发生反应,初始反应速率也就越大。这一现象与李宏[13]的研究观点一致,反应物浓度的升高可以使强氧化剂的利用率得到提高。当反应物初始浓度从2 000 mg/L增加到4 000 mg/L,PGN的除去率从95.3%下降到79.8%,主要原因是氧化剂用量不足,随着反应物初始浓度提高,如果要达到相同的除去率则需要更多的氧化剂量。反应40~100 min,不同初始浓度下的反应速率基本趋于一致,除去率在这段时间内均提高了5%~10%。这一时段内,氧化降解的作用减弱,导致其除去率增长的主要原因是混凝作用[14]。
2.2 不同初始Fe2+浓度的影响
按照试验方法,对不同初始Fe2+浓度的PGN溶液进行降解反应。试验条件:pH值为3±0.1,[PGN]=3 000 mg/L,T=30 ℃,[H2O2]=2 200 mg/L。试验数据如图2所示。
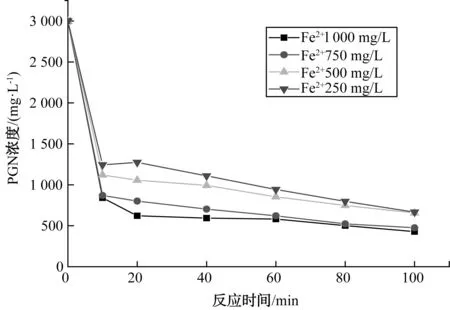
图2 Fe2+浓度对PGN降解影响Fig.2 Effect of Fe2+ Concentration on PGN Degradation
由图2可知,Fe2+的浓度对氧化PGN的速率有较大影响。在试验范围内,随着初始Fe2+浓度升高,PGN降解速率增大。由表1的试验数据可知,当Fe2+的浓度从250 mg/L增加到500 mg/L时,降解速率增幅为11.46%;从500 mg/L增加到750 mg/L时,降解速率增幅为13%;而从750 mg/L增加到1 000 mg/L时,降解速率增幅仅为6%。导致增幅下降的原因主要是羟基自由基(·OH)的产生速率增幅降低——由于氧化剂的用量是一定的,即使增大催化剂的用量,也只能在一定程度上加快·OH的产生速率。反应初期,Fe2+浓度较高,能促使H2O2快速分解产生大量的·OH[15]与溶液中的PGN反应,因此反应初期速率大;随着反应的进行,Fe2+、H2O2被消耗,·OH的产生速率变慢,并且有降解产物同时也在消耗氧化剂,导致后续反应速率减小。由图2可知,PGN的除去率随着Fe2+浓度的增大而增大,这可能是混凝作用造成的,也与相关的文献报道结论一致,即Fe2+浓度大,混凝的效果越明显[16]。
2.3 不同初始H2O2浓度的影响
按照试验方法,对不同初始H2O2浓度的PGN溶液进行降解反应。试验条件:pH值为3±0.1,[PGN]=3 000 mg/L,T=30 ℃,[Fe2+]=1 000 mg/L。试验数据如图3所示。
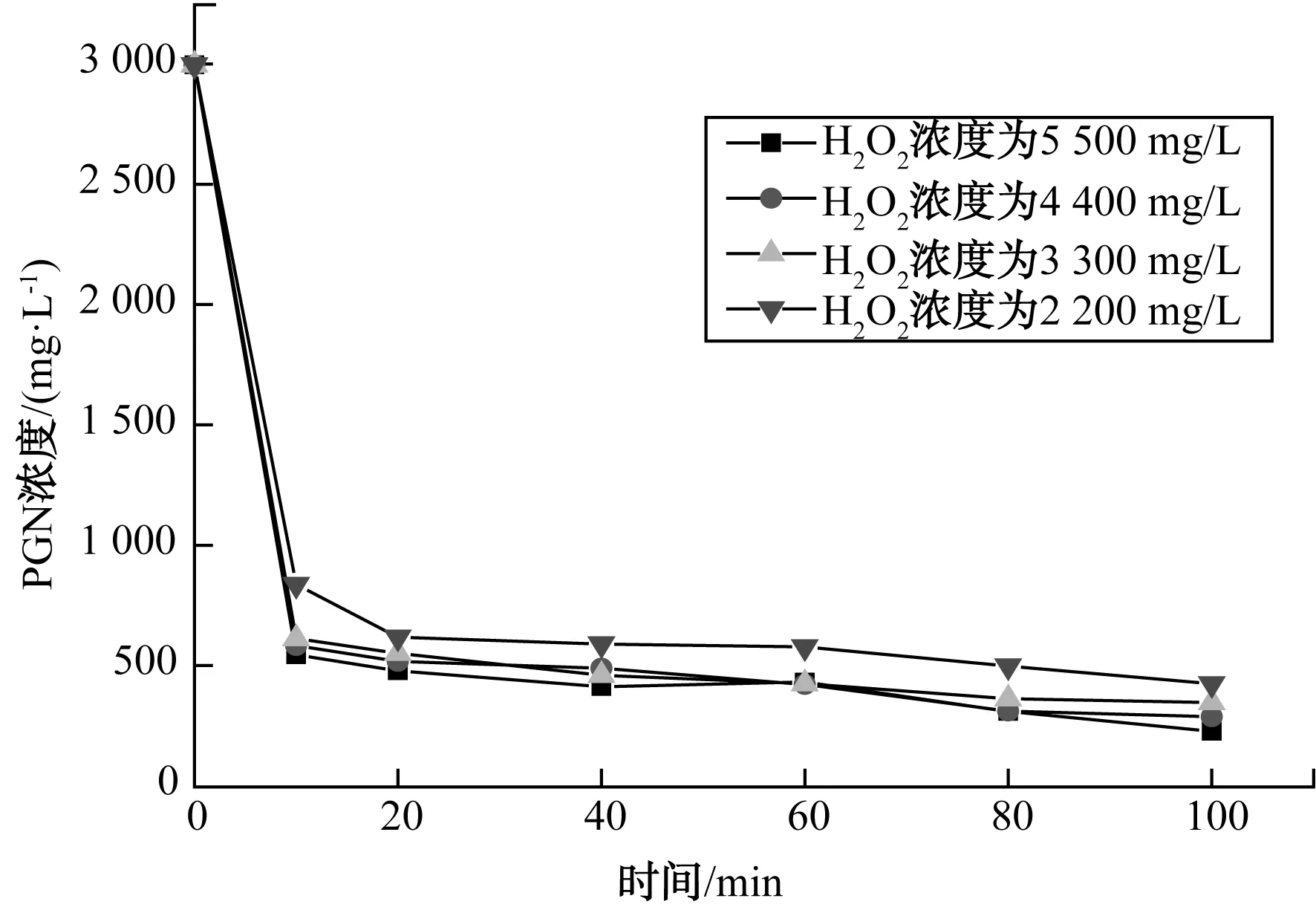
图3 H2O2浓度对PGN降解影响Fig.3 Effect of H2O2 Concentration on PGN Degradation
由图3可知,PGN除去率随着氧化剂用量的增大而增大,除去率从85.7%增加到92.3%。反应前20 min降解速率非常快;随着时间的延长,降解速率减小。由表1数据可知,氧化剂投加量的增加可以加快初始反应速率,但是随着投加量的增大,反应速率的增幅逐渐减小,当H2O2浓度大于4 400 mg/L时,增加氧化剂用量对氧化速率没有显著影响。这可能是因为初始Fe2+投加量一定,·OH的生成速率与催化剂浓度有关,也存在最大值;随着反应的不断进行,催化剂消耗且无法再生,·OH的生成速率降低,造成反应后期降解速率降低。因此,确定合适的催化剂和氧化剂用量比例关系有助于提高Fenton试剂的使用率和PGN的除去率。
2.4 不同反应温度的影响
按照试验方法,对不同初始温度的PGN溶液进行降解反应。试验条件:pH值为3±0.1,[PGN]=3 000 mg/L,[H2O2]=2 200 mg/L,[Fe2+]=1 000 mg/L。试验数据如图4所示。
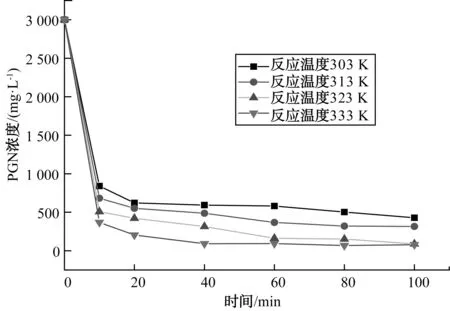
图4 温度对PGN降解影响Fig.4 Effect of Temperature on PGN Degradation
由图4可知,随着反应体系温度升高,PGN的降解速率增大,这一现象符合阿伦尼乌斯理论[12]。随着温度升高,降解速率从249.6 mg/(L·min)增加到295.5 mg/(L·min),增幅从3.8%提高到8.5%。从分子动力学角度分析,温度升高使得参与反应分子的平均动能增加,加速了·OH的生成,同时升高温度可以加快分子的运动,提高分子间的碰撞频率,因此降解PGN的初始反应速率增大。随着反应温度从303 K升高到333 K,PGN除去率也有所提高,除去率从85.7%增加到97.4%。因此在试验条件范围内,升高温度有利于提高PGN的除去率。
2.5 表观反应动力学模型建立
Fenton法氧化降解PGN的反应过程十分复杂,会产生多种中间产物。为了降低中间产物的干扰,采用初始浓度法进行动力学研究,根据图1~图4拟合方程得到的参数如表1所示。
根据表1的试验数据并结合试验原理,计算得出[Fe2+]、[H2O2]、[PGN]的反应级数分别为α=0.214 1、β=0.103 9、γ=0.428 5。
在已知α、β、γ的基础上计算指前因子k0和反应活化能Ea。对式(1)、式(2)两遍同取自然对数,得到式(4)、式(5)。
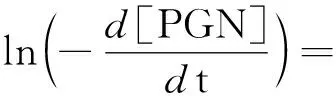
(4)
(5)
根据计算所得数据作lnK-1/T图,如图5所示。
计算得出k0=0 151 mol0.253 5·L-0.253 5·min-1,Ea=4.66 kJ/mol。
因此,整个反应的表观动力学方程如式(6)。

(6)
此动力学模型是基于反应初始阶段的数据拟合获得的,符合反应初始阶段的反应情况,但是可能会高估整个降解反应的反应速率[15,17]。由试验数据以及拟合动力学方程可知,Fenton法降解青霉素的初始反应速率受到PGN初始浓度的影响最大。[H2O2]的反应级数(0.103 9)小于[Fe2+]的反应级数(0.214 1),说明Fe2+浓度的影响比H2O2浓度大。这一现象的原因在于,氧化降解青霉素的是·OH,因而Fe2+催化分解H2O2生成·OH的反应对整体反应速率的影响较大。反应活化能Ea较小,说明该反应容易发生。
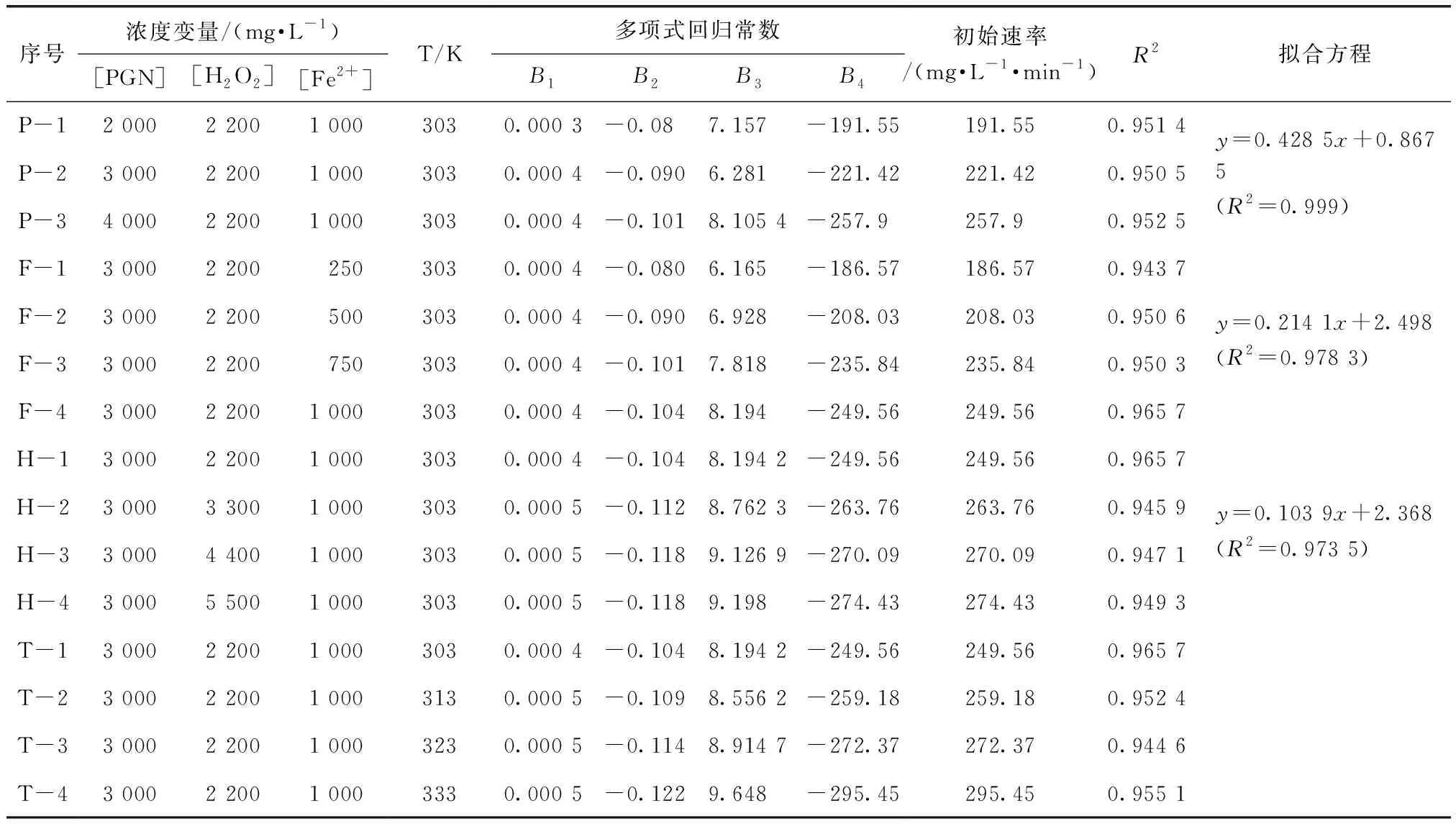
表1 不同操作条件对初始反应速率的影响Tab.1 Effect of Various Operational Conditions on Initial Reaction Rate by Fenton Process
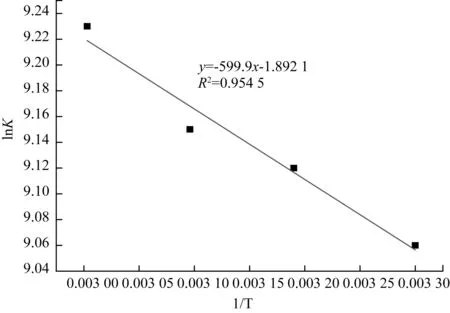
图5 lnK与1/T的关系Fig.5 Correlation between lnK and 1/T
2.6 处理前后溶液COD和BOD5/COD的变化
为了进一步明确Fenton法处理青霉素的效果,在上述Fenton法处理PGN溶液的条件下,对比了处理前后COD以及BOD5/COD的变化情况,试验数据如表2所示。
由表2可知,青霉素溶液的COD除去率达到59.6%,BOD5/COD的数值从0.011增加到0.377,可生化性能得到提高。青霉素由于其自身的抑菌性质,溶液的可生化能力较差,反应后BOD5/COD的数值显著提高,可生化性能增强,原因可能是PGN分子中主要的抑菌结构β-内酰胺环遭到破坏,反应后的产物失去了抗菌活性。
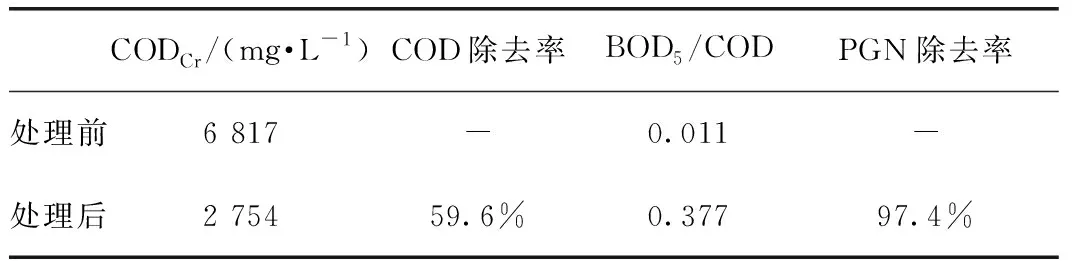
表2 溶液处理前后的COD和BOD5/CODTab.2 CODCr and BOD5/COD before and after Treatment
2.7 青霉素降解产物分析
在多反应监测模式下监测了6对离子(含青霉素),并通过液相分离,确定了各个产物的出峰时间和质谱信息。经过多次重复试验分析,产物中包含文献[18]提及的青霉噻唑酸(penicilloic acid)、去羧青霉噻唑酸(penilloic acid)和异青霉二酸(isopenillic acid),以及未提及的化合物A和B。根据化合物A、B的质谱信息推断其可能的结构,如图6所示。
由图7的质谱离子流图可知,6种物质得到了较好的分离。在液相分离的基础上获得了产物准确的质谱信息,如表3所示。
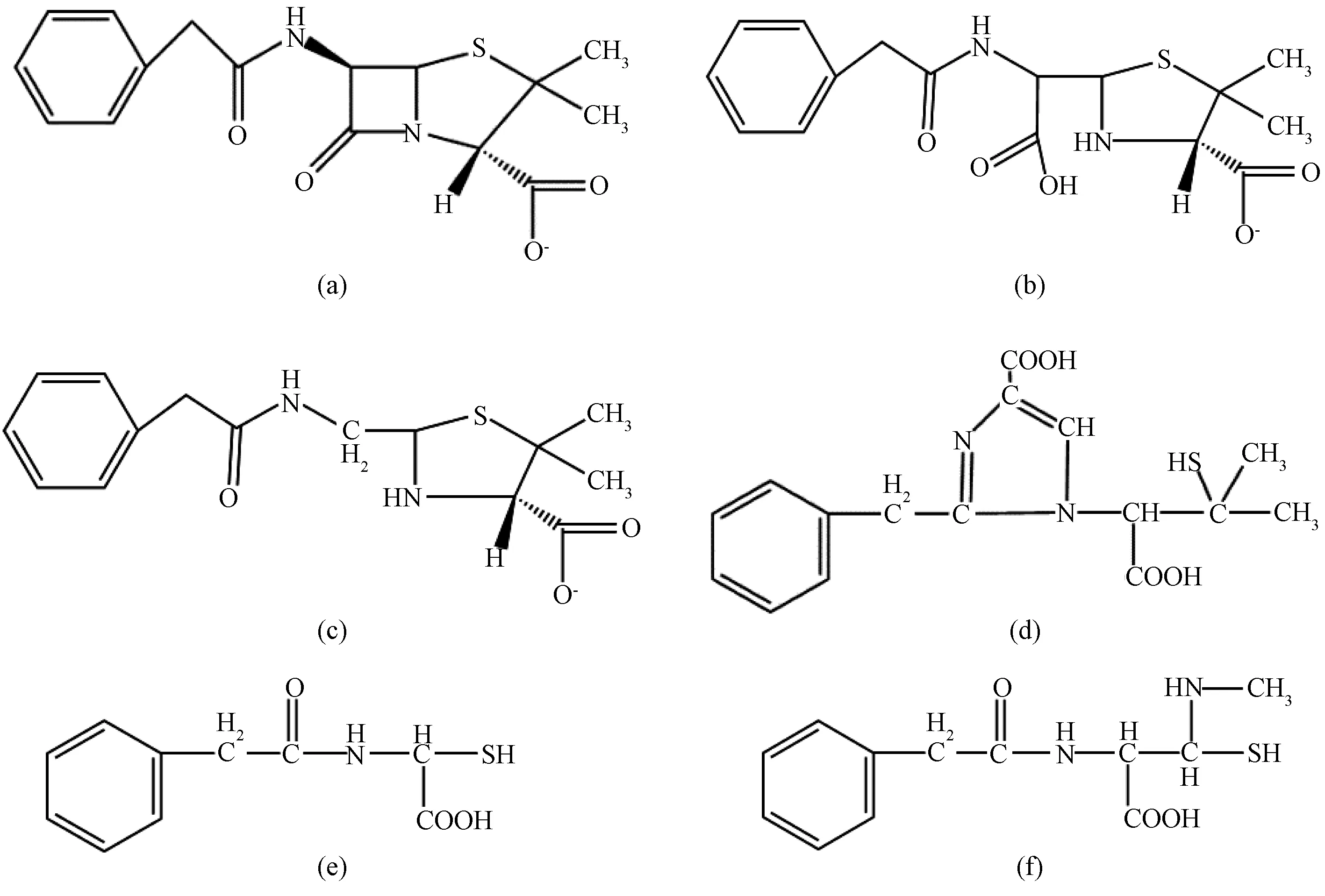
图6 青霉素降解产物(含青霉素)结构式 (a)青霉素;(b)青霉噻唑酸;(c)去羧青霉噻唑酸;(d)异青霉二酸;(e)化合物A;(f)化合物BFig.6 Structural Formulas of Penicillin Degradation Products (including Penicillin) (a) Penicillin;(b) Penicilloic Acid;(c) Penilloic Acid;(d) Isopenillic Acid;(e) Compound A;(f) Compound B
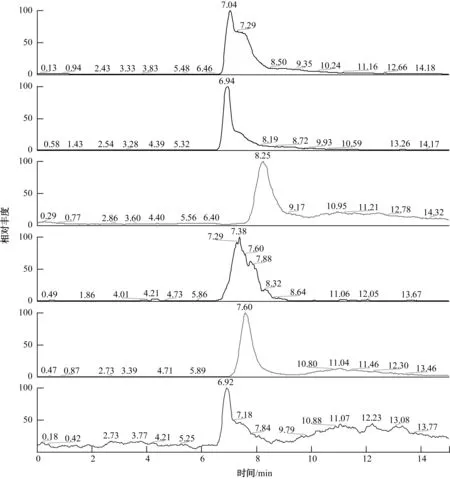
图7 青霉素降解产物(含青霉素)的选择离子流图Fig.7 Selected Ion Chromatograms of Penicillin Degradation Products (including Penicillin)
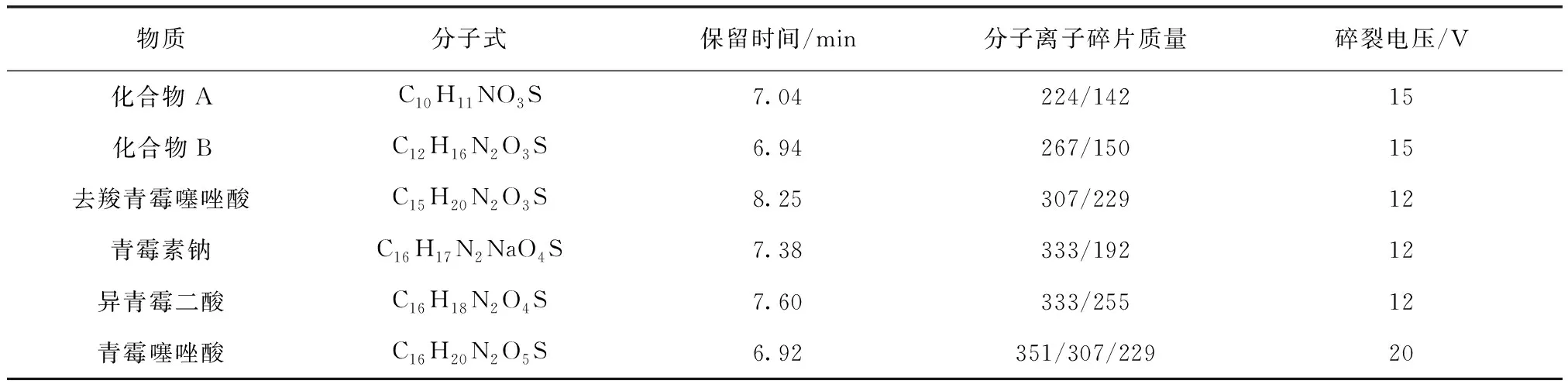
表3 青霉素降解产物(含青霉素)质谱参数Tab.3 MS Parameters of Penicillin Degradation Products (including Penicillin)
研究过程中发现,Fenton法降解青霉素的反应是一个非常复杂的过程,涉及的反应可能包括青霉素自身的水解、异构重排、开环、氧化等,同时还可能包括某些产物的氧化、水解、异构等反应。根据产物的分析结果,推测其可能的降解路径如图8所示。

图8 青霉素可能的降解路径Fig.8 Conceivable Degradation Pathways of Penicillin
青霉素中β-内酰胺环的C-N键容易断裂,生成青霉噻唑酸;脱羧之后生成去羧青霉噻唑酸,或者发生异构重排生成异青霉二酸;再或者由青霉素钠和青霉噻唑酸发生一系列复杂反应后生成化合物A、B以及一些未知产物。产物结构中的内酰胺环被破坏,青霉素失去药效,并且有羧基生成。青霉素溶液可生化能力较差,经Fenton法处理后,内酰胺环被破坏,抑菌能力变弱,提高了后续处理的可生化能力。这也与前面分析的结论一致。
3 结论
(1)在试验条件范围内,拟合得到了Fenton法降解青霉素的表观动力学方程,3个因素对降解速率的影响程度由大到小分别为:PGN浓度>Fe2+浓度>H2O2浓度。该反应的活化能为4.66 kJ/moL,较低的活化能表明Fenton法降解青霉素反应容易发生。
(2)Fenton试剂能有效降解模拟废水中的青霉素,当PGN为3 000 mg/L、H2O2投加量为2 200 mg/L、Fe2+投加量为1 000 mg/L、反应温度为333 K时,反应100 min后PGN的除去率可以达到97.4%。在试验条件范围内,确定氧化剂和催化剂的合理投加量有利于提高Fenton试剂的利用率;升高反应温度有利于提高青霉素的去除率。
(3)试验分析表明,青霉素有效官能团被破坏,处理后产物失去药效;处理后溶液COD去除率为59.6%,BOD5/COD从0.011增加到0.377,后续生物处理能力提高;主要降解产物为青霉噻唑酸、去羧青霉噻唑酸和异青霉二酸,以及未知化合物A和B。

