兰科菌根真菌对干旱胁迫下铁皮石斛生长和抗氧化能力及相关基因表达的影响
魏 明,童秦怡,柴瑞娟,丁佳红
(安徽工程大学 生物与化学工程学院,安徽芜湖 241000)
铁皮石斛(DendrobiumofficinaleKimura et Migo)为兰科石斛属珍稀药用植物[1],由于缺乏有效保护,野生铁皮石斛已处于濒危状态。随着植物离体繁殖技术的发展[2],铁皮石斛已经实现了规模化栽培,但是其药用品质不及野生铁皮石斛。因此,仿野生栽培成为提高铁皮石斛品质的有效途径。铁皮石斛属于喜阴植物,一般生长在空气湿润的地方,在铁皮石斛仿野生栽培过程中常遇到环境水分不足,最终影响铁皮石斛在野生环境中的正常生长。
水分是植物进行新陈代谢和生长发育的重要因子,水分不足会影响植物的生长[3]。干旱胁迫能引起植物体内的活性氧大量积累,而过多的活性氧会使细胞发生膜脂过氧化反应,细胞膜受到伤害,严重影响植物的生长[4]。植物体内的抗氧化酶可以清除多余的活性氧[5],维持细胞内活性氧代谢平衡,保护细胞内大分子物质,减少细胞膜损伤[6]。植物能通过调节抗氧化酶活性提高植株对干旱的耐受性[7]。
菌根技术是一种先进的真菌肥料技术,在自然界中,大多数石斛在生长过程中能与相应的真菌形成共生体[8]。研究表明,菌根真菌能促进石斛根系吸收水分和营养成分,增强植株抗病性和抗逆性[9,10],提高幼苗的生理活性,促进幼苗生长[11]。研究发现,适当干旱能提高石斛次生代谢产物的积累[12],对石斛药用品质的形成具有一定的作用。本试验通过接种菌根真菌来研究干旱胁迫下菌根真菌对铁皮石斛幼苗生长和抗氧化防御能力及其相关基因表达的影响,探讨兰科菌根真菌对铁皮石斛干旱胁迫的缓解作用及机制,为铁皮石斛的菌根化栽培提供理论依据,也为铁皮石斛仿野生化栽培提供方法,对提高铁皮石斛药用品质具有重要意义。
1 材料和方法
1.1 试验材料
铁皮石斛无菌苗由安徽工程大学组培基地提供,兰科菌根真菌(OM)为本实验室从野生金钗石斛中分离的丝核菌(编号为OM12),初步鉴定为角菌根菌属(Ceratorhizasp.),由本实验室保存;栽培培养基为粉碎的树皮,营养源为腐熟的豆饼。
1.2 试验设计
将菌种接种在PDA液体培养基中,28 ℃振荡培养4~6 d,得到液体菌剂备用。试验在安徽工程大学温室中进行,试验设计分为接种菌根真菌(+M)和不接种菌根真菌(-M)两种处理,选生长一致的铁皮石斛无菌苗(苗高4 cm左右)为原始试验材料,以盆栽的方式进行培养。栽种之前,盆子和培养基质进行灭菌处理,培养温度为(25±0.5) ℃, 相对湿度为80%,光照强度为200 μmol·m-2·s-1,光照时间为12 h/d,培养基中添腐熟的豆饼作为营养源,树皮和豆饼的比例为7∶3。菌根真菌接种时,每次接种菌剂10 mL,每隔6 d接种1次,连续接种3次,以不接种真菌作为对照(-M),培养30 d后获得菌根化苗(+M)和非菌根化苗(-M)。
挑选长势一致的菌根化苗和非菌根化苗进行干旱模拟试验。为了模仿自然环境的干旱情况,试验设计不同水分处理,包括正常水分对照组(well watered ,简写CK,培养基质持水量75%~80%)、轻度干旱胁迫(light drought stress, 简写LS,培养基质持水量为55%~60%)、中度干旱胁迫(moderate drought stress,简写DS,培养基质持水量为40%~45%)和重度干旱胁迫(severe drought stress,简写SS,培养基质持水量为25%~30%)。每个处理包含菌根化苗(+M)和非菌根化苗(-M)2种材料,每个处理10盆,每盆3株。用时域反射仪(TZS-1R,北京博普特科技有限公司)检测培养基质中的水分含量,水分不足时进行补水,并记录补水量,使各个处理水分稳定在设定的范围内。培养时间从2017年4月至2017年9月,培养结束后测定各项指标。
1.3 测定指标及测定方法
1.3.1菌根化苗鉴定和生物量参考Biermann和Linderman[13]描述的方法鉴定菌根的形成情况。将每盆新鲜石斛幼苗取出培养基,用自来水冲洗干净,再用吸水纸吸干幼苗表面水分。按根和茎叶分开,测定株高,再分别称取根部和地上部分的生物量, 5个重复取平均值。
1.3.2相对含水量和脯氨酸含量相对含水量用烘干法测定[14]。取新鲜叶片0.5 g,放入装满蒸馏水的试管中,避光放置24 h,叶片充分吸水后,取出叶片,擦干表面水分,称量饱和鲜重,然后放入干燥箱中于105 ℃烘干至恒重,称其干重,重复3次取平均值。相对含水量(RWC, %)=(鲜重-干重)/(饱和鲜重-干重)。游离脯氨酸含量采用茚三酮比色法测定[14]。
1.3.3电解质渗透率和丙二醛含量电解质渗透率用相对电导率表示,相对电导率采用电导仪法测定[14]。取新鲜叶片0.5 g,用蒸馏水洗净后,除去叶片表面水分,放入装有10 mL去离子水的试管中,静置24 h后用电导仪测其初电导率(S1),再将试管放入沸水中煮大约15 min,直至叶片变黄,冷却后测定终电导率(S2)。相对电导率(EL, %)=(初电导率S1)/(终电导率S2)×100%。丙二醛(MDA)含量用硫代巴比妥酸(TBA)比色法测定[15]。

过氧化氢(H2O2)含量采用Uchida等[16]的方法进行测定。取新鲜叶片0.5 g,加入1∶1比例的丙酮,研磨成匀浆后离心,取1 mL上清液,加入0.2 mL硫酸钛和0.1 mL浓氨水,形成沉淀后离心,沉淀用丙酮洗涤3次后加入5 mL硫酸,于415 nm处进行比色测定吸光值,然后计算H2O2含量。H2O2含量(μmol·g-1)=(C×V)/(F×V1),C为标准曲线对应的H2O2的浓度(μmol·L-1);V为样品提取液体积(mL);V1为测定时样品提取液体积(mL);F为叶片鲜重(g)。
1.3.5抗氧化酶活性取1 g新鲜叶片加入20 mL磷酸盐缓冲液,在冰浴中研磨,离心后,上清液用于保护酶活性测定。超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性分别用SOD和CAT试剂盒测定,具体操作按试剂盒说明书进行;过氧化物酶(POD)用愈创木酚法测定[17],单位均为U·g-1。
1.3.6RNA提取及荧光定量PCR分析利用RNA提取试剂盒(上海生物工程公司)提取铁皮石斛叶片总RNA,利用反转录试剂盒(TaKaRa公司)进行反转录得到cDNA第一链,方法参照试剂盒说明书。以铁皮石斛肌动蛋白基因(β-actin)为内参基因[18],根据铁皮石斛POD基因设计半定量引物[19]。由于铁皮石斛SOD和CAT基因序列未知,从Genbank查找拟南芥、烟草、水稻、玉米、小麦等5种植物的SOD和CAT基因序列,利用DNAMAN软件做同源序列对比取得保守区段,设计简并引物。SOD-Up 5′-AAGAAGGCCGTCGCAGTCGT-3′,SOD-Down 5′-GGAGTCAAGCCATAACTCC-3′, CAT-Up 5′-ATGGATCCATACAAGTCGTCC-3′, CAT-Down 5′-TTATCCATGTGCCTGTAGT-3′。以合成的铁皮石斛cDNA为模板分别克隆SOD和CAT基因。使用近缘物种基因序列相似性的TBLASTX分析,对克隆到的铁皮石斛SOD和CAT基因片段进行鉴定。SOD基因片段与水稻中Cu/Zn-SOD(XP-015631402.1)基因序列相似度达到94%,CAT基因与玉米CAT3(L05934)基因序列相似度达到97%,因此可以用于设计引物(表1)。
利用SYBR Green试剂盒(Takara公司)进行荧光定量PCR分析,在AB17500荧光定量PCR仪上进行试验。反应体系(共20 μL):10 μL SYBR Primix Ex TaqTM,上下游引物各0.4 μL,cDNA 1.0μL,用ddH2O补足至20 μL;RT-PCR反应条件为:95 ℃预变性15 min,95 ℃变性15 s,57 ℃退火30 s,72 ℃延伸30 s,30循环,在72 ℃延伸步骤收集荧光信号后,采用2-ΔΔCT法进行相对定量分析,实验重复3次。

表1 荧光定量PCR引物序列
1.4 数据处理与统计分析
应用统计分析软件SPSS 17.0进行数据统计分析,采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同处理组间的差异显著性,显著性水平设定为α=0.05,采用Origin 8.6软件绘图。
2 结果与分析
2.1 OM真菌对干旱胁迫下铁皮石斛生长的影响
由表2可知,干旱胁迫抑制了铁皮石斛幼苗的生长,铁皮石斛株高和生物量随着干旱胁迫程度的增加而逐渐降低;在重度干旱胁迫下,铁皮石斛幼苗生长缓慢,并伴有黄叶产生,生物量也最低。接种OM真菌可以缓解干旱胁迫,无论是正常水分,还是干旱胁迫,接种OM真菌后,铁皮石斛幼苗生长比较旺盛,产生新根多,株高、根重、茎叶重和总生物量均不同程度高于未接种组,且在正常水分和在重度干旱胁迫下达到显著水平(P<0.05)。可见,OM真菌能有效缓解干旱胁迫对铁皮石斛幼苗生长的抑制作用,促进铁皮石斛幼苗生长。
2.2 OM真菌对干旱胁迫下铁皮石斛叶片相对含水量和脯氨酸含量的影响
植物叶片的相对含水量反映了植物在干旱胁迫下整体水分亏缺状况,而游离脯氨酸是植物体内较为重要的渗透调节物质。由图1, A、B可知,随着干旱程度的增加,接种和不接种OM真菌的铁皮石斛叶片相对含水量均逐渐降低,而其叶片游离脯氨酸含量均逐渐增加。在正常水分下,接种OM真菌对铁皮石斛叶片中相对含水量和游离脯氨酸含量影响不显著;在干旱胁迫下,接种OM真菌能显著增加叶片的相对含水量,降低叶片中游离脯氨酸的含量(P<0.05)。可见,OM真菌能够改善铁皮石斛水分代谢,缓解干旱胁迫下水分亏缺,促进铁皮石斛生长。
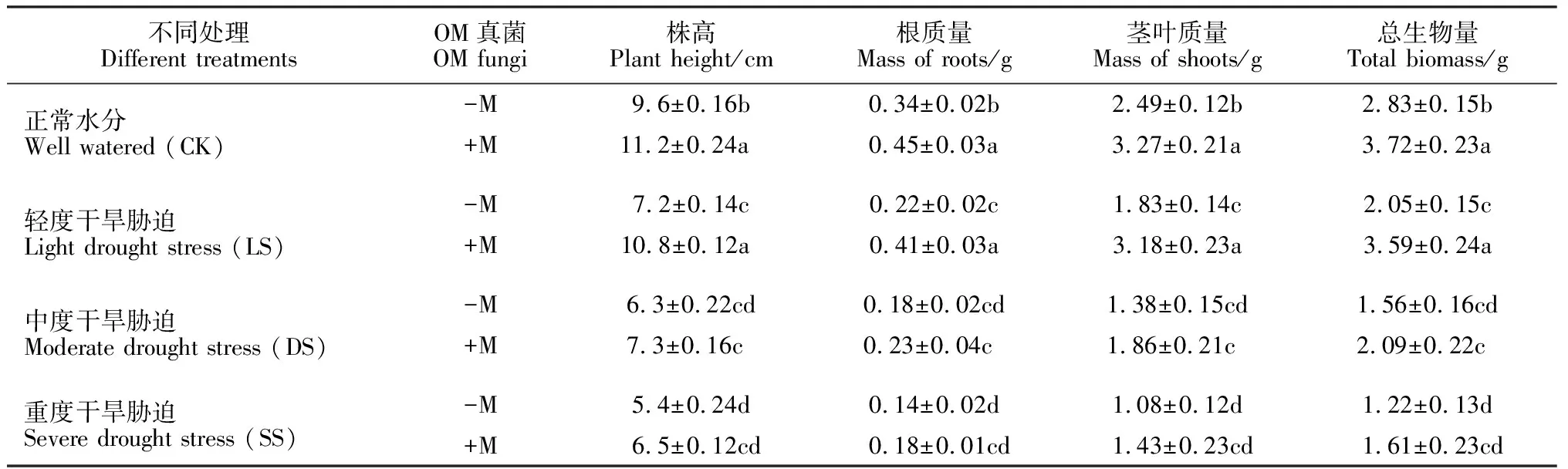
表2 OM真菌和干旱处理下铁皮石斛幼苗的生长变化
注:表中各列的不同字母表示处理间在0.05水平差异显著;-M. 未接种OM真菌;+M. 接种OM真菌;下图同
Note:The different normal letters in same column of table mean significantly different among treatments at 5% level; -M. Non-inoculated OM fungi; +M. Inoculated OM fungi; The same as below figures
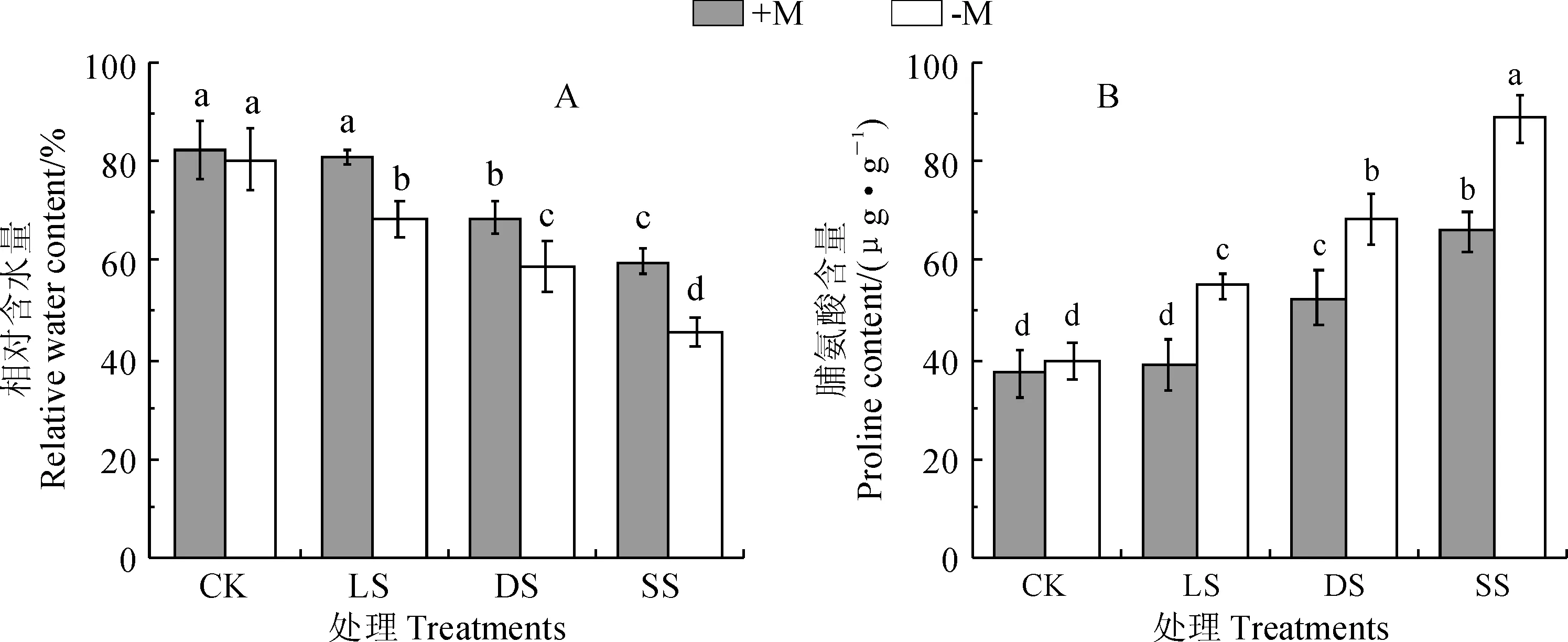
图1 OM真菌和干旱处理下铁皮石斛叶片相对含水量和脯氨酸含量变化Fig.1 The changes of relative water content and proline content in leaves of D. officinale seedlings with OM fungus treatment under drought stress
2.3 OM真菌对干旱胁迫下细胞膜稳定性的影响
电解质渗透率是评价植物细胞膜稳定性的一个重要指标,而丙二醛(MDA)是植物细胞膜脂过氧化反应的产物之一,MDA的含量通常用来衡量膜脂过氧化的程度,反映了细胞膜受损程度。由图2, A、B可知,随着干旱胁迫程度的增加,接种和不接种OM真菌的铁皮石斛叶片的电解质渗透率和MDA含量均逐渐增加;接种OM真菌可以显著降低干旱胁迫下叶片的电解质渗透率和细胞内MDA含量(P<0.05)。植物在干旱胁迫下,产生的活性氧增多,会增加细胞膜脂过氧化反应,增加MDA含量,而OM真菌能降低膜脂过氧化反应,降低MDA含量,缓解干旱胁迫对细胞膜的损伤,提高细胞膜的稳定性。
2.4 OM真菌对干旱胁迫下超氧阴离子和H2O2含量影响
2.5 OM真菌对干旱胁迫下铁皮石斛抗氧化酶活性的影响
SOD、POD和CAT是植物体内重要的保护酶,其活性与植物的抗旱性密切相关。由图4可知,随着干旱胁迫程度的增加,接种和不接种OM真菌铁皮石斛叶片SOD(图4, A)、POD(图4, B)和CAT(图4, C)的活性均表现出先增加后下降的变化趋势,并均在中度干旱胁迫下达到最大值,且各干旱胁迫处理均显著高于相应正常水分对照;与不接种处理相比,接种OM真菌显著提高了铁皮石斛叶片的抗氧化酶SOD、POD和CAT的活性。因此,干旱胁迫能显著诱导增强铁皮石斛幼苗叶片中抗氧化酶活性,OM真菌对抗氧化酶活性的增强有显著促进作用,从而提高植株的抗旱能力。
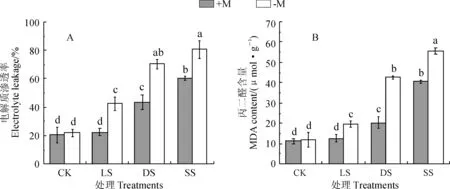
图2 OM真菌和干旱处理下铁皮石斛叶片电解质渗透率和丙二醛含量变化Fig.2 The changes of electrolyte leakage and MDA content in leaves of D. officinale seedlings with OM fungus treatment under drought stress
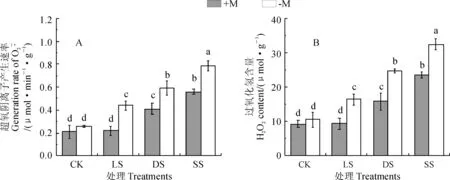
图3 OM真菌和干旱处理下铁皮石斛叶片产生速率和过氧化氢含量变化Fig.3 The changes of generation rate of and H2O2 content in leaves of D. officinale seedlings with OM fungus treatment under drought stress
2.6 OM真菌对干旱胁迫下铁皮石斛抗氧化酶基因表达的影响
定量RT-PCR结果表明,随着干旱程度的增加,接种和不接种OM真菌铁皮石斛幼苗叶片内SOD(图5, A)、POD(图5, B)和CAT(图5, C)基因的相对表达量均先增加后降低,并均在中度胁迫下达到最大值,而在重度干旱胁迫下各基因的表达量均有所降低,但仍显著高于正常水分对照;与不接种处理相比,接种OM真菌处理的基因表达量均不同程度提高,且大多达到显著水平。说明适当的干旱胁迫诱导了铁皮石斛幼苗叶片内SOD、POD和CAT基因的表达,而接种OM真菌能进一步提高SOD、POD和CAT基因的表达,这与SOD、POD和CAT活性变化相一致。可见,干旱胁迫下,OM真菌可以通过诱导抗氧化酶基因的表达,提高抗氧化酶活性,有效缓解干旱胁迫对铁皮石斛幼苗的伤害。

图4 OM真菌和干旱处理下铁皮石斛抗氧化酶活性变化Fig.4 The changes of antioxidant enzyme activities in D. officinale seedlings with OM fungus treatment under drought stress
3 讨 论
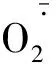

图5 OM真菌和干旱处理下铁皮石斛抗氧化酶基因表达Fig.5 The expression of antioxidant enzyme genes in D. officinale seedlings with OM fungus treatment under drought stress
植物的抗逆性与其抗氧化防御系统活性密切相关,干旱胁迫下,细胞内会产生更多的活性氧,细胞内自由基平衡被打破,自由基含量增加,造成膜脂过氧化,产生较多的MDA,使细胞膜结构受到损伤,从而影响植物生长[25],同时干旱胁迫能诱导提高植物体内抗氧化酶活性,增强植物对干旱环境的耐受性[26]。在植物抗氧化系统中,SOD、POD和CAT等抗氧化酶能清除多余的活性氧,减轻活性氧对植物细胞的伤害,以维持植物的正常生理代谢[27]。同时,POD还是多功能酶,对植物的生长还具有调节作用。植物的保护酶系统可以在菌根真菌的诱导下提高其活性,维持细胞内自由基的平衡,确保细胞的正常生理功能。如在干旱胁迫下,丛枝菌根真菌能提高小麦[28]和柏树[29]抗氧化酶活性,增强幼苗对干旱的耐受性。本研究表明,接种OM真菌上调了干旱胁迫下SOD、POD和CAT基因的相对表达量,也不同程度地提高了干旱胁迫下铁皮石斛SOD、POD和CAT等抗氧化酶活性,说明OM真菌通过调控多种抗氧化酶活性来增强铁皮石斛幼苗的抗旱能力,并从分子水平参与了干旱胁迫下抗氧化防御系统的活动。
总之,OM真菌通过与铁皮石斛形成菌根共生体后,显著提高了铁皮石斛幼苗在干旱胁迫下的含水量,改善了干旱情况下植株的水分代谢。通过上调抗氧化酶SOD、POD和CAT基因的表达,显著提高了SOD、POD和CAT等抗氧化酶活性,有效缓解了干旱胁迫导致的氧化损伤,稳定了细胞膜结构,增强了铁皮石斛幼苗对干旱环境的适应能力,促进铁皮石斛幼苗生长。因此,菌根化栽培能提高铁皮石斛幼苗的抗旱性,为铁皮石斛的仿野生栽培提供了依据。

