前增菌时间对生禽肉中沙门菌检验的影响研究
◎ 朱应飞,曾春华,吴 鑫,翟平平,范宏伟,姚小英
(1.江西省食品检验检测研究院,江西 南昌 330000;2.江西农业大学,江西 南昌 330000)
1 材料与方法
1.1 材料
1.1.1 菌种
鼠伤寒沙门菌(ATCC14028),购自广东微生物菌种保藏中心。
1.1.2 主要仪器
42 ℃恒温培养箱,36 ℃恒温培养箱,拍击式均质器,电子天平。
1.1.3 培养基及试剂
平板计数琼脂(PCA)培养基、缓冲蛋白胨水(BPW)培养基、四硫磺酸钠煌绿增菌液(TTB)培养基、亚硒酸盐胱氨酸增菌液(SC)培养基、亚硫酸铋琼脂(BS)培养基,均购自青岛海博生物技术有限公司;沙门菌显色培养基,购自郑州博赛生物技术股份有限公司;56种沙门菌诊断血清,购自宁波天润生物药业有限公司。
1.2 方法
1.2.1 沙门菌计数
鼠伤寒沙门菌(ATCC14028)纯培养物的计数采用倾注PCA平板计数。用0.85%的生理盐水将增菌液稀释成10-6、10-7、10-83个稀释度,每个稀释度做2块平皿,每块平皿加1 mL稀释液,倾注约20 mL温度为48 ℃的PCA琼脂,凝固后倒置36 ℃培养24 h后计数。
前文详细分析了换流器在发生不对称故障时计及两侧谐波的实际触发角和换相角计算原理,进而得到实际的熄弧角:
1.2.2 样品采集
样品采集时间为7月,分两次进行,每次采集10份,样品来自于各商场,每个商场每次采一份样,均为生禽肉,采样量约300 g,样品采集后用冰袋冷藏运输,3 h内开始检验。
1.2.3 前增菌和增菌
无菌取25 g样品分别加入到装有225 mL BPW的无菌均质袋中,用拍击式均质器拍打1 min。同时随机取一份样品加入10-7的沙门菌标准株稀释液770 μL,均质混匀作阳性对照。将样品混合物于36 ℃恒温培养,8 h后,摇匀,移取1 mL转种于10 mL TTB内,于42 ℃增菌培养24 h。同时移取1 mL转种于10 mL SC内,于36 ℃增菌培养24 h。8 h的前增菌液取样后立刻放回培养箱继续前增菌培养,前增菌18 h后,再摇匀,分别再取1 mL转种于10 mL TTB和SC中,分别于42 ℃和36 ℃增菌培养24 h。
1.2.4 分离和鉴定
增菌24 h后,各管TTB和SC分别摇匀,用不锈钢接种环划线各接种一个BS平板和一个沙门菌显色培养基平板,36 ℃培养。BS平板培养48 h,沙门菌显色培养基平板培养24 h。从BS平板上挑取黑色或棕褐色或灰色且菌落周围呈黑色或棕色的可疑菌落,从沙门菌显色培养基平板上挑取淡紫色可疑菌落,分别接种三糖铁(TSI)、赖氨酸脱羧酶、尿素、氰化钾、靛基质、甘露醇、山梨醇和ONPG。对生化反应阳性的可疑菌,从TSI转种营养琼脂,做菌体抗原(O)鉴定和鞭毛抗原(H)鉴定。
2 结果与分析
2.1 沙门菌计数结果
沙门菌纯培养稀释到10-6、10-7、10-8后,计数结果分别为141 CFU/mL、13 CFU/mL、2 CFU/mL。
2.2 沙门菌的样品检验结果
20份生禽肉样品的沙门菌定性检验情况见表1。20份生禽肉中,总共检出13份阳性,通过8 h前增菌检出8份,通过18 h前增菌检出9份,两个前增菌时间同时检出的有4份。
在分离平板上,鸡肫67和鸡丁76沙门菌呈优势生长。鸡丁64、鸡丁66和鸭肫80可疑平板上只有1~2个可疑菌落生长。鸡丁68、鸡丁70、鸡肫71、鸡丁72、鸡丁74和鸭肫77可疑平板上有3~5个可疑菌落生长。鸡肫69和鸡丁78可疑平板上有6个及以上可疑菌落生长。分离平板上均有60~120个不等的单菌落生长。
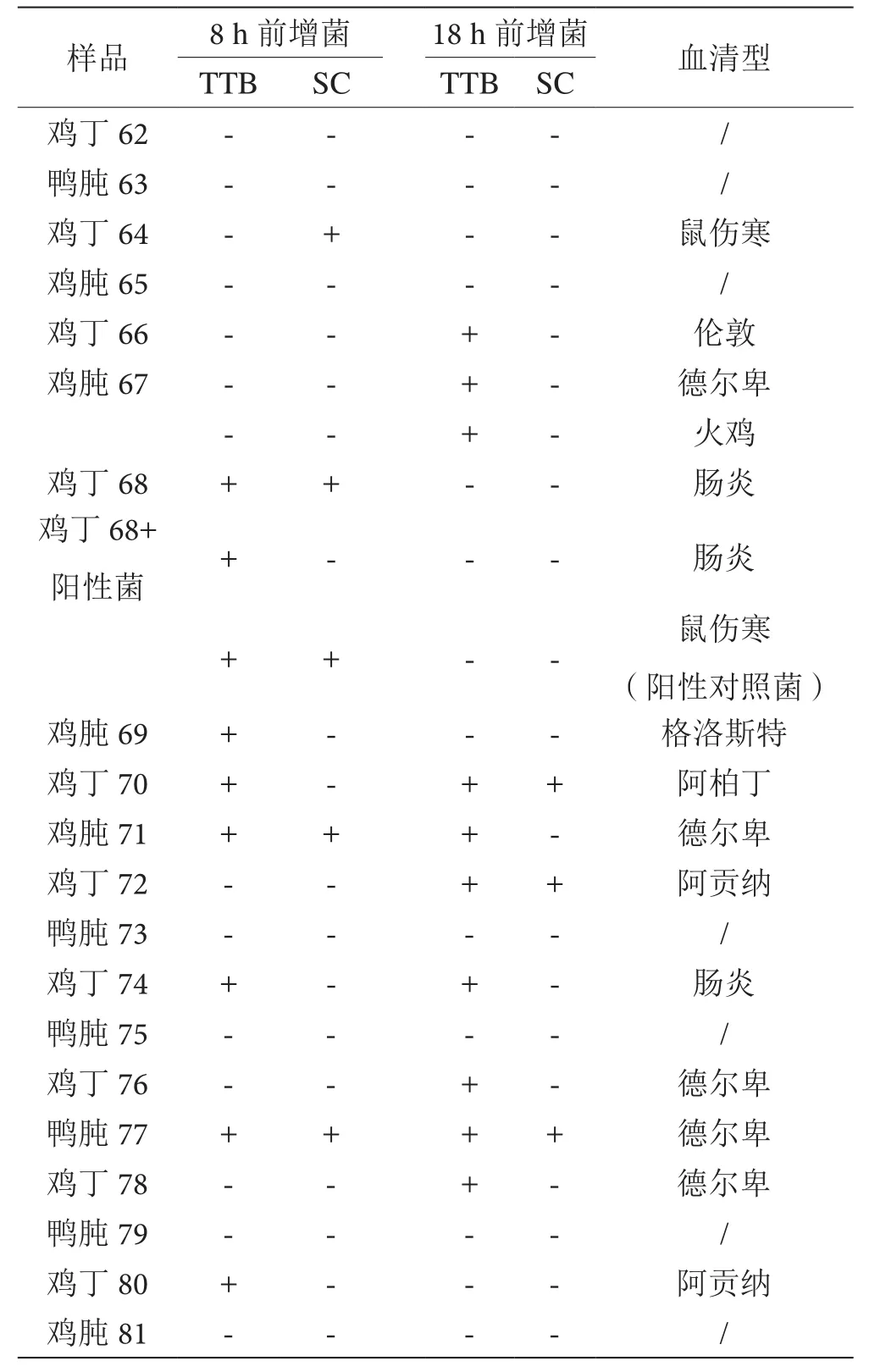
表1 生禽肉中沙门菌检验结果表
3 讨论
目前,国内和国际上沙门菌的检验的“金标准”方法[2-3]依旧是以White-Kauffmann抗原表为基础,依靠传统的前增菌、增菌、分离、生化鉴定和血清鉴定。由于增菌分离的培养基种类和质量的差异,样品基质复杂,尤其是样品中杂菌菌相复杂,影响了目标菌的检出,传统沙门菌检验面临的最大技术问题是假阴性。如何提高样品的阳性检出率显得尤为重要。
通过文献检索和多年对食品中沙门菌污染情况的监测,发现生禽肉和生畜肉中沙门菌的污染最为严重,相应的杂菌菌相复杂,生长旺盛,严重干扰了沙门菌的检验,极易造成假阴性,本研究选取生禽肉模拟杂菌菌相最为复杂、干扰最为严重的环境进行研究。鸡丁68号样品加入阳性对照菌,为保证能够取到菌而又尽量少的加入,本试验加入10-7标准株稀释液770 μL,约等于10 CFU鼠伤寒沙门菌量。
本研究共检测了20份样品,8 h前增菌和18 h前增菌的检出率分别为40%和45%,显著高于我国餐饮食品中沙门菌的检出率9.7%[4],显著高于合肥市屠宰生猪肉沙门菌的检出率13%[5],显著高于美国食品安全检验署公布的2012年生畜肉及生禽肉产品中沙门菌检出率(鸡肉4.3%、猪肉1.3%、牛肉0.0%、嫩牛肉1.1%、绞牛肉1.9%、鸡绞肉28%、火鸡绞肉11%和火鸡肉2.2%)[6],可见南昌市生禽肉的沙门菌污染非常严重。本研究共检出13份阳性,综合检出率为65%。张玲等[7]用美国农业部的方法对长春市的市售鸡胴体进行沙门菌监测,7月份检出率为100%,与之相较明显偏低,提示按现行国家标准检验,即使采用两个前增菌时间,依然存在漏检的可能。
本试验中,有5份样品在前增菌8 h未检出,前增菌18 h后有检出,表明在某些样品中,前增菌8 h并不能够充分复苏和增殖目标菌,过短的前增菌阶段容易造成目标沙门菌的丢失。另有4份样品在前增菌8 h有检出,前增菌18 h后未检出。前增菌18 h后,理论上沙门菌能得以更充分复苏和增殖,造成沙门菌反而丢失的原因是前增菌时间过长,使伴随沙门菌的非目标杂菌过度生长,竞争抑制甚至完全掩盖了沙门菌的增殖。阳性对照菌鼠伤寒沙门菌在8 h前增菌有检出,18 h前增菌后未有检出,也是同样的道理。
13份阳性样品中,有两份样品,其分离平板上只有1~2个可疑菌落。在增菌液中目标菌丰度低的情况下,从11 mL的增菌液中挑取5~20 μL进行划线,分离出1~2个可疑菌落这个过程本身具有很大的偶然性。这提示本试验检定的7份阴性样品中,有部分样品很可能存在沙门菌,由于前増菌和增菌时的竞争抑制作用,造成目标菌丰度低,接种环蘸取菌液时没能蘸取到目标菌,或者蘸取到少量的目标菌,但由于与能够在分离平板上良好生长的非目标杂菌比例过于悬殊,没能分离到目标菌,实际上是假阴性。
分离平板的选择效果是有限的,对于增菌液中目标菌丰度低的样品,划线分离平板上单个菌落的数量成了试验是否成功的另一关键,平板上的单个菌落越多,检出目标菌的可能性就越大,因此,在做分区划线分离时,应该尽量多地挑取菌液,第一区面积应该尽量小,其他区域划线在能够分开的前提下,尽量密,不留空白,这样才能最大限度地划出尽量多的单个菌落,最大可能地分离出目标菌。
有2份阳性样品,其目标菌在分离平板上呈优势生长,其他11份阳性样品中沙门菌的生长远不如杂菌生长旺盛,前增菌液培养基中没有加入任何抑菌成分,是杂菌生长最快的阶段,需要在前增菌时间上做出适当优化,选择一个最佳时间,在沙门菌充分复苏,增殖数量与杂菌增殖数量之比最大时完成前增菌,效果最佳。
4 结论
由于无法事先准确预知样品中杂菌污染情况,因此无法确定最佳前增菌时间,同时采用两个前增菌时间,可以大幅度提高检出目标菌的机会,同时,划线分离的平板数量加倍,划线分离的单个菌落数也会相应的增加,对于丰度低的沙门菌样品,可以大大提高其检出率。样品中目标菌可能会出现前增菌8 h不够充分复苏和增殖,而前增菌18 h造成杂菌过度生长。建议采用3个前增菌时间8 h、13 h、18 h。这样,在不至于增加太多的工作量的情况下,可以最大限度的提高目标菌检出率。样品在前增菌8 h时,甚至在前增菌之初,杂菌已经过度生长,目标菌在前增菌的开始阶段就被竞争抑制,按照现行的国家标准无法检测到目标菌,这就要求更好的选择性增菌效果和更高效的分离培养基,如何对增菌和划线分离进行优化,还有待进一步研究。

