补骨脂酚缓释片Beagle犬体内药代动力学研究*
★ 洪建华 雷志强(.南昌大学附属口腔医院/江西省口腔生物医学重点实验室 南昌330006;2.江西中医药大学 南昌 330004)
补骨脂酚是补骨脂中提取出的一种含量较高的单萜酚类化合物。本课题组前期药理研究表明补骨脂酚具一定植物雌激素活性,能同时激活ERα和ERβ转录活性,但对ERβ的激活大于ERα[1]。而激活ERβ的药物被认为是长期使用雌激素治疗雌激素相关疾病的更安全的替代品。结果揭示补骨脂酚在治疗妇女更年期综合征及其它与雌激素相关疾病方面可能是一个具良好开发前景的候选药物。
但补骨脂酚为水难溶性药物,在体内难以吸收,生物利用度低,本课题为增加补骨脂酚的溶解度和溶出速率,且维持稳定的体内血药浓度,利用固体分散及缓释制剂的技术将其制成补骨脂酚缓释片。
为了解补骨脂酚缓释片在Beagle犬体内的药代动力学特征,揭示其体内的缓释特征,本文拟建立Beagle犬血浆中补骨脂酚浓度的含量测定方法,考察了缓释片在犬体内的药动学特征,为新药开发奠定基础,保证补骨脂临床用药的有效性和安全性。
1 实验材料
1.1 仪器 Waters 515液相色谱仪,配置一元泵,手动进样器及Waters 2487检测器(美国,Waters公司),Empower数据处理软件。色谱柱:Hypersil ODS2色谱柱(250 mm×4.6 mm,5μm;中国,大连依利特分析测试公司)。
1.2 试药与试剂 补骨脂酚为本实验室制得,HPLC归一化结果显示纯度均大于98%,结构经NMR及MS鉴定;甲醇(色谱纯,天津市康科德科技有限公司);冰醋酸(色谱纯,天津市精细化工研究所);超纯水为Millipore超纯水净化系统制得(美国,Millopore公司);乙酸乙酯(分析纯,天津市化学试剂一厂)。
2 方法
2.1 色谱分析条件 流动相:0.2%冰醋酸水溶液(A)-甲醇(B)(10∶90);流速:1mL/min。检测波长:260nm。柱温:室温。进样量:10μL。
2.2 数据分析软件 利用SPSS 11.5软件进行统计分析。
2.3 对照品溶液的配制 精密称取补骨脂酚对照品4.632mg,置于100mL容量瓶中,少量甲醇溶解后,再用甲醇定容至刻度,配制成浓度为4.632μg/mL的储备液置于冰箱中备用。取上述储备液适量,用甲醇配成含补骨脂酚如下浓度的系列工作液:6.948,14.988,46.32,92.64,185.28,463.2 ng/mL。将上述储备液及工作液置于4℃冰箱中保存备用。
2.4 血浆样品的处理方法 冰冻犬血浆于水浴中融化,温度回至室温,再涡旋1min。取犬血浆200μL于1.5mL离心管内,涡旋混匀器上混匀30s,加入1mL的乙酸乙酯提取液,继续涡旋1min,将样品置于离心机中,4℃下14000 rpm离心10min,移取上层有机相至干净的1.5mL离心管中,于40℃水浴,空气吹干。残渣加入100μL甲醇,涡旋混匀器上震荡30s,超声1min,将溶解液置于离心机中,4℃下14000 rpm离心5min,取上清液10μL注入HPLC色谱仪,记录补骨脂酚的峰面积。
2.5 方法验证
2.5.1 专属性试验 分别取6只犬空白血浆各200μL,按“2.4 血浆样品的处理方法”项下操作,进样测定,获得空白血浆色谱图。取上述混合空白血浆,加入某一浓度混合工作液溶液50μL,其余按“2.4 血浆样品的处理方法”项下操作,进样测定,获得空白血浆外加对照品色谱图。
取健康犬灌胃给予补骨脂酚部位后的血浆样品,按“2.4 血浆样品的处理方法”项下操作,进样测定,获得给药后的血浆样品色谱图。
2.5.2 标准曲线的绘制、最低定量限的测定 取1.5mL的离心管,加入200μL的空白犬血浆,精密吸取50μL的补骨脂酚系列工作液,配成含补骨脂酚浓度为1.737,3.747,11.580,23.160,46.320,115.800 ng/mL 的血浆标准浓度溶液。涡旋混匀30s,按“2.4 血浆样品的处理方法”项下操作。以补骨脂酚在血浆中的标准浓度(C)为横坐标,补骨脂酚的峰面积(/103)为纵坐标进行线性回归。连续测定3分析批次。
2.5.3 精密度、准确性试验 日内精密度:按标准曲线项下操作,配制补骨脂酚浓度为46.320,23.160,3.747ng/mL的高、中、低三种不同浓度的犬血浆样品,按“2.4血浆样品的处理方法”项下操作,HPLC分析,记录补骨脂酚的峰面积,代入随行标准曲线中求算浓度。一天内每个浓度各做5份。
日间精密度:按日内精密度项下操作,每天将补骨脂酚的高、中、低三种不同浓度的血浆样品各做5份,按“2.4 血浆样品的处理方法”项下操作,HPLC分析,记录补骨脂酚的峰面积,代入随行标准曲线中求算浓度,连续测定3天。
2.5.4 提取回收率的测定 取1.5mL的离心管,加入200μL的空白犬血浆,精密吸取50μL的补骨脂酚工作液,配制补骨脂酚浓度为46.320,23.160,3.747ng/mL的高、中、低三种不同浓度的犬血浆样品各5份,加入1mL乙酸乙酯,涡旋1min,静置5min,将样品置于离心机中,4℃下14000 rpm离心10min,移取上层有机相至干净的1.5mL离心管中,于40℃水浴,空气吹干。残渣加入100μL甲醇,涡旋混匀器上震荡2min,超声5min,将溶解液置于离心机中,4℃下14000 rpm离心5min,取上清液10μL注入HPLC色谱仪,记录补骨脂酚的峰面积(As0)。
另取1.5mL的离心管,精密吸取不同量的补骨脂酚工作液,配制补骨脂酚浓度为46.320,23.160,3.747ng/mL的高、中、低三种不同浓度的样品,涡旋混匀,于40℃水浴,空气吹干。残渣加入100μL甲醇,涡旋混匀器上震荡2min,超声5min,将溶解液置于离心机中,4℃下14000 rpm离心5min,取上清液10μL注入HPLC色谱仪,记录补骨脂酚的峰面积(As1),按下式计算样品提取回收率:
回收率 /%=(As0)/(As1)×100%
2.5.5 稳定性试验 按标准曲线项下操作,配制含补骨脂酚浓度为23.160ng/mL的中浓度犬血浆样品,其中3份中浓度的犬血浆样品室温下放置4h,按“2.4血浆样品的处理方法”项下操作,进行HPLC分析;其中3份中浓度的犬血浆样品室温下放置8h,按“2.4血浆样品的处理方法”项下操作,进行HPLC分析;其中3份中浓度的犬血浆样品置于-20℃冰箱24h后,用37℃的水化冻,按“2.4血浆样品的处理方法”项下操作,进行HPLC分析;其中3份中浓度的犬血浆样品置于-20℃冰箱每24h,用37℃的水化冻3次,按“2.4血浆样品的处理方法”项下操作,进行HPLC分析;另外也进行处理样品在20℃下自动进样器样品盘中放置0h和24h的稳定性。
2.6 补骨脂酚犬血浆中移行情况研究
2.6.1 补骨脂缓释片的制备 补骨脂酚固体分散体的制备:按处方补骨脂酚∶PVP∶磷脂=1∶2∶0.5,依下列步骤将补骨脂酚制备成固体分散体。
补骨脂酚缓释片的制备:依下列步骤将补骨脂酚固体分散体制备成缓释片。

包衣液的配置:包衣液HPMC∶PEG∶IV丙烯酸树脂∶乙醇∶水=2.5∶0.7∶4∶75.8∶18。


2.6.2 动物 Beagle犬6只,普通级,雌雄各半,体质量(10.12±0.5868)kg,购自北京玛斯生物技术有限公司提供,生产许可证:SCXK(京)2011-0003;质量合格证明:11400600000228。
2.6.3 给药剂量的选择 结合补骨脂的药理作用、药材中的补骨脂酚含量及补骨脂在临床上的用药剂量(6~9g/60kg),经过预试验,补骨脂酚缓释片犬给药的剂量为:每只犬给予1片,每片含补骨脂酚120mg。
2.6.4 给药与取样 试验过程遵循实验动物饲养和使用的相关规定。试验前犬饲养于恒温恒湿动物房中,给药前自由摄食、摄水。Beagle犬6只,给药前均禁食12h,灌胃给药。于给药前、后0.0833、0.25、0.5、0.75、1、2、3、5、7、10、12、15、24h前肢静脉采血 2 mL左右于真空采血管中,4000 rpm离5min,分离出血浆,于-20℃保存待测。按上述所建立的血浆样品处理方法处理血浆样品,经HPLC法测定各时间点的补骨脂酚的药物浓度。
3 结果
3.1 方法学验证
3.1.1 专属性试验 在上述检测条件和血浆样品处理方法下,犬血浆中内源性物质不干扰生物样品的出峰,基线噪音小,见图1。
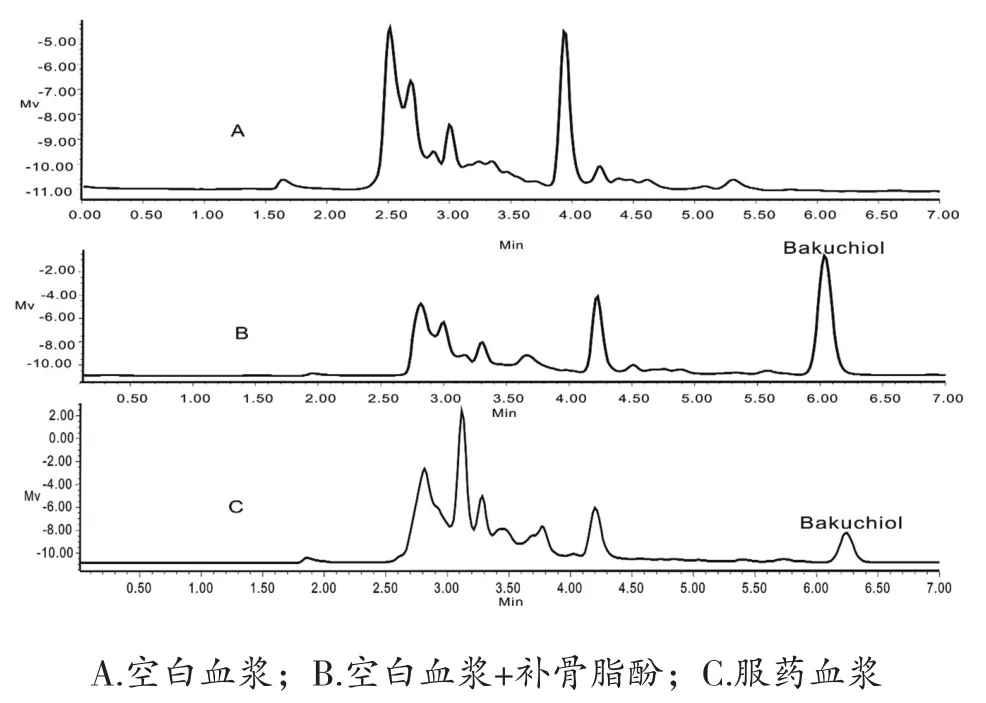
图1 Beagle犬血浆样品中补骨脂酚典型色谱图
3.1.2 标准曲线、定量下限 共进行了3分析批的空白犬血浆标准曲线,其平均线性回归方程如下:Y= 0.6871X-0.5295(r=0.9992)。利用本法测得犬血浆中补骨脂酚的最低定量限为1.737 ng/mL(S/N>10)。
3.1.3 精密度与准确度 低、中、高三个浓度样品的日内、日间精密度与准确度结果见表1,符合药代动力学研究要求。
表1 精密度与准确度(,n = 7)
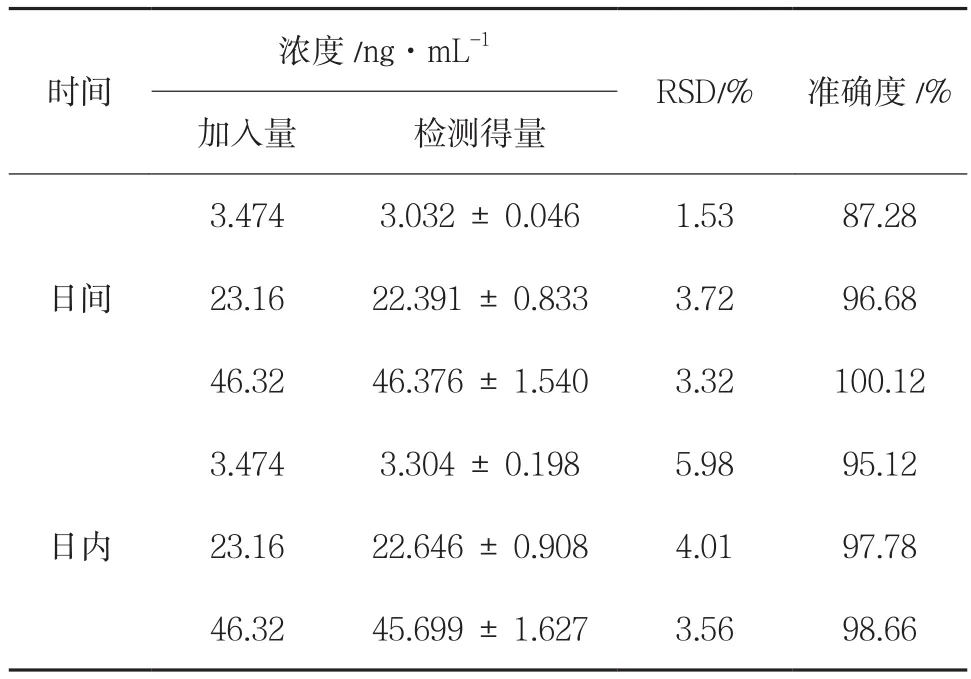
表1 精密度与准确度(,n = 7)
时间浓度/ng·mL-1 RSD/% 准确度/%加入量 检测得量日间3.474 3.032 ± 0.046 1.53 87.28 23.16 22.391 ± 0.833 3.72 96.68 46.32 46.376 ± 1.540 3.32 100.12日内3.474 3.304 ± 0.198 5.98 95.12 23.16 22.646 ± 0.908 4.01 97.78 46.32 45.699 ± 1.627 3.56 98.66
3.1.4 提取回收率 HPLC分析测试结果见表2,表明补骨脂酚在血浆中提取回收率稳定,符合药代动力学研究要求。

表2 提取回收率(n = 5)
3.1.5 样品稳定性 犬血浆样品稳定性结果见表3,血浆样品在不同条件下的准确度在之间,精密度小于,符合药代动力学测定要求,表明犬血浆样品在不同条件下放置稳定。
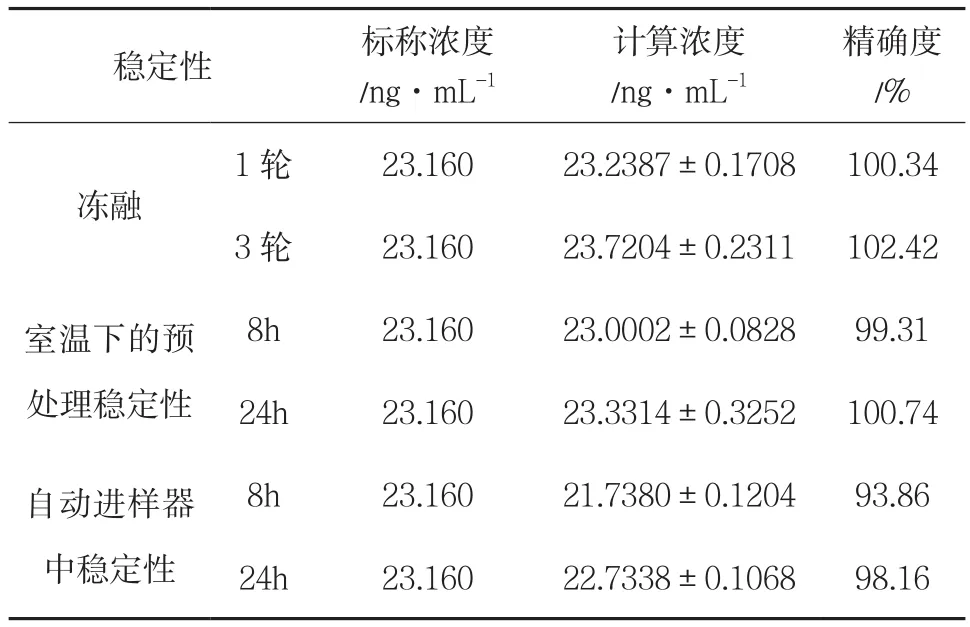
表3 稳定性(n = 3)
4 讨论
4.1 紫外检测波长的选择 以甲醇为溶剂,对补骨脂酚进行紫外扫描,发现其在260nm处有最大吸收,所以将检测波长定为260nm。
4.2 色谱条件的选择 本试验考察了不同洗脱系统及是否加酸对生物样品中补骨脂酚色谱行为的影响。比较了补骨脂酚在甲醇-水系统和乙腈-水系统下的分离状况,发现补骨脂酚在这两种系统下都能得到很好的分析,无背景噪音干扰,但因甲醇-水系统较为经济实惠,故本试验选择了甲醇-水作为洗脱系统。结果见图1。
补骨脂酚结构中含有酚羟基,显弱酸性,在洗脱系统加入一定量的酸,将有助于色谱行为的改善。本试验选择了0.2%冰醋酸作为修饰剂,色谱峰峰形得到明显改善。
4.3 血浆样品的制备 生物样品数量较多,故建立一种简便、经济、快速的处理方法非常有必要。本试验采用乙酸乙酯液液萃取法处理血浆样品。预试验结果发现蛋白沉淀法也能使分析物有高的回收率(90%),但是其背景噪音较大,满足不了本试验检测限的要求。
内标化合物的引入对减少生物样品分析的误差,保证分析的准确非常重要。本试验也考察了不同内标化合物(丹参酮ⅡA、大黄素、大黄酸、大黄酚、大黄素甲醚)对分析的影响,结果所考察化合物因在本试验色谱条件下的保留时间不合适,内源性物质对所选内标化合物的干扰或理化性质不适宜而被启用,最终本试验未采用内标定量,直接用补骨脂酚以外标法进行分析。
4.4 隔室模型拟和及结果 用药动学程序对表4所列数据进行处理,计算相关参数。本文根据AIC、F检验共同来判断房室模型。判断方法为对于同一权重,当检验无显著性差异时,选择房室数小者,当F有显著性差异时,选择AIC小者。结果补骨脂酚缓释片血药浓度拟合符合二室模型。
4.5 补骨脂酚Beagle 犬体内的药代动力学 Beagle犬给予补骨脂酚缓释片后,所测得的补骨脂酚的平均血药浓度-时间曲线见图2,从图可以看出自制补骨脂酚缓释片在犬体内表现为较好的缓释,不同时间点犬体内补骨脂酚的浓度见表4。以二室模型计算所得的各个药代参数见表5。
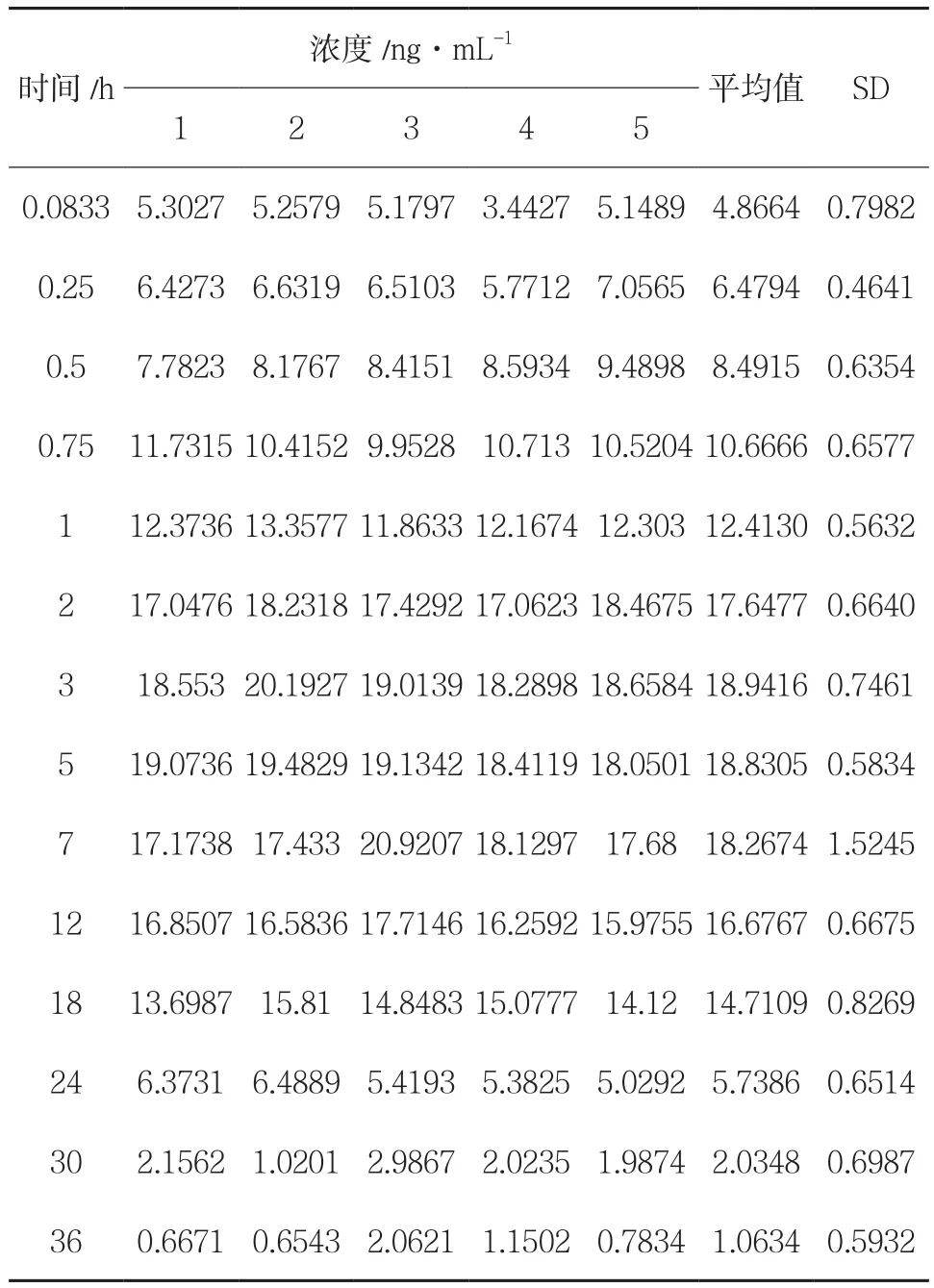
表4 不同时间点比格犬血浆中补骨脂酚的浓度(n = 5)
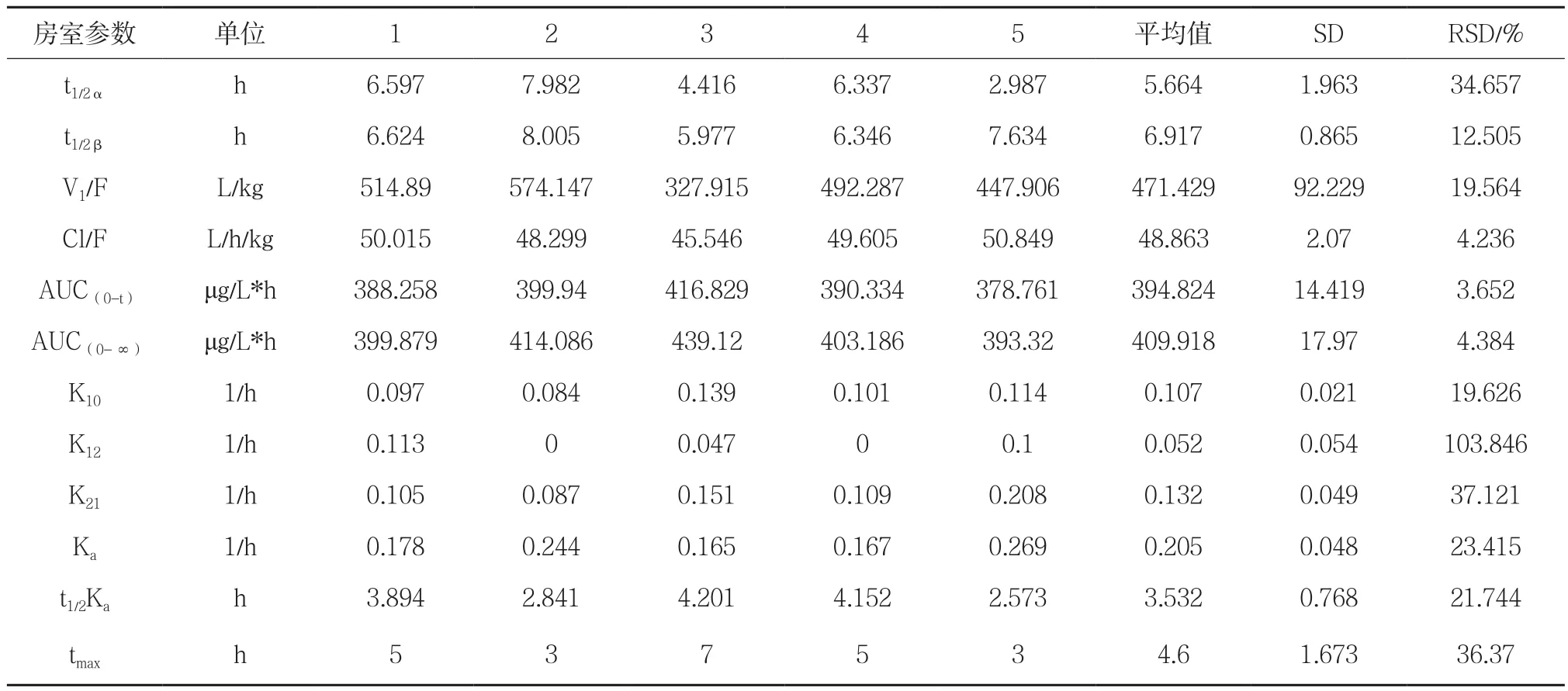
表5 药代动力学参数

图2 Beagle犬口服补骨脂酚缓释片后的补骨脂酚的血药浓度-时间曲线(n = 5)
5 小结
本试验建立了补骨脂酚在犬体内血浆药物浓度的HPLC检测方法,犬血浆中的内源性物质不干扰补骨脂酚的测定,线性关系良好,补骨脂酚的最低定量限为1.737ng/mL,回收率大于85%,高、中、低剂量组日内、日间差均小于6%,稳定性试验结果表明,补骨脂酚血浆样品在室温放置4h、8h,-20℃下冻存24h,-20℃下冻融3次,20℃下自动进样器样品盘中放置24h是稳定性。方法学研究结果表明,所建立的方法符合生物样品的测定要求。该方法被成功用于测定犬灌胃给药后24h体内补骨脂酚犬血浆中不同时间的移行浓度。
研究结果表明灌胃给予Beagle犬10mg/kg补骨脂酚部位后在4.6h后达到峰浓度,且补骨脂酚浓度在服用后2~18h内能较好地维持平稳的血药浓度,表明补骨脂酚在犬体内缓慢吸收。本研究为补骨脂酚相关制剂的临床前药动学研究提供了试验基础。

